




- 2022唐山高三上学期期末考试政治试题含解析 试卷 0 次下载
- 2022唐山高三上学期期末考试地理试题含解析 试卷 0 次下载
- 2022唐山高三上学期期末考试历史试题含解析 试卷 0 次下载
- 2022唐山高三上学期期末考试生物试题含解析 试卷 0 次下载
- 2022唐山高三上学期期末考试物理试题含解析 试卷 0 次下载
2022唐山高三上学期期末考试化学试题含解析
展开唐山市2021-2022学年度高三年级第一学期期末考试
化学
注意事项:
1.答卷前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Si-28 S-32 V-51 Cu-64 Zn-65 Pb-207
I卷(共43分)
一、单项选择题:本题共9小题,每小题3分,共27分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学与社会环境、科学技术密切相关,下列说法错误是
A. 工业中可利用反应Na(l)+KCl(l)K(g)+NaCl(l)来制取金属K
B. 油脂在碱性溶液中的水解反应称为皂化反应
C. 水玻璃是建筑行业常用的粘合剂
D. 自来水杀菌消毒可使用明矾
2. 下列物质名称或化学式错误的是
A. 胆矾:CuSO4·5H2O B. 漂白粉有效成分:Ca(ClO)2
C. 硬脂酸:C15H31COOH D. 酚醛树脂:
3. 关于非金属元素及其化合物的性质,下列说法正确的是
A. SiO2既能与HF反应又能与NaOH溶液反应,因此为两性氧化物
B. 工业上可用浓氨水检验氯气管道是否泄漏
C. S与足量的O2反应可生成SO3
D. 因为海水中氯的含量高,所以氯被称为“海洋元素”
4. NA是阿伏加德罗常数的值。下列说法正确的是
A. 78gNa2O2与足量CO2反应转移电子数为NA
B. pH=2的HCl溶液中,H+的数目为0.02NA
C. 18g2H2O分子中含有的电子数目为10NA
D. 标准状况下,将22.4L的NO与11.2L的O2混合可得NA个分子
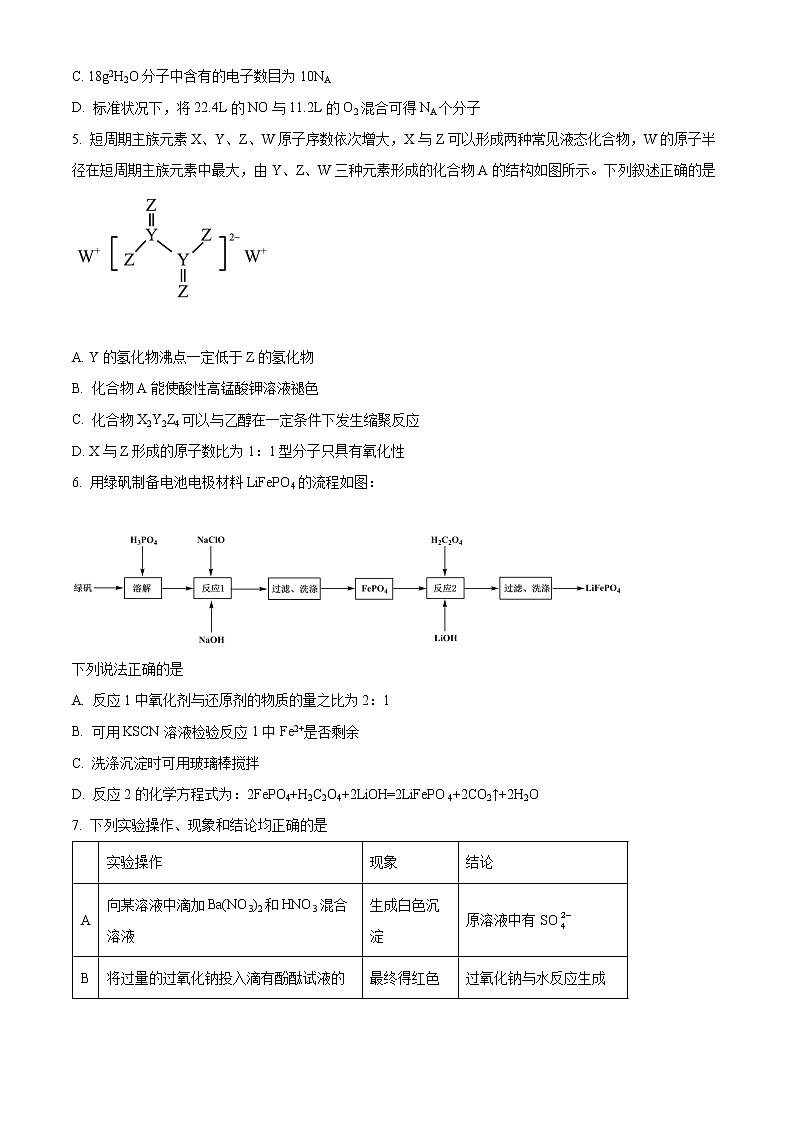
5. 短周期主族元素X、Y、Z、W原子序数依次增大,X与Z可以形成两种常见液态化合物,W的原子半径在短周期主族元素中最大,由Y、Z、W三种元素形成的化合物A的结构如图所示。下列叙述正确的是
A. Y的氢化物沸点一定低于Z的氢化物
B. 化合物A能使酸性高锰酸钾溶液褪色
C. 化合物X2Y2Z4可以与乙醇在一定条件下发生缩聚反应
D. X与Z形成的原子数比为1:1型分子只具有氧化性
6. 用绿矾制备电池电极材料LiFePO4的流程如图:
下列说法正确的是
A. 反应1中氧化剂与还原剂的物质的量之比为2:1
B. 可用KSCN溶液检验反应1中Fe2+是否剩余
C. 洗涤沉淀时可用玻璃棒搅拌
D. 反应2的化学方程式为:2FePO4+H2C2O4+2LiOH=2LiFePO4+2CO2↑+2H2O
7. 下列实验操作、现象和结论均正确的是
| 实验操作 | 现象 | 结论 |
A | 向某溶液中滴加Ba(NO3)2和HNO3混合溶液 | 生成白色沉淀 | 原溶液中有SO |
B | 将过量的过氧化钠投入滴有酚酞试液的水中 | 最终得红色溶液 | 过氧化钠与水反应生成碱性物质 |
C | 将H2在充满Cl2的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2化合生成HCl |
D | 向浓度均为0.1mol·L-1NaCl和NaI的混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
A. A B. B C. C D. D
8. 香豆素—3—羧酸的结构简式如图所示,下列说法错误的是
A. 分子式为C10H6O4
B. 1mol该有机物最多消耗3molNaOH
C 分子中含有官能团只有羧基、酯基
D. 该分子中所有原子可能共面
9. 已知Ka(HClO)=3.0×10-8,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11,下列说法错误的是
A. 向0.1mol·L-1的NaClO溶液中加水稀释,增大
B. 向NaClO溶液中通HCl气体至中性,c(Na+)+c(H+)=c(OH-)+c(ClO-)
C. 等物质的量浓度的NaClO溶液与NaHCO3溶液,前者碱性强
D. 向氯水中加入稍过量碳酸氢钠粉末,溶液漂白性增强
二、不定项选择题:本题共4小题,每小题4分,共16分。在每小题给出的四个选项中,有一项或两项符合题目要求。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题得0分。
10. 下列离子方程式正确的是
A. 将少量SO2通入NaClO溶液中:SO2+2ClO-+H2O=2HClO+SO
B. AlCl3溶液中滴加过量的氨水:Al++3NH3·H2O=Al(OH)3↓+3NH
C. 向NaHCO3溶液中滴入少量澄清石灰水:HCO+Ca2++OH-=CaCO3↓+H2O
D. 向FeBr2溶液中通入等物质的量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
11. 向含xmolHNO3和ymolH2SO4的混合稀溶液中缓慢加入铁粉,其氧化产物与所加铁粉的物质的量关系如图所示:
下列有关说法正确的是
A. x=0.2,y=0.1
B. a点之前的反应离子方程式为3Fe+8H++2NO=3Fe2++2NO↑+4H2O
C. 向b点所得溶液中加入Cu粉,最多可溶解1.92g
D. 反应至c点,可收集到气体4.48L(标准状况)
12. 顺—1,2—二甲基环丙烷(g)和反—1,2—二甲基环丙烷(g)可发生如图转化:
该反应的速率方程可表示为:v正=k正·c顺和v逆=k逆·c反,k正和k逆在一定温度时为常数,分别为正、逆反应速率常数。T1温度下,k正=0.006,k逆=0.002。下列说法错误的是
A. T1温度下,反应的平衡常数K=3
B. 温度升高,k正和k逆均增大
C. 若该转化过程为吸热反应,则活化能Ea(正)>Ea(逆)
D. 在恒容的密闭容器中,若压强不再变化则达到平衡状态
13. 一种新型Zn—PbO2电池结构示意图如图,电池由三个不同区域(A、B、C)组成,所用电解质分别为KOH、K2SO4和H2SO4,不同区域由离子交换膜(a、b)隔开。关于该电池,下列说法正确的是
A. Zn为电池的负极,发生的电极反应为:Zn-2e-+4OH-=Zn(OH)
B. a、b隔膜分别为阴离子交换膜和阳离子交换膜
C. 电池中消耗6.5gZn,理论上PbO2电极应增重6.4g
D. Zn-PbO2电池与传统铅酸蓄电池相比较,输出电压更低
II卷(共57分)
三、非选择题:共57分。第14~16题为必考题,每个试题考生都必须作答。第17~18题为选考题,考生根据要求作答。
(一)必考题:共42分。
14. 唐山是拥有石煤资源的地区之一,工业上常以伴生钒的石煤(主要成分为V2O3、V2O5,含少量P2O5、SiO2等杂质)为原料制备钒,工业流程如图:
已知:①NH4VO3难溶于水。
②Ksp(MgSiO3)=2.4×10-15,Ksp[(Mg3(PO4)2=2.7×10-27。
回答下列问题:
(1)焙烧:通入空气的条件下向石煤中加纯碱焙烧,写出将V2O3转化为NaVO3的化学反应方程式______。
(2)除硅、磷:滤渣1的成分是______(写化学式),溶液中离子浓度小于1.0×10-5 mol/L认为沉淀完全,除硅、磷后溶液中c(Mg2+)最小为______。
(3)沉钒:该操作产生的滤液中两种主要的溶质阴离子是______(写离子符号);依次检验该滤液中两种阴离子方法是______。
(4)灼烧:在灼烧NH4VO3的过程中,固体残留率随温度变化的曲线如图所示,则0℃~210℃,发生反应的化学方程式为______。
(5)还原:在高温真空条件下,用过量焦炭还原V2O5可以生成钒单质,该反应的化学方程式为______。
15. 氯化钴(CoCl2)主要用于电解制备金属钴,还可用作氨的吸收剂、防毒面具和肥料添加剂。某实验小组制备无水氯化钴的装置如图所示。已知:Co(III)的氧化性强于Cl2,CoCl2易潮解。
(1)装置A烧瓶中的固体为84消毒液中的有效成分,则A装置中发生反应的离子方程式为______。
(2)装置B中盛放试剂为______,装置D硬质玻璃管中的玻璃纤维的作用是______。
(3)E中物质的名称______,其作用是______。
(4)实验过程应先打开分液漏斗旋塞,一段时间后再点燃酒精灯,目的是______。
(5)小组成员认为实验过程中Cl2过量,装置D中所得固体可能会有CoCl3,你是否同意该论断并解释原因是______。
(6)氯化钴溶液与氯化镁溶液类似,直接蒸干不能得到CoCl2固体,使用氯化亚砜(SOCl2)与CoCl2·6H2O混合加热可以得到氯化钴固体,原理是______。
16. 在碳达峰、碳中和的国家战略下,工业生产废气和汽车尾气中的NOx和CO的减排及有效处理,显得尤为重要。
(1)在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH。
已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-144kJ·mol-1,
2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1,
N2(g)+2O2(g)=2NO2(g) ΔH3=-66kJ·mol-1。
则ΔH=______,该反应在______(填“高温”、“低温”或“任何温度”)下能自发进行。
(2)用金作催化剂,CO(g)+H2O(g)CO2(g)+H2(g)的反应历程如图所示,其中吸附在金催化剂表面上的微粒用“•”标注。该历程中最大能垒E正=______eV,写出该步骤的化学方程式______。
(3)将相同量的NO和CO分别充入盛有催化剂①和②的体积相同的密闭容器,进行反应2NO(g)+2CO(g)N2(g)+2CO2(g),经过相同时间内测量两容器中NO的含量,从而确定NO的转化率,结果如图所示。图像中c点是否一定是平衡状态并说明理由______。
(4)在另一温度下,关闭K,向A容器中充入1molNO和2molCO,向B容器中充入1.5molNO和3molCO,两容器均发生反应2NO(g)+2CO(g)N2(g)+2CO2(g)。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为0.9aL,则容器A和B中NO的转化率A______B(填“>”、“<”或“=”)。维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为______L(不考虑温度的变化,P为可自由滑动话塞)。则该温度下,2NO(g)+2CO(g)N2(g)+2CO2(g)的浓度平衡常数K=______。
(二)选考题:共15分。请考生从2道题中任选一题作答,并用2B铅笔将答题卡上所选题目对应的题号方框涂黑,按所涂题号进行评分:多涂、多答,按所涂的首题进行评分:不涂,按本选考题的首题进行评分。
17. 磷被首次发现存在于恒星爆炸后的宇宙残余物里。它是在深空发现的两大元素之一,可能给科学家提供有关生命在宇宙里的可能性的线索。磷至少有10种同素异形体,其中主要的是白磷、红磷和黑磷三种。回答下列问题:
(1)基态磷原子最外层成单电子数与成对电子数之比为______。
(2)白磷晶体是由P4分子()组成的分子晶体,P4分子中键角为______。白磷以P4形式存在,而氮以N2形式存在的原因是_________,已知有关氮、磷的单键和叁键的键能(kJ·mol-1)如表:
N—N | N≡N | P—P | P≡P |
193 | 946 | 197 | 489 |
(3)白磷隔绝空气加热到533K转化为红磷,它是一种暗红色粉末。红磷的结构为,磷原子的杂化方式为______,______溶于CS2(填“难”或“易”)。
(4)黑磷是磷的一种最稳定的同素异形体,其具有类似于石墨的片状结构(如图),片状结构间通过______相结合。
(5)磷有多种含氧酸,磷酸是其中一种,磷酸通过分子间脱水缩合形成多磷酸,如:
++
若4个磷酸分子间脱水形成环状的多磷酸,则该多磷酸的分子式可写成______。
(6)磷的卤化物有PX3和PX5两种类型,其中PCl5是白色固体,在气态和液态时PCl5以分子形态存在,固态时PCl5不再保持该结构,而形成离子型晶体。晶胞中含有正四面体的[PCl4]+和正八面体的______离子,其晶胞结构最合理的是______(填序号)。
A. B. C. D.
18. 双环有机物I()是重要的有机合成过程的中间体,某种合成该有机物的过程如图所示,请回答下列问题:
已知:RBrRMgBr (R、R1、R2为烷烃基)
(1)若有机物A的核磁共振氢谱中只有1个峰,则有机物A的名称为______。
(2)F转化有机反应类型为______,HI转化的反应条件为______。
(3)写出DE的化学反应方程式______。
(4)双环有机物I中共平面的碳原子数最多为______,有机物I存在多种同分异构体,属于苯的同系物的同分异构体个数为______。
(5)参照合成路线中的相关信息,设计由及甲苯合成的路线(无机试剂任选)______。
2024届唐山高三上学期期末考试化学试题+答案: 这是一份2024届唐山高三上学期期末考试化学试题+答案,文件包含唐山2023-2024学年高三年级上学期期末考试化学试题pdf、唐山20232024学年度高三年级第一学期期末考试化学参考答案pdf等2份试卷配套教学资源,其中试卷共6页, 欢迎下载使用。
2022-2023学年河北省唐山市高一上学期期末考试化学试题含解析: 这是一份2022-2023学年河北省唐山市高一上学期期末考试化学试题含解析,共21页。试卷主要包含了单选题,多选题,实验题,填空题,元素或物质推断题,计算题等内容,欢迎下载使用。
2021-2022学年河北省唐山市高三上学期期末考试化学试题含解析: 这是一份2021-2022学年河北省唐山市高三上学期期末考试化学试题含解析,共27页。试卷主要包含了 NA是阿伏加德罗常数的值,02NA, 已知Ka=3等内容,欢迎下载使用。












