





高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质教学演示课件ppt
展开理解共价键的极性、分子的空间结构与分子极性的关系。2.学会判断简单分子极性的方法。
成键原子带部分正电荷、部分负电荷。
H—I H—Br H—Cl H—F
成键元素电负性值差异越大,共价键的极性越强。
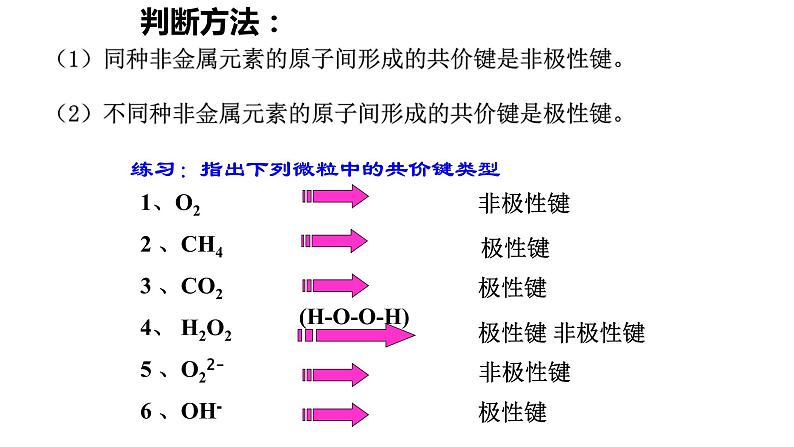
(1)同种非金属元素的原子间形成的共价键是非极性键。
(2)不同种非金属元素的原子间形成的共价键是极性键。
练习:指出下列微粒中的共价键类型
1、O22 、CH43 、CO24、 H2O25 、O22-6 、OH-
分子的极性又是根据什么来判定呢?
一、极性分子与非极性分子
分子呈电中性,可以设想:它的全部正电荷集中于一点,叫正电荷重心它的全部负电荷集中于一点,叫负电荷重心
若,正电荷重心与负电荷重心
重合的分子——非极性分子
不相重合的分子——极性分子
二、键的极性和分子的极性
取决于成键原子之间的共价键是否有极性
A-B型分子(HCl ):异核双原子分子都是极性分子A-A型分子(Cl2):同核双原子分子是非极性分子同核多原子分子也有非极性分子,如:P4,C60、S8 、B12
特别注意:O3(V型)是极性分子
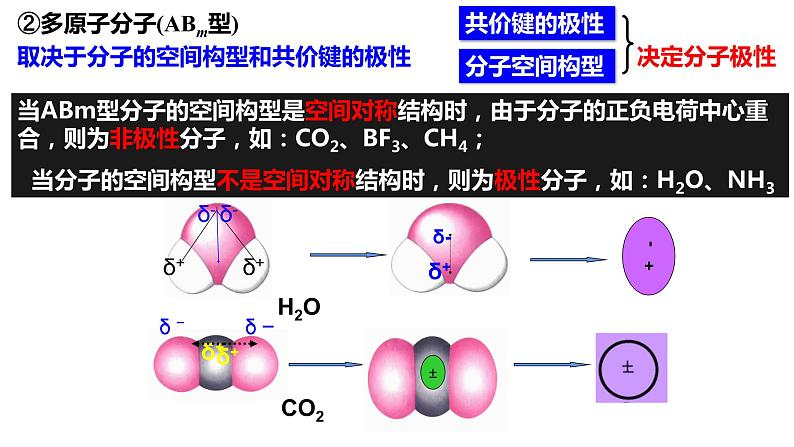
②多原子分子(ABm型)
取决于分子的空间构型和共价键的极性
当ABm型分子的空间构型是空间对称结构时,由于分子的正负电荷中心重合,则为非极性分子,如:CO2、BF3、CH4; 当分子的空间构型不是空间对称结构时,则为极性分子,如:H2O、NH3
若中心原子A的化合价的绝对值等于该元素原子的最外层电子数(价电子数),则为非极性分子,若不等则为极性分子。
经验规律:化合价法判断ABn型分子的极性
键的极性与分子的极性的关系:
双原子分子,如: HCl NO HBr
V型分子,如:H2O SO2 H2S
三角锥形分子,如:NH3 PH3
非正四面体,如:CH2Cl2 CH3Cl
单质分子,如:Cl2 N2 P4
直线型分子,如:CO2 CS2 C2H2
平面三角形分子,如:BF3 BCl3
正四面体型分子,如:CH4 CF4
1. 下列叙述中正确的是( )A.极性分子一定含有极性键。B.含有极性键的分子一定是极性分子。C.含有非极性键的分子一定是非极性分子。D.非极性分子中一定含有非极性键。
极性分子HCl、H2O等,非极性分子CO2、CCl4等,均含极性键
极性分子CH3CH2OH等,含极性键和非极性键
非极性分子CO2、CCl4等,均含极性键
2、下列叙述正确的是( ) A.含有极性键的分子是极性分子 B.分子中一定含有共价键 C.只含有非极性键的分子一定是非极性分子 D.非极性分子中一定含有非极性键
4、常温条件下三氯化氮(NCl3)是一种淡黄色液体,以下关于NCl3的说法中正确的是( ) A.分子中N-Cl键是非极性键 B.分子中不存在孤对电子 C.三氯化氮分子结构呈三角锥形 D. 三氯化氮分子是非极性分子
3、下列各组分子中,都属于含极性键的非极性分子的是( ) CO2和H2S B.C2H4和CH4 C. Cl2和C2H2 D.NH3和HCl
5、有个同学在研究CO2、BF3、CCl4、NH3、H2S等ABn型分子的极性时发现,CO2、BF3、CCl4是非极性分子,NH3、H2S是极性分子,由此他猜测ABn型分子是非极性分子的经验规律,你认为合理的是( ) A.所有原子都在同一平面内 B.分子中不含氢原子 C.在ABn中A原子没有孤对电子 D.分子内A原子最外层为8电子结构
若中心原子有孤对电子(未参与成键的电子对)则为极性分子,若无孤对电子则为非极性分子。
结论:由同种元素组成的非金属单质分子不一定 是非极性分子。
7. 由极性键结合的一组分子都为非极性分子的是( )A.O2、H2、N2、P4、C60B.HCl、HBr、CO、NOC.H2O、H2S、NH3、PCl3D.CO2、CS2、CH4、CCl4
空间结构对称分子为非极性分子
高中化学人教版 (2019)选择性必修2第一节 共价键授课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第一节 共价键授课ppt课件,共27页。
高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质教课内容ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质教课内容ppt课件,共57页。PPT课件主要包含了知识点一,共价键的极性,呈电中性,知识点二,随堂练学以致用,Cl2,C2H4,H2O2,课后测素养评价,CHO等内容,欢迎下载使用。
化学人教版 (2019)第一节 共价键精品ppt课件: 这是一份化学人教版 (2019)第一节 共价键精品ppt课件,文件包含第二章第三节第1课时共价键的极性pptx、极性分子swf、非极性分子swf等3份课件配套教学资源,其中PPT共50页, 欢迎下载使用。













