


(通用版)高考化学一轮复习课件第四章非金属及其化合物第4节考点2氨和铵盐 (含解析)
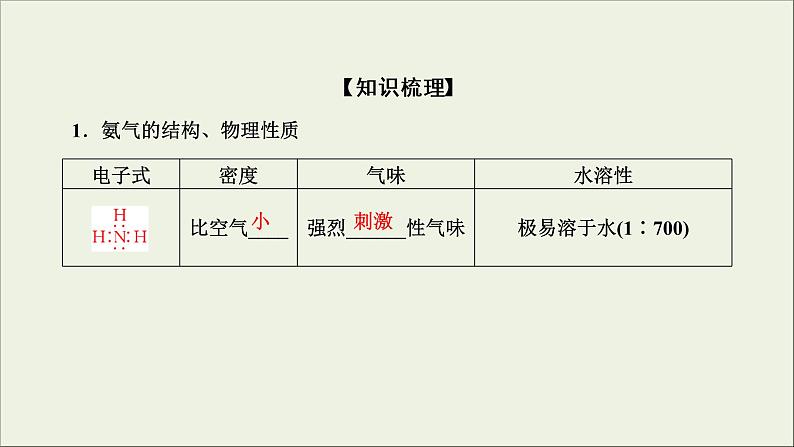
展开1.氨气的结构、物理性质
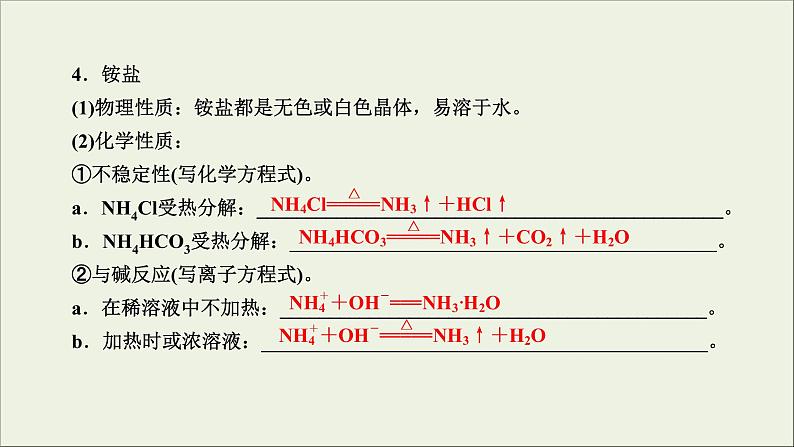
4.铵盐(1)物理性质:铵盐都是无色或白色晶体,易溶于水。(2)化学性质:①不稳定性(写化学方程式)。a.NH4Cl受热分解:_______________________________________________。b.NH4HCO3受热分解:___________________________________________。②与碱反应(写离子方程式)。a.在稀溶液中不加热:___________________________________________。b.加热时或浓溶液:_____________________________________________。
1.判断正误(正确的画“√”,错误的画“×”)。(1)NH4HCO3受热易分解,故可用作氮肥( )(2)液氨制冷、碘的升华、NH4Cl气化都不涉及化学变化( )(3)能用加热法除去NaCl中的NH4Cl的原因是NH4Cl为强酸弱碱盐( )(4)氨水具有弱碱性,说明氨水是弱电解质( )(5)氨水中微粒种类与NH4Cl溶液中的微粒种类相同( )
【答案】(1)浓氨水、氢氧化钠固体、碱石灰 ①③⑥或①③⑦(2)若漏斗下端边沿与液面接触部分溶液颜色变为红色,说明已收集满NH3(3)气球逐渐变大
1.(2018·湖南衡阳月考)如图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )
氨气和铵盐的性质及应用★★★
【答案】A【解析】NH3能与HCl发生化合反应,生成NH4Cl白色固体,NH3也能与H2SO4发生化合反应,生成(NH4)2SO4,A项正确,B项错误;NH3与氯化物溶液反应生成氢氧化物沉淀,该氯化物可以是氯化铝、氯化镁等,C项错误;NH3溶于水生成NH3·H2O,NH3·H2O属于碱,NH3不属于碱,D项错误。
2.探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水B.将pH=11的氨水稀释1 000倍,测得pH>8,说明NH3·H2O为弱碱
C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定D.将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2【答案】D
【解析】 氨气极易溶于水,使试管内压强迅速降低,液体迅速充满试管,A项正确;强碱稀释10n倍,pH减小n个单位,而将pH=11的氨水稀释1 000倍,测得pH>8,说明氨水为弱碱,B项正确;加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明碳酸氢铵受热分解,不稳定,C项正确;氨气催化氧化生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,D项错误。
3.(2019·湖南邵阳月考)下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )A.①②B.②③ C.③④D.①③ 【答案】D
氨气的实验室制法★★★★
【解析】①NH4Cl固体受热可产生NH3和HCl,但两者遇冷会重新凝结产生NH4Cl固体,且可能出现堵塞导管的情况,③中试管口未向下倾斜会导致水倒流到试管底部而使试管破裂,故①③错误;②把浓氨水滴入氧化钙固体中,会发生反应CaO+NH3·H2O===Ca(OH)2+NH3↑,反应放热,温度升高有利于NH3放出,④浓氨水受热产生氨气,通过碱石灰吸收水蒸气后即得干燥的NH3,故②④正确。
4.某学习兴趣小组探究氨气的制取实验:(1)甲同学拟用下列实验方法制备氨气,其中合理的是________(填字母)。A.将氯化铵固体加热分解收集产生的气体B.将浓氨水滴入氢氧化钠固体中,收集产生的气体C.将碳酸氢铵加热分解产生的气体用碱石灰干燥D.将氯化铵稀溶液滴入氢氧化钠固体中,收集产生的气体
(2)根据上述正确的原理,该同学欲用下列常见的实验室制气装置制取氨气,适宜的装置是________。(3)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是____________(填序号)。①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(4)下图是甲同学设计收集氨气的几种装置,其中可行的是________,集气的原理是_______________________________________________________________。【答案】(1)BC (2)CD (3)②④ (4)d 利用氨气的密度小于空气,采用短管进氨气,长管出空气,即可收集氨气
实验室制取少量NH3的三种简易方法
5.如右图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实不相符的是( ) A.Cl2(饱和食盐水),无色喷泉B.NH3(H2O含石蕊),蓝色喷泉C.HCl(H2O含石蕊),红色喷泉D.SO2(NaOH溶液),无色喷泉【答案】A【解析】Cl2在饱和食盐水中溶解度很小,不能形成喷泉。
6.同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为( )A.①>② B.①<②C.①=② D.不能确定【答案】C
喷泉实验的原理及应用(1)喷泉实验的原理。使烧瓶内外在短时间内产生较大的压强差,利用大气压将烧瓶下面烧杯中的液体压入烧瓶内,在尖嘴导管口形成喷泉。(2)形成喷泉的常见类型。
7.(2016·全国卷Ⅰ,26) 氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:(1)氨气的制备:①氨气的发生装置可以选择上图中的______,反应的化学方程式为_________________________________。
氨气的制法与性质实验综合题★★★
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为发生装置→______________(按气流方向,用小写字母表示)。(2)氨气与二氧化氮的反应:将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
8.某化学自主实验小组通过实验探究NH3、NO2的性质。探究Ⅰ:利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。(1)A装置中制取NH3的化学方程式是_________________________________。(2)甲、乙分别是________(填字母)。a.浓硫酸、碱石灰 b.碱石灰、碱石灰c.碱石灰、无水氯化钙 d.五氧化二磷、五氧化二磷
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是_________________。(4)此实验装置存在一个明显的缺陷是__________________________________。探究Ⅱ:探究NO2、O2混合气体的喷泉实验。(5)请在G装置中的虚线上描出导管实线图。
(6)G装置中浓硫酸有三种作用:混合NO2、O2气体;干燥NO2、O2;________。(7)将G装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体全部被吸收,则所得溶液物质的量浓度为____ml/L(假设为标准状况,保留两位有效数字)。
第24讲 氨和铵盐-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第24讲 氨和铵盐-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共45页。PPT课件主要包含了复习目标,考点一,必备知识,喷泉实验,②形成喷泉的常见组合,溶于水,归纳提升,易错辨析,专项突破,氨的化学性质归纳等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第4章 第23讲 氨和铵盐: 这是一份2024年高考化学一轮复习课件(鲁科版)第4章 第23讲 氨和铵盐,文件包含第4章第23讲氨和铵盐pptx、第4章第23练氨和铵盐docx、第4章第23讲氨和铵盐docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
2020版高考化学一轮复习考点备考课件4.4.3氨铵盐 (含解析): 这是一份2020版高考化学一轮复习考点备考课件4.4.3氨铵盐 (含解析),共10页。PPT课件主要包含了速查速测,无因果关系,典例剖析,放热反应温度升高,-2价,反思归纳,氨气制取装置创新考查,试题备选等内容,欢迎下载使用。