




2023届山东化学高三一轮复习《镁、铝及其化合物》 课件
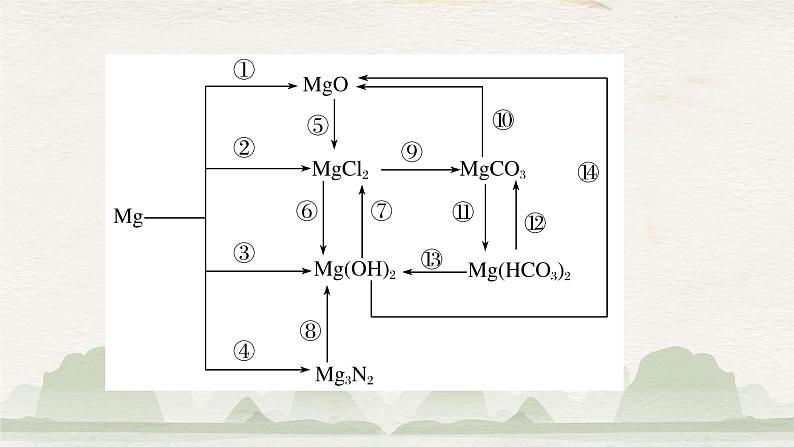
展开知识主线Mg―→MgO―→Mg(OH)2―→
1.镁的存在自然界中的镁主要以 的形式存在于地壳和海水中,海水中镁的总储量约为1.8×1015t。
2.镁的性质(1)物理性质:(2)化学性质:分别写出镁与①O2、②N2、③CO2、④H+溶液反应的化学方程式,是离子反应的写离子方程式:
具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电、传热和延展性。
(1)Mg在CO2中燃烧。(2)将Mg3N2放入水中。(3)将MgCl2与Na2CO3溶液混合(写离子方程式)。
2Mg+CO2点燃(=====)2MgO+C
Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑。
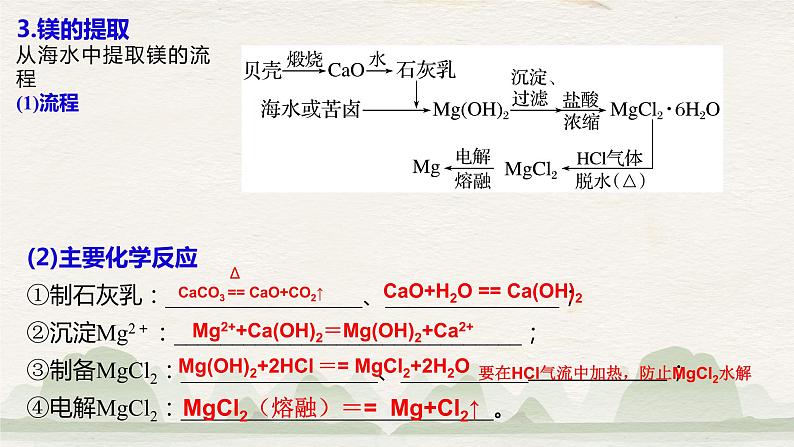
3.镁的提取从海水中提取镁的流程(1)流程
(2)主要化学反应①制石灰乳:_________________、_______________;②沉淀Mg2+:______________________________;③制备MgCl2:_________________、___________ ;④电解MgCl2:___________________________。
CaCO3 == CaO+CO2↑
CaO+H2O == Ca(OH)2
Mg2++Ca(OH)2=Mg(OH)2+Ca2+
Mg(OH)2+2HCl == MgCl2+2H2O
要在HCl气流中加热,防止MgCl2水解
MgCl2(熔融)== Mg+Cl2↑
1.铝的存在地壳中:铝在地壳中中的含量为8.2%,仅次于氧和硅,金属中排第1。主要矿石:铝土矿(Al2O3 ·nH2O) ,提取和冶炼铝的主要原料。还以硅铝酸盐的形式存在于各种矿物岩石中,如长石、云母、高岭土等。
铝的密度2.70 g/cm³,熔点:660.323℃。
铝接触空气,表面立即氧化生成一层致密的氧化膜,具有保护作用。
铝遇到冷的浓硫酸和浓硝酸发生钝化。
2Al2O3(熔融) == 4Al +3O2↑
冰晶石(Na3AlF6)降低AI2O3熔点
为何不用AlCl3冶炼铝?
——共价化合物,熔融态不导电
(4)当参加反应的HCl和NaOH的物质的量一样多时,产生H2的体积比是1∶3,而题设条件体积比为1∶2,说明此题投入的铝粉对盐酸来说是过量的,而对于NaOH来说是不足的。2Al + 6HCl === 2AlCl3+ 3H2↑ 6 ml 3 ml 3 ml·L-1×0.1 L 0.15 ml则Al与NaOH反应生成的H2为0.15 ml×2=0.3 ml。2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑2×27 g 3 ml5.4 g 0.3 ml即投入的铝粉为5.4 g。
铝热反应:铝与氧化铁(高温引发)反应, 反应剧烈放热,产生>3000℃ 的高温,生成熔融态的Fe:
用途:焊接钢轨、穿甲弹
广义的铝热反应:铝与(铝之后的)金属氧化物在高温引发条件下剧烈放热的反应。
3.氢氧化铝(1)物理性质:白色胶状不溶于水的固体。(2)化学性质: ①Al(OH)3的电离:
②③受热分解:___________________________。
Al(OH)3+3H+===Al3++3H2O
(3)制备:①向铝盐中加入氨水,离子方程式为____________________________________;②NaAlO2溶液中通入足量CO2,离子方程式为_________________________________;③NaAlO2溶液与AlCl3溶液混合:_____________________________________。
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
Al(OH)4-+CO2+2H2O=Al(OH)3↓+HCO3-
Al3++3Al(OH)4-=4Al(OH)3↓
4.常见的铝盐——明矾明矾的化学式为__________________,它是无色晶体,可溶于水,水溶液pH___7。明矾可以净水,其净水的原理是___________________________________,Al(OH)3胶体颗粒吸附杂质形成沉淀而净水。
KAl(SO4)2·12H2O
中学化学学习阶段接触到许多既能与酸反应又能与碱反应的物质,除了Al及其重要化合物外,你还知道哪些?
①弱酸的铵盐,如:NH4HCO3、CH3COONH4、(NH4)2S等;②多元弱酸的酸式根离子强碱盐,如:NaHCO3、KHS、NaHSO3等;③氨基酸、蛋白质。
2.可溶性铝盐溶液与NaOH溶液反应的图像
3.偏铝酸盐溶液与盐酸反应的图像
4.借助数轴理解“铝三角”
3.铝的应用制造电线,导电性不如铜,资源丰富、密度小。铝合金应用于电讯器材、建筑设备、飞机和宇航器等方面。铝桶可用于装运浓硫酸、浓硝酸等。
主要原料:铝土矿(Al2O3 ·nH2O),含少量氧化铁和二氧化硅。
2024届高三化学一轮复习镁、铝及其重要化合物课件: 这是一份2024届高三化学一轮复习镁、铝及其重要化合物课件,共25页。PPT课件主要包含了答案C,海水提镁的工艺流程,答案D,氧化膜,坩埚钳,氧化铝为离子化合物,硼酸的酸性比碳酸弱,七水硫酸镁等内容,欢迎下载使用。
人教版高考化学一轮复习第3章金属及其化合物第2讲镁铝及其化合物课件: 这是一份人教版高考化学一轮复习第3章金属及其化合物第2讲镁铝及其化合物课件
2023届高三化学高考备考一轮复习 镁、铝及其化合物 课件: 这是一份2023届高三化学高考备考一轮复习 镁、铝及其化合物 课件












