





高考化学总复习12铝、镁及其重要化合物课件PPT
展开考试说明了解铝、镁及其重要化合物的主要性质和应用。
考点一 铝、镁的性质及应用
考点三 用数形结合思想理解“铝三角”
考点二 铝的重要化合物
考点四 化工生产中镁、铝及其化合物的化工流程
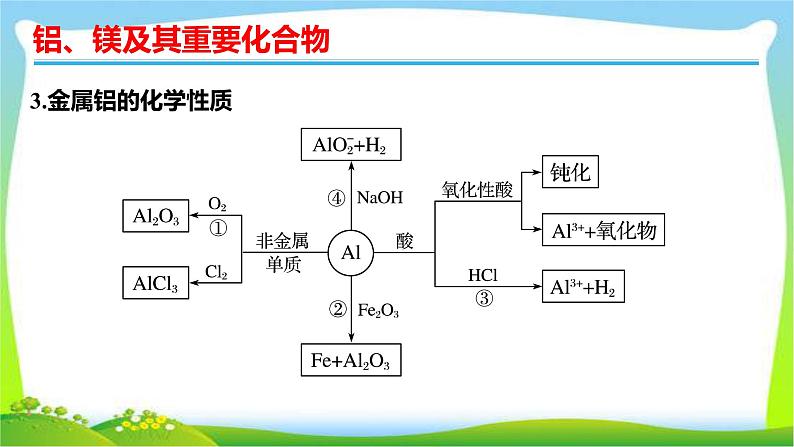
考点一 铝、镁的性质及应用1.铝的结构和存在铝位于元素周期表第三周期ⅢA族,原子结构示意图为 。铝是地壳中含量最多的金属元素。自然界中的铝全部以化合态的形式存在。2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
写出图中有关反应的化学方程式或离子方程式:①_____________________;②__________________________;③_________________________;④_________________________________。4.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
2Al+6H+===2Al3++3H2↑
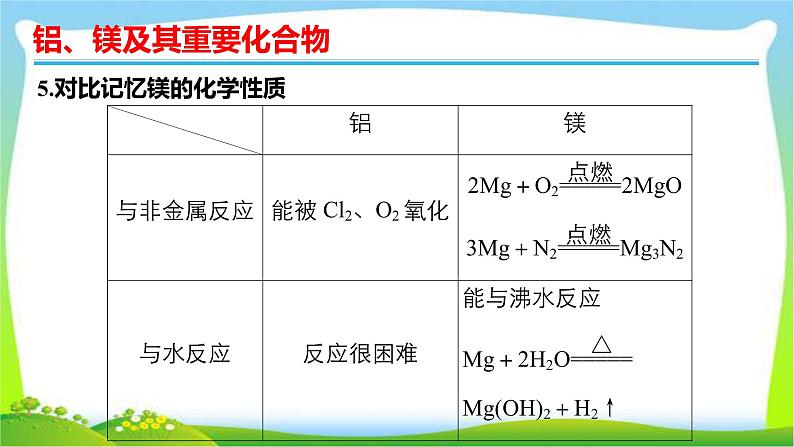
5.对比记忆镁的化学性质
例1.正误判断,正确的打“√”,错误的打“×”(1)铝在自然界中有游离态和化合态两种形式( )(2)MgO与Al粉的混合物也可称为铝热剂( )(3)Mg粉与浓NH4Cl溶液反应放出H2和NH3( )(4)冶炼铝时常用焦炭作还原剂( )(5)1 ml Al与足量的硫酸或足量的氢氧化钠溶液反应转移电子数相同( )(6)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐( )
例2.镁在空气中充分燃烧,所得固体产物可能有_________________(用化学式表示)。
MgO、Mg3N2、C
铝与酸或碱反应生成H2的量的关系2Al+6HCl===2AlCl3+3H2↑2Al+2NaOH+2H2O===2NaAlO2+3H2↑(1)等质量的铝与足量的盐酸、氢氧化钠溶液分别反应:①产生H2的物质的量相等。②消耗H+、OH-的物质的量之比为n(H+)∶n(OH-)=3∶1。(2)足量的铝分别与等物质的量的HCl和NaOH反应:①消耗Al的物质的量之比为1∶3。②生成H2的物质的量之比为1∶3。
考点二 铝的重要化合物1.氧化铝(1)物理性质:白色固体,难溶于水,有很高的熔点。(2)化学性质
2.氢氧化铝(1)物理性质白色胶状不溶于水的固体,有较强的 性。(2)化学性质(用化学方程式表示)Al(OH)3的电离方程式为
写出图中有关反应的化学方程式或离子方程式:①____________________________;②____________________________;③__________________________。
Al(OH)3+3H+===Al3++3H2O
KAl(SO4)2·12H2O
例1.在做铝的燃烧实验时,用坩埚钳夹住一小块铝箔,在酒精灯上加热至其熔化,会看到的现象是铝箔熔化,失去光泽,但熔化的铝并不滴落。原因是_________________________________________________________________________________________。
铝箔与O2发生反应生成熔点很高的Al2O3薄膜,使内部的铝被Al2O3包裹着,所以熔化的铝不易滴下
例2.中学化学学习阶段接触到许多既能与酸反应又能与碱反应的物质,除了Al及其重要化合物外,你还知道哪些?
①弱酸的铵盐,如:NH4HCO3、CH3COONH4、(NH4)2S等;②弱酸的酸式盐,如:NaHCO3、KHS、NaHSO3等;③氨基酸。
两性物质是指既能与酸反应又能与碱反应生成盐和水的化合物,上述物质中只有Al2O3、Al(OH)3、氨基酸是两性物质。
含铝杂质的提纯方法归类利用Al、Al2O3、Al(OH)3可溶于强碱的特性,可除去许多物质中的含铝杂质,如:(1)Mg(Al):加足量NaOH溶液。(2)Fe2O3(Al2O3):加足量NaOH溶液。(3)Mg(OH)2[Al(OH)3]:加足量NaOH溶液。(4)Mg2+(Al3+):加过量NaOH溶液,过滤,再加酸充分溶解。
写出实现上述各步转化的离子方程式。
2.与Al(OH)3沉淀生成有关的图像分析(1)可溶性铝盐溶液与NaOH溶液反应的图像(从上述转化关系中选择符合图像变化的离子方程式,下同)
(2)偏铝酸盐溶液与盐酸反应的图像
例1.按要求画出图像。(1)向MgCl2、AlCl3溶液中(假设各1 ml),逐滴加入NaOH溶液,画出沉淀的物质的量随NaOH溶液体积变化的图像。(2)向HCl、MgCl2、AlCl3、NH4Cl溶液中(假设各 1 ml),逐滴加入NaOH溶液,画出沉淀的物质的量随NaOH溶液体积变化的图像。
(3)向NaOH、NaAlO2溶液中(假设各1 ml),逐滴加入HCl溶液,画出沉淀的物质的量随HCl溶液体积变化的图像。
(4)向NaOH、Na2CO3、NaAlO2溶液中(假设各1 ml),逐滴加入HCl溶液,画出沉淀的物质的量随HCl溶液体积变化的图像。
(5)向NaOH、Ca(OH)2、NaAlO2溶液中(假设各1 ml),通入CO2气体,画出沉淀的物质的量随CO2通入的变化图像。
考点四 化工生产中镁、铝及其化合物的化工流程1.从海水中提取镁的流程(1)流程:
2.工业炼铝的流程铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,因而可设计出两种提纯氧化铝的方案。
方案一:碱溶法讨论回答下列问题:(1)写出①、③两步骤中可能发生反应的离子方程式。
(2)步骤③中不用盐酸(或H2SO4)酸化的理由是_________________________________________________________________________________________________________________________。
Al(OH)3具有两性,可溶于强酸,不易控制酸的量;CO2廉价而且生成的副产物NaHCO3用途广泛,经济效益好
因为AlO 与酸反应生成的
(3)步骤④中得到较纯的Al2O3,可能含有_____杂质,在电解时它不会影响铝的纯度的原因:________________________________________________________________________。
由于SiO2的熔点很高,在加热到1 000 ℃ 左右时不会熔化,因而不影响铝的纯度
讨论回答下列问题:(1)写出①、②中可能发生反应的离子方程式。
(2)步骤②中不用氨水沉淀Fe3+的原因:____________________________________________________________________。
Al(OH)3只能溶于强碱,不能溶
于氨水,用氨水不能将Fe(OH)3和Al(OH)3分离
2024届高三化学一轮复习镁、铝及其重要化合物课件: 这是一份2024届高三化学一轮复习镁、铝及其重要化合物课件,共25页。PPT课件主要包含了答案C,海水提镁的工艺流程,答案D,氧化膜,坩埚钳,氧化铝为离子化合物,硼酸的酸性比碳酸弱,七水硫酸镁等内容,欢迎下载使用。
【备战2023高考】化学总复习——第08讲《铝、镁及其重要化合物》练习: 这是一份【备战2023高考】化学总复习——第08讲《铝、镁及其重要化合物》练习,文件包含备战2023高考化学总复习第08讲《铝镁及其重要化合物》练习解析版docx、备战2023高考化学总复习第08讲《铝镁及其重要化合物》练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
新人教版高考化学一轮复习第3章金属及其重要化合物第11讲镁铝铜及其重要化合物金属冶炼课件: 这是一份新人教版高考化学一轮复习第3章金属及其重要化合物第11讲镁铝铜及其重要化合物金属冶炼课件,共60页。PPT课件主要包含了MgO+C,砖红色,碱式碳酸铜,CuSO4·5H2O,金属与非金属,金属特性,低碳钢,中碳钢,高碳钢,Hg+O2↑等内容,欢迎下载使用。












