





高中化学第一节 铁及其化合物精品ppt课件
展开1. Fe2+和 Fe3+的检验(1)观察法 Fe2+:浅绿色 Fe3+:棕黄色(2)加碱沉淀法(3)KSCN显色反应
Fe3+ + 3SCN- ═ Fe(SCN)3 血红色溶液
怎么证明溶液中既含有Fe3+又含有Fe2+?
当溶液中既有Fe3+又有Fe2+时,应如何将它们鉴别出来?
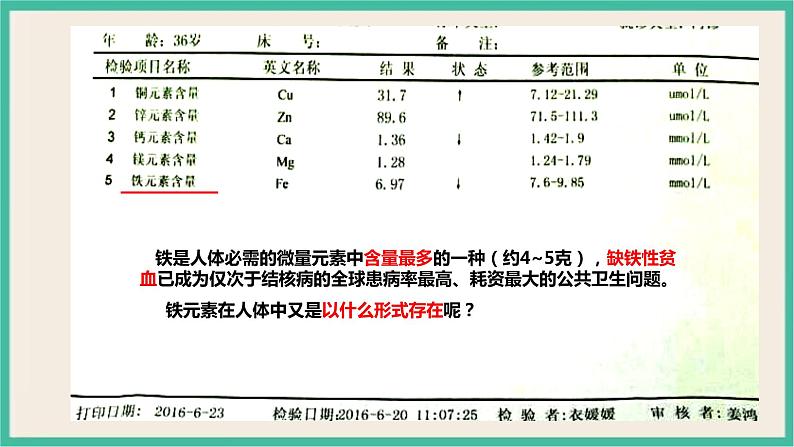
铁是人体必需的微量元素中含量最多的一种(约4~5克),缺铁性贫血已成为仅次于结核病的全球患病率最高、耗资最大的公共卫生问题。 铁元素在人体中又是以什么形式存在呢?
Fe2+很不稳定,很容易被空气中的O2或其他氧化剂氧化成Fe3+。所以防治贫血症的关键在于想办法把这些Fe3+还原回Fe2+。
1.铁是人体必需的微量元素
草酸亚铁、Fe(OH)3等
需转化为Fe2+,吸收率低
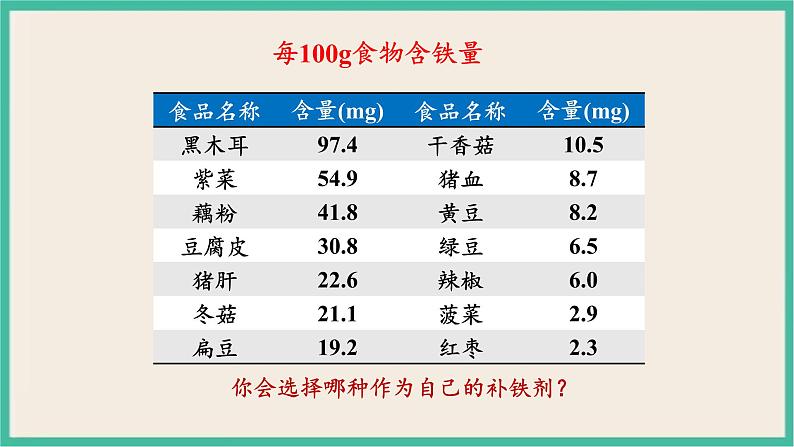
你会选择哪种作为自己的补铁剂?
【功能主治】用于缺铁性贫血症,预防及治疗用。
亚铁盐是可以被氧化的,补铁的试剂是亚铁盐,补铁药品如何达到 2~3年的保质期?
薄膜防止Fe2+被氧化
注:维生素C与本品同服,有利于本品吸收。
实验:在氯化铁滴加硫氰化钾溶液,再加入维生素C
氯化铁溶液,滴加硫氰化钾溶液后显红色,加入维生素C红色褪去,说明维生素C将Fe3+,还原为Fe2+
维生素C和补铁试剂同时使用,可以保证吸收的都是亚铁离子
注:与维生素C同服,可增加本品的吸收。
1.某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知SCN-、Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色,并结合已学的知识设计了如下实验;①将药片除去糖衣研细后溶解、过滤。②取滤液分别加入两支试管中,在一支试管中加入酸性KMnO4溶液,在另一支试管中加入KSCN溶液。 请完成下列问题:
(1)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液后不变红,结论是____________。(2)若滴入酸性KMnO4溶液后不褪色,滴入KSCN溶液变红,结论是____________。(3)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液变红,结论是 ____________。(4)________(填“能”或“不能”)将酸性KMnO4溶液和KSCN溶液滴入同一支试管中进行验证,原因是____________。
酸性KMnO4溶液呈紫红色,影响Fe3+的检验;KSCN具有还原性,影响Fe2+的检验
2. Fe3+、Fe2+ 、Fe的转化——铁三角
预测哪些试剂可以实现上述转化?你预测的依据是什么?设计实验验证你的猜测。
实验药品:FeSO4溶液、FeCl3溶液铁粉、KI溶液、酸性KMnO4溶液、 H2O2、铜粉、氯水铁氰化钾溶液、硫氰化钾溶液
实验目的:实现Fe2+→Fe3+转化
实验目的:实现Fe3+→Fe2+转化
加少量铁粉振荡后,溶液变成浅绿色,再加KSCN溶液,溶液颜色无变化
2Fe3++Fe=3Fe2+
2Fe2++Cl2=2Fe3++2Cl-
铁盐遇到较强的还原剂会被还原成亚铁盐,亚铁盐在较强的氧化剂作用下会被氧化成铁盐,即在一定条件下是Fe3+和Fe2+可以互相转化的。
【实验3-3】在盛有2mLFeCl3溶液的试管中加入少量的铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液。观察并记录现象。把上层清液倒入另一支试管中,再滴入几滴氯水,又发生了什么变化?
了解FeCl3制作印刷电路板
铜板制印刷电路板原理先在一块铜板上画好电路图,然后用例如石蜡之类的东西封好需保留的部份,再放入氯化铁溶液中浸泡,没有被蜡覆盖住的铜溶解掉. 这个工艺很像印刷书本,所以叫印刷电路.
Cu + 2Fe3+ = 2Fe2+ + Cu2+
【思考与讨论】(1)Fe、FeSO4和Fe2(SO4)3 三种物质中,哪种物质可做氧化剂,哪种可做还原剂,哪种既可做氧化剂,又可做还原剂?举例写出相应反应的化学方程式,并加以说明。(2)请你用图示的方法归纳Fe、Fe2+和Fe3 +三者之间的转化关系,并与同学讨论。
、O2 、KMnO4(H+)等
小结:Fe2+和Fe3+的相互转化
氧化性较强的氧化剂如:
氧化性较强的氧化剂如:Cl2、 Br2、硝酸、H202等
还原剂Zn、Al、Mg、CO等
弱氧化剂:H+、Cu2+、S、I2、Fe3+等
(Cl2、Br2、O2、H2O2、HNO3、KMnO4)
(还原剂Fe、Cu、H2S、SO2、KI、 Vc等)
2FeCl3+SO2+2H2O=2FeCl2+ H2SO4+2HCl
2FeCl3+2KI=2FeCl2+I2 + 2KCl
2FeCl3+H2S=2FeCl2+S ↓ + 2HCl
5Fe2++MnO4-+8H+ == 5Fe3+ +Mn2+ + 4H2O
【例】硫酸亚铁是一种性能优良的净水剂,工业上常用废铁屑和稀硫酸反应制得。FeSO4固体需密封保存在实验室中。 FeSO4溶液一般是现配现用尽量减少与空气接触并且不宜久存。 1.分析:“FeSO4溶液一般是现配现用,尽量减少与空气接触并且不宜久存。”可能原因是什么?可能发生什么反应? 2.思考:如何保存硫酸亚铁溶液。
答:FeSO4中Fe为+2价,所以极易被空气氧化为+3价,而变质。
答:存放FeSO4 溶液时,常加铁粉(和少量稀硫酸,防水解)。
【难点突破】问题1. 如何证明Fe3O4中同时含有+2和+3价的Fe ?
答:都不行。原因是:稀HNO3可以将Fe2+氧化为Fe3+。 若用盐酸,会与后加入的酸性KMnO4溶液反应,影响Fe2+的检测。
问题3.能否用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2 ?
答: 不能,酸性KMnO4溶液会与FeCl3溶液中Cl-离子反应而褪色
问题2. 若用盐酸或稀HNO3代替上述方案中的稀H2SO4是否可行?
1. 某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示: 已知硝酸能将Fe2+氧化为Fe3+。现对A、B、C、D作出的如下推断中,不正确的是( )A.A盐一定是FeCl3 B.白色沉淀B是AgClC.滤液C中一定含Fe3+D.无法确定A中是否含有Fe2+
2.已知:溴水为橙色,有强氧化性。请选择合适试剂完成甲、乙两组实验。 甲组:检验含Fe3+的溶液中是否含有Fe2+。 乙组:检验含Fe2+的溶液中是否含有Fe3+。下列试剂及加入试剂顺序能达到实验目的的是 ( )
①FeCl3溶液使KI淀粉试纸变蓝
②FeSO4溶液使酸性KMnO4溶液褪色
2Fe3+ +2I- =2Fe2++I2
2Fe2++H2O2+2H+ == 2Fe3+ + 2H2O
③在FeSO4溶液中滴入H2O2溶液,变为黄色
④在HCl和FeCl3混合溶液中加入铁粉,依次发生的反应为
①2Fe3+ +Fe=3Fe2+② Fe+2H+ == Fe2+ +H2↑
高中化学人教版 (2019)必修 第一册第一节 铁及其化合物示范课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物示范课课件ppt,共25页。
化学必修 第一册第一节 铁及其化合物获奖课件ppt: 这是一份化学必修 第一册第一节 铁及其化合物获奖课件ppt,共45页。PPT课件主要包含了三方法,Fe2+,Fe3+,红蛋白,还有什么疑问,课堂小结,你知道其中的原理吗等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册实验活动2 铁及其化合物的性质教课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册实验活动2 铁及其化合物的性质教课课件ppt,共14页。PPT课件主要包含了苹果会“变脸”,P61科学探究,动脑与动手,资料卡片等内容,欢迎下载使用。













