



高中化学鲁科版 (2019)必修 第一册第2节 硫的转化教课内容课件ppt
展开1.通过浓硫酸的性质实验和交流研讨,掌握硫酸的性质、典型实验现象,并能书写相关的化学方程式和离子方程式。2.通过从物质类别和元素价态两个视角去认识浓硫酸的性质,进一步掌握研究无机物性质的具体思路和方法。3.通过对酸雨危害的了解,认识到防治酸雨的措施与必要性。增强环境保护意识和社会责任。
学习任务1 浓硫酸的性质
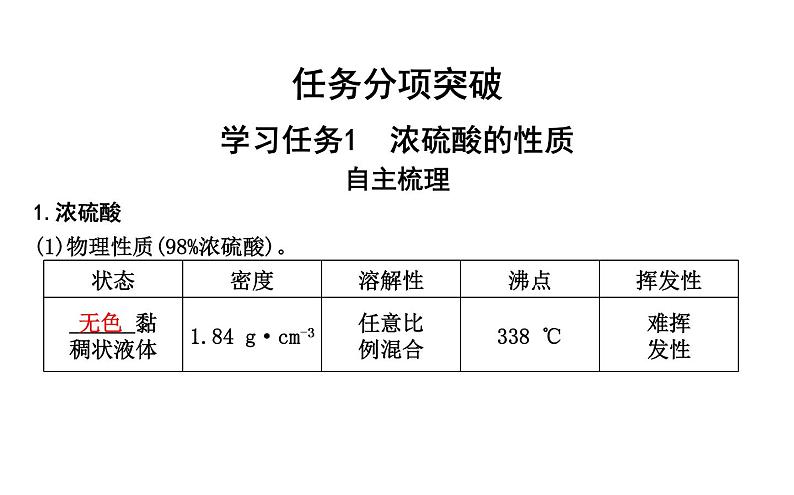
1.浓硫酸(1)物理性质(98%浓硫酸)。
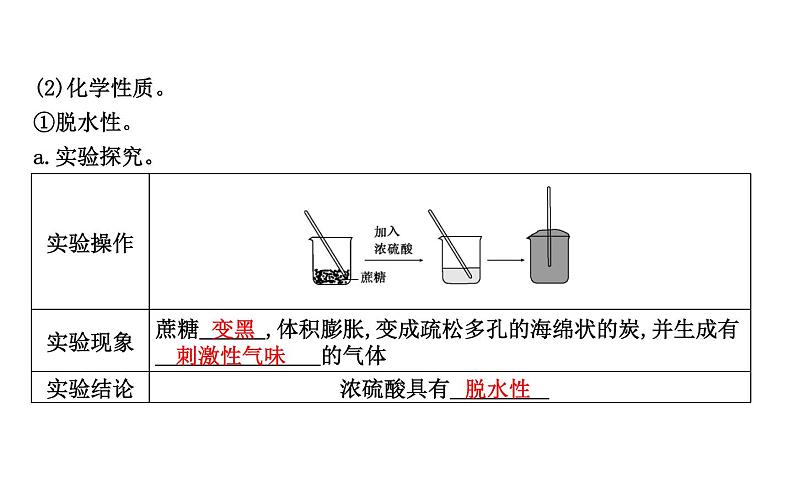
(2)化学性质。①脱水性。a.实验探究。
b.吸水性与脱水性的对比。
氧元素按水的元素组成质量比
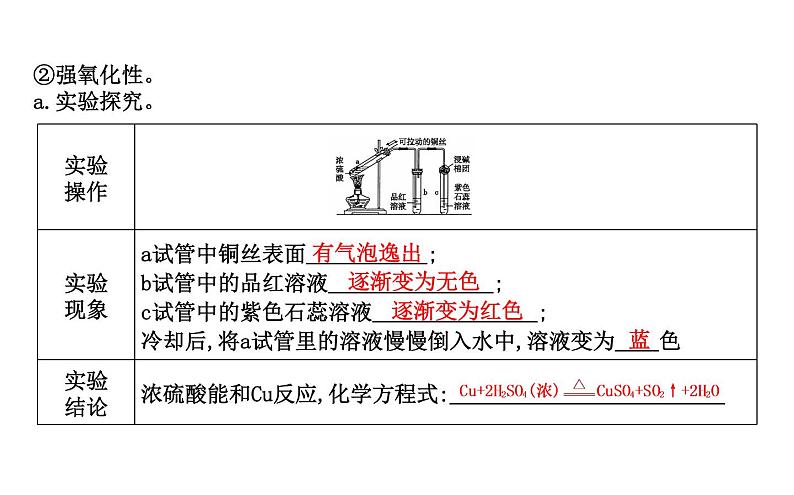
②强氧化性。a.实验探究。
2.硫酸工业制备——接触法制硫酸
③ 。
3.硫酸的用途(1)重要的化工原料,实验室必备的重要试剂,做干燥剂等。(2)工业上可用于制化肥、农药、炸药、染料等。(3)用于石油精炼、金属加工等。
探究1 浓硫酸的性质在学习了浓硫酸的性质后,有同学感觉到与初中学过的稀硫酸的性质差异很大。于是在课后设计如下实验进行比较验证:
问题1:对于实验Ⅰ你能观察到什么现象?其原理相同吗?提示:看到火柴梗变黑,蓝矾晶体由蓝色变为白色;原理不同,前者体现浓硫酸的脱水性,后者体现浓硫酸的吸水性。问题2:对于实验Ⅱ,浓、稀硫酸与铁丝的反应对比,有何不同?提示:可观察到铁丝能与稀硫酸反应产生气泡,溶液变为浅绿色,这里是氢离子与铁之间的氧化还原反应;浓硫酸中的铁丝表面迅速变黑,发生了钝化,实质是浓硫酸中+6价的硫体现强氧化性把铁丝表面氧化形成一层致密的氧化物薄膜。
问题3:实验Ⅲ能看到什么现象?浓硫酸体现了什么性质?与实验Ⅱ中浓硫酸与铁丝反应实验比较能得出什么结论?提示:看到铁丝表面产生气泡,品红溶液褪色;该反应中表现了浓硫酸的酸性、强氧化性;表明常温下浓硫酸可使铁丝钝化,加热条件下,浓硫酸可与铁丝反应生成二氧化硫。问题4:实验Ⅲ中,装置C的作用是什么?检测到D处有可燃性气体,说明了什么问题?提示:作用是吸收尾气中的SO2气体,防止污染环境;硫酸溶液变稀后跟铁反应产生H2。
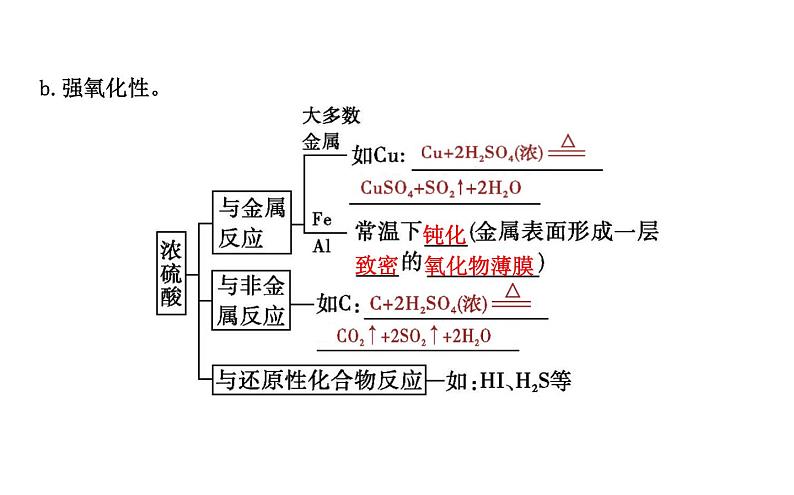
1.浓硫酸特性(1)脱水性脱的不是水分子,是有机物中的氢、氧元素;吸水性是直接吸收水分子。(2)钝化。①能钝化的金属:铁、铝。②钝化是一个化学反应,是浓硫酸强氧化性的体现。③钝化只有在常温下才能发生。
2.浓硫酸和稀硫酸的差异
探究2 不同价态硫元素间的转化在学习了浓硫酸的强氧化性后,认识到加热条件下,浓硫酸能与木炭反应,生成CO2、SO2气体。有同学认为浓硫酸应该也能与硫粉反应。于是设计如下实验:
问题5:你认为浓硫酸与硫粉能否反应?如果能反应,其产物是什么?写出反应的化学方程式。
问题6:盛放H2S溶液、酸性KMnO4溶液的试剂瓶有什么现象?硫元素转化为什么物质?提示:盛放H2S溶液的试剂瓶变浑浊,生成硫单质;盛放酸性KMnO4溶液的试剂瓶中颜色变浅,SO2被氧化为H2SO4。问题7:结合上述的实验,你能在硫元素的“价—类”二维图上标识出硫元素的转化关系吗?提示:
1.不同价态硫元素间的转化
2.硫元素不同价态间的转化规律(1)邻位价态原则。
(2)含同种元素相邻价态的粒子间不发生氧化还原反应,如SO2和浓硫酸之间不发生氧化还原反应。
1.(2021·北京师大二附中期中)下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )A.在空气中敞口久置的浓硫酸,溶液变稀(挥发性)B.在加热条件下铜与浓硫酸反应(脱水性)C.浓硫酸在白纸上书写的字迹变黑(氧化性)D.浓硫酸可用来干燥某些气体(吸水性)
解析:在空气中敞口久置的浓硫酸,溶液变稀,体现浓硫酸吸水性,故A错误;铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,体现浓硫酸的强氧化性、酸性,故B错误;浓硫酸在白纸上书写的字迹变黑,体现浓硫酸的脱水性,故C错误;浓硫酸具有吸水性,可以干燥某些气体,故D正确。
2.(2022·安徽芜湖期中)在实验室中,几位同学围绕浓硫酸的化学性质进行如下探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量浓硫酸,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。上述实验现象不能说明浓硫酸具有的性质是( )A.酸性 B.脱水性C.吸水性 D.强氧化性
解析:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量浓硫酸,迅速搅拌,观察到蔗糖逐渐变黑,体现浓硫酸脱水性、吸水性,蔗糖炭化后,与浓硫酸发生氧化还原反应生成具有刺激性气味的二氧化硫气体,体现浓硫酸强氧化性,上述实验现象能说明浓硫酸具有的性质为吸水性、脱水性、强氧化性,不能体现浓硫酸的酸性。
3.(2021·黑龙江哈尔滨月考)已知A、B、C、D、E五种物质,它们是单质硫或硫的不同价态化合物,已知在一定条件下有如下未配平的转化关系(注:每个关系式中化合价的升降都只有一处):①A+KOH→B+C+H2O;②C+E→B+H2O;③B+D→C+H2O;④C+Cl2+H2O→D+HCl,则这些物质中硫元素的化合价由低到高的顺序为( )A.A
1.硫酸型酸雨的形成(1)酸雨:排放到空气中的二氧化硫在氧气和水蒸气的共同作用下形成酸雾,随雨水降落就成为酸雨。(2)SO2的来源: 的燃烧。(3)硫酸型酸雨的形成。①形成过程。
3.酸雨的防治措施(1)对 物质的排放加以控制。①利用物理、化学方法对含硫燃料预先进行脱硫。②对废气中的 进行回收处理。 (2)改变 结构,开发利用清洁能源。(3)健全法律法规、严格规定污染物的排放标准,提高人们的环境保护意识等。
探究 酸雨的形成我国酸雨危害十分严重,是世界三大酸雨区之一。我国以煤炭为主的能源结构决定了我国的酸雨以硫酸型为主,硫酸型酸雨主要是由于空气中SO2含量超标导致。为减少SO2的污染和酸雨的形成,目前常应用石灰法脱硫。过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,最终生成CaSO4,从而达到减少SO2排放的目的。为了探究酸雨的形成,某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到如表数据:
问题1:是不是显酸性的降雨都是酸雨?提示:不是。只有雨水的pH小于5.6才能算为酸雨。问题2:酸雨放置时,pH发生变化的主要原因是什么?提示:该酸雨是SO2溶于水形成的,由于H2SO3还原性较强,在空气中放置会被氧气缓慢氧化为强酸H2SO4,使酸性增强,而当水中的H2SO3完全转化为H2SO4时,酸性就不变了。问题3:你认为减少酸雨的产生,还有哪些途径?提示:一方面减少SO2排放,另一方面发展替代能源,减少煤的使用。
1.酸雨(1)定义:饱和H2CO3溶液的pH=5.6,因此正常降雨的雨水显酸性,但pH最小为5.6。所以规定只有pH<5.6的降雨才认定为酸雨。(2)分类。硫氧化物引起的酸雨叫硫酸型酸雨;氮氧化物引起的酸雨叫硝酸型酸雨。2.工业常用钙基固硫原理(1)钙基固硫是在含硫量比较高的煤中按比例加入一定量的石灰石。
1.(2021·北京西城期末)如图为酸雨形成的示意图。下列说法中,不正确的是( )A.酸雨的pH小于5.6B.酸雨会加速建筑物的腐蚀C.含硫煤的燃烧是导致酸雨的原因之一D.酸雨形成过程中不涉及氧化还原反应
解析:正常雨水的pH≈5.6,酸雨的pH<5.6,故A正确;酸雨的主要成分为硝酸或硫酸,会与建筑物中的碳酸盐反应,从而腐蚀建筑物,故B正确;含硫煤的燃烧会产生SO2,SO2可以经过2种途径转化为硫酸型酸雨,故C正确;NOx转化为硝酸,SO2转化为硫酸的过程中,N和S的化合价均升高,发生了氧化还原反应,故D错误。
2.(2021·湖北荆州月考)你认为减少酸雨产生的途径可以采取的措施是( )①少用煤做燃料 ②把工厂的烟囱造高 ③燃料脱硫 ④在已经酸化的土壤中加石灰 ⑤开发新能源A.①②③B.①②④⑤C.①③⑤D.②③④⑤
解析:①用煤做燃料会产生二氧化硫、氮氧化物,造成酸雨,所以少用煤做燃料可以减少酸雨;③燃料脱硫处理,可减少二氧化硫的形成;⑤开发新能源可减少含硫物质的排放,可减少二氧化硫的形成;而②把工厂烟囱造高不能减少二氧化硫、氮氧化物的产生,即不能减少酸雨产生,④在已经酸化的土壤中加石灰,可以改良土壤,但不能减少酸雨产生。
3.(2022·福建师大附中期中)如图是某燃煤发电厂处理废气的装置示意图,下列说法不正确的是( )A.使用此装置可减少导致酸雨的气体的排放B.装置内发生了化合反应和分解反应C.整个过程的总反应可表示为2SO2+2CaCO3+O2 2CaSO4+2CO2D.若排放的气体能使澄清石灰水变浑浊,说明排放的气体中含SO2
【易错提醒】1.误认为浓硫酸使蓝色五水硫酸铜变白色是表现浓硫酸的脱水性,其实这里表现的是浓硫酸的吸水性。2.误认为浓硫酸使铁、铝钝化是物理变化,其实钝化是金属表面被氧化生成一层致密氧化膜,是化学变化。3.误认为浓硫酸不能干燥二氧化硫。其实不然,由于两者中的硫元素处于相邻价态,不能发生氧化还原反应。4.误认为浓硫酸有很强的酸性。其实不然,由于浓硫酸中几乎没有水,基本不电离,所以浓硫酸几乎没有酸性。5.误认为+6价的硫都有强氧化性。其实不然,只有浓硫酸、SO3分子状态的+6价硫有强氧化性,而稀硫酸、硫酸盐中+6价硫没有强氧化性。6.误认为浓硫酸与金属反应生成的气体只有SO2。其实不然,随反应进行硫酸浓度降低,可能会生成H2。7.误认为显酸性的雨水就是酸雨。其实不然,只有pH小于5.6的降雨才是酸雨。
学习完浓硫酸的性质后,某化学学习小组对浓硫酸的性质做了总结:浓硫酸具有吸水性、脱水性、强氧化性(能使铁钝化)。但又产生了新的疑问,什么样浓度的硫酸溶液具备上述的三个特性?经过分组讨论以后,该学习小组对“具有该三个特性的浓硫酸的浓度范围”进行了以下实验探究。(1)配制不同浓度的硫酸:用18.4 ml·L-1的浓硫酸配制不同浓度的硫酸。(2)探究浓硫酸的吸水性、脱水性、钝化与浓度的关系。①浓硫酸的吸水性:各取0.5 g胆矾颗粒于试管中,分别加入3 mL不同浓度的硫酸。②浓硫酸的脱水性:各取一根火柴梗于试管中,分别加入1 mL不同浓度的硫酸。③浓硫酸的钝化:各取约1 cm经过砂纸打磨过的铁丝,再向试管中加入3 mL不同浓度的硫酸。实验结果见下表:
结合表格数据回答下列问题。用化学方程式表示胆矾由“蓝→白”的原因: ;当硫酸的浓度≥ ml·L-1时即具有脱水性。
学习完浓硫酸的性质后,某化学学习小组对浓硫酸的性质做了总结:浓硫酸具有吸水性、脱水性、强氧化性(能使铁钝化)。但又产生了新的疑问,什么样浓度的硫酸溶液具备上述的三个特性?经过分组讨论以后,该学习小组对“具有该三个特性的浓硫酸的浓度范围”进行了以下实验探究。(3)探究浓硫酸的强氧化性与浓度的关系。在试管中分别加入1小块铜片,再向试管中分别加入2 mL不同浓度的硫酸,用如图所示的装置进行实验(夹持仪器略去)。①按图组装好装置后必须进行的实验操作是 ,b装置的作用是 。
解析:(3)①组装好装置后必须进行的实验操作是检查装置的气密性,b装置的作用是做安全瓶,防倒吸。
答案:(3)①检查装置的气密性 作安全瓶,防倒吸
学习完浓硫酸的性质后,某化学学习小组对浓硫酸的性质做了总结:浓硫酸具有吸水性、脱水性、强氧化性(能使铁钝化)。但又产生了新的疑问,什么样浓度的硫酸溶液具备上述的三个特性?经过分组讨论以后,该学习小组对“具有该三个特性的浓硫酸的浓度范围”进行了以下实验探究。(3)探究浓硫酸的强氧化性与浓度的关系。在试管中分别加入1小块铜片,再向试管中分别加入2 mL不同浓度的硫酸,用如图所示的装置进行实验(夹持仪器略去)。②本实验中证明浓硫酸具有强氧化性的现象是 、 。
解析:②浓硫酸和铜反应,铜被浓硫酸氧化,铜片会溶解,浓硫酸被还原,生成的还原产物是二氧化硫,可以使品红溶液褪色,所以实验中证明浓硫酸具有强氧化性的现象是铜片溶解,表面有气泡产生、品红溶液褪色。
答案:②铜片溶解,表面有气泡产生 品红溶液褪色
学习完浓硫酸的性质后,某化学学习小组对浓硫酸的性质做了总结:浓硫酸具有吸水性、脱水性、强氧化性(能使铁钝化)。但又产生了新的疑问,什么样浓度的硫酸溶液具备上述的三个特性?经过分组讨论以后,该学习小组对“具有该三个特性的浓硫酸的浓度范围”进行了以下实验探究。(3)探究浓硫酸的强氧化性与浓度的关系。在试管中分别加入1小块铜片,再向试管中分别加入2 mL不同浓度的硫酸,用如图所示的装置进行实验(夹持仪器略去)。③试管a中加热时产生黑色的固体,经检验该黑色固体中含有CuO,写出生成该物质的化学方程式: 。
学习完浓硫酸的性质后,某化学学习小组对浓硫酸的性质做了总结:浓硫酸具有吸水性、脱水性、强氧化性(能使铁钝化)。但又产生了新的疑问,什么样浓度的硫酸溶液具备上述的三个特性?经过分组讨论以后,该学习小组对“具有该三个特性的浓硫酸的浓度范围”进行了以下实验探究。(3)探究浓硫酸的强氧化性与浓度的关系。在试管中分别加入1小块铜片,再向试管中分别加入2 mL不同浓度的硫酸,用如图所示的装置进行实验(夹持仪器略去)。 ④经过实验发现:c(H2SO4)≥6 ml·L-1 时,硫酸与铜在加热反应时即可表现强氧化性。有同学预测,铜片与5 ml·L-1的硫酸在长时间持续加热时,也会发生反应。该预测的理由是 。
解析:④若铜片与5 ml·L-1的硫酸在长时间持续加热时,由于水分的蒸发,硫酸浓度增大到6 ml·L-1时,也会和铜发生反应。
答案:④长时间加热时,水分蒸发,使硫酸的浓度增大
学习完浓硫酸的性质后,某化学学习小组对浓硫酸的性质做了总结:浓硫酸具有吸水性、脱水性、强氧化性(能使铁钝化)。但又产生了新的疑问,什么样浓度的硫酸溶液具备上述的三个特性?经过分组讨论以后,该学习小组对“具有该三个特性的浓硫酸的浓度范围”进行了以下实验探究。(4)综合该小组同学的探究结果,中学教材中同时具有“吸水性、脱水性、使铁钝化、强氧化性”的浓硫酸的浓度范围为 ml·L-1。
解析:(4)综合该小组同学的探究结果,浓硫酸具有吸水性需要浓度≥11 ml·L-1,具有脱水性需要浓度≥6 ml·L-1,使铁钝化需要浓度≥12 ml·L-1,具有强氧化性需要浓度≥6 ml·L-1,所以同时具有“吸水性、脱水性、使铁钝化、强氧化性”的浓硫酸的浓度范围为c(H2SO4)≥12 ml·L-1。
答案:(4)c(H2SO4)≥12
鲁科版 (2019)必修 第一册第2节 硫的转化授课ppt课件: 这是一份鲁科版 (2019)必修 第一册第2节 硫的转化授课ppt课件,共41页。PPT课件主要包含了分点突破1,硫酸的性质,分点突破2等内容,欢迎下载使用。
化学必修 第一册第3章 物质的性质与转化第2节 硫的转化习题课件ppt: 这是一份化学必修 第一册第3章 物质的性质与转化第2节 硫的转化习题课件ppt,文件包含鲁科版高中化学必修第一册第3章物质的性质与转化第2节硫的转化第2课时硫酸酸雨及其防治课件ppt、鲁科版高中化学必修第一册第3章物质的性质与转化第2节硫的转化第2课时硫酸酸雨及其防治课后习题含答案doc等2份课件配套教学资源,其中PPT共45页, 欢迎下载使用。
化学必修 第一册第3章 物质的性质与转化第2节 硫的转化示范课ppt课件: 这是一份化学必修 第一册第3章 物质的性质与转化第2节 硫的转化示范课ppt课件,共42页。PPT课件主要包含了知识网络,学业基础,核心素养,学考评价等内容,欢迎下载使用。













