





化学必修 第一册第3节 化学中常用的物理量——物质的量课前预习ppt课件
展开1.通过对溶液浓度表示原理的理解,认识物质的量浓度的含义,从原理层次掌握各种浓度表示法之间的换算。2.通过配制一定物质的量浓度溶液的实验,了解一定体积的物质的量浓度溶液的配制过程以及误差分析。3.通过物质质量与物质的物质的量转换,能从物质的量的角度认识化学反应,并能进行相关计算。
学习任务1 物质的量浓度
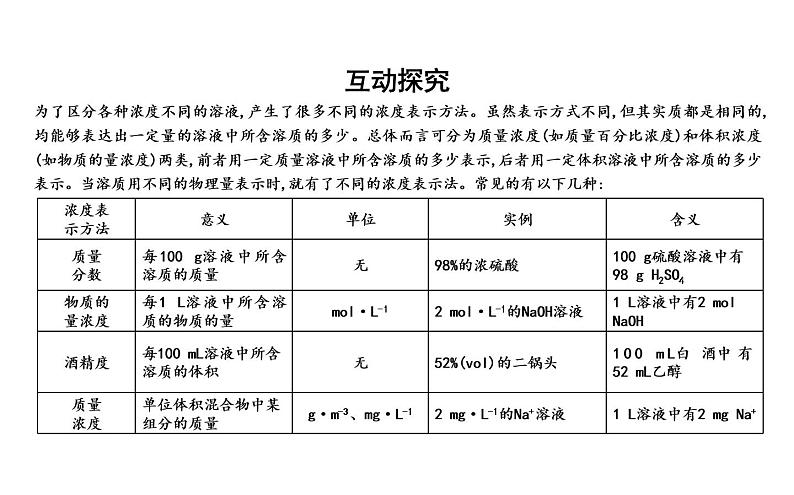
为了区分各种浓度不同的溶液,产生了很多不同的浓度表示方法。虽然表示方式不同,但其实质都是相同的,均能够表达出一定量的溶液中所含溶质的多少。总体而言可分为质量浓度(如质量百分比浓度)和体积浓度(如物质的量浓度)两类,前者用一定质量溶液中所含溶质的多少表示,后者用一定体积溶液中所含溶质的多少表示。当溶质用不同的物理量表示时,就有了不同的浓度表示法。常见的有以下几种:
问题1:从500 mL 2 ml·L-1的NaCl溶液中取出100 mL,则这100 mL溶液的物质的量浓度为多少?含有的NaCl的物质的量为多少?
提示:这100 mL溶液的物质的量的浓度为2 ml·L-1,含有的NaCl的物质的量为0.2 ml。
问题2:将1 ml NaOH加入1 L水中,配成的溶液的物质的量浓度是1 ml·L-1吗?
探究1 对物质的量浓度的理解
问题3:已知在AlCl3溶液中,Al3+的物质的量浓度为1 ml·L-1,则Cl-的物质的量浓度是多少?
提示:在溶液中,阴离子与阳离子的浓度之比等于化学式中离子个数之比,因此可根据已知离子的浓度求算其他离子的浓度,所以c(Cl-)=3c(Al3+)=
探究2 物质的量浓度的相关计算
问题4:将3 ml·L-1的NaCl溶液稀释到原来的3倍,稀释后的溶液的浓度是多少?
问题5:98%的浓硫酸的密度是1.84 g·cm-3,换算为物质的量浓度是多少?
提示:1 ml·L-1。
问题6:将1 L 1 ml·L-1的H2SO4溶液和3 L 0.5 ml·L-1的H2SO4溶液混合,加水至5 L,此时硫酸溶液的浓度是多少?
溶液物质的量浓度的计算方法1.根据定义式计算
2.物质的量浓度与质量分数的关系(1)根据浓度表示原理换算。①把不同浓度表示法中溶液、溶质的物理量转换为相应浓度表示法中的物理量,就完成了浓度的换算。②换算时注意单位的变化。
3.溶液稀释和混合的计算(1)溶液稀释的有关计算:稀释前后溶质的物质的量和质量都保持不变。c(浓)·V(浓)=c(稀)·V(稀)m(浓)·w(浓)=m(稀)·w(稀)(2)溶液混合的计算:混合前后溶质的总物质的量或总质量不变。c1·V1+c2·V2=c(混)·V(混)m1·w1+m2·w2=m(混)·w(混)
题点一 物质的量浓度的认识
1.(2021·天津三中期中)某血液化验单中“总胆固醇”一项的结果为4.27 mml·L-1。这里的“4.27 mml·L-1”表示总胆固醇的( )A.质量分数B.摩尔质量C.物质的量D.物质的量浓度
解析:根据单位可判断“4.27 mml·L-1”表示总胆固醇的物质的量浓度,故D正确。
2.(2021·河北邯郸期中)1 ml·L-1的NaOH溶液的含义是( )A.1 L水中含有1 ml NaOHB.将40 g NaOH溶于1 L水中C.1 L此浓度的NaOH溶液中含有1 ml Na+D.1 L此浓度的NaOH溶液中含4 g NaOH
解析:1 L水中含有1 ml NaOH,由于溶液体积不是1 L,所以浓度不是1 ml·L-1,A错误;将40 g即1 ml NaOH溶于1 L水中所得溶液体积不是1 L,所以浓度不是1 ml·L-1,B错误;1 L此浓度的NaOH溶液中含有1L×1 ml·L-1=1 ml NaOH,则含有1 ml Na+,C正确;1 L此浓度的NaOH溶液中含有1 L×1 ml·L-1=1 ml NaOH,质量为1 ml×40 g·ml-1=40 g,D错误。
3.(2021·江苏沭阳月考)下列溶液中溶质的物质的量浓度为1 ml·L-1的是( )A.将40 g NaOH溶解于1 L水中配成NaOH溶液B.常温、常压下,将22.4 L HCl气体溶于水配成1 L的盐酸C.将1 L 0.5 ml·L-1的盐酸加热浓缩为0.5 LD.从1 000 mL 1 ml·L-1的NaCl溶液中取出100 mL的溶液
题点二 物质的量浓度的有关计算
解析:40 g氢氧化钠固体溶于1 L水所得的溶液的体积已不是1 L,物质的量浓度不是1 ml·L-1,故A错误;常温、常压下,22.4 L HCl的物质的量不是1 ml,所得盐酸的物质的量浓度不是1 ml·L-1,故B错误;盐酸是恒沸液,将1 L 0.5 ml·L-1的盐酸加热浓缩为0.5 L的过程中,氯化氢和水都受热挥发,所得盐酸的物质的量浓度不是1 ml·L-1,故C错误;从1 000 mL 1 ml·L-1的NaCl溶液中取出100 mL的溶液,氯化钠溶液的物质的量浓度仍为1 ml·L-1,故D正确。
4.(2021·山西太原期中)市售盐酸的浓度一般较大,使用前往往需要稀释。将10 ml·L-1的盐酸稀释成200 mL 4 ml·L-1的盐酸,需取用10 ml·L-1盐酸的体积是( )A.6 mL B.80 mL C.100 mL D.120 mL
学习任务2 一定物质的量浓度的溶液的配制
2.实验过程(以配制100 mL 1.00 ml·L-1 NaCl溶液为例)(1)实验目的:配制100 mL 1.00 ml·L-1的NaCl溶液。
(3)实验仪器:100 mL容量瓶、电子天平(或 天平)、量筒、烧杯、玻璃棒、胶头滴管等。(4)配制步骤。
(1)质量关系:4 g H2与32 g O2在点燃的条件下恰好完全反应,生成 H2O。(2)物质的量的关系: H2与 O2在点燃的条件下恰好完全反应生成2 ml H2O。
在实际生产和科学实验中,固体往往要配成溶液才能使用,有时溶液的浓度较大,同时经常要把浓溶液稀释成所需浓度的稀溶液。现在实验需要用到2 ml·L-1的硫酸250 mL和1 ml·L-1的氯化钠溶液250 mL。实验室里可以提供98%的浓硫酸(标签上标明密度为1.84 g·cm-3)、NaCl固体,为此小明和小华展开了讨论。
问题1:如何确定取用浓硫酸的体积和NaCl的质量?
问题2:这两种溶液配制需用的仪器有何区别?
提示:都要用到的仪器有250 mL容量瓶、烧杯、玻璃棒和胶头滴管;配制稀硫酸还要用到量筒,配制NaCl溶液还要用到托盘天平、药匙。
探究1 配制过程中的要点
问题3:若要配制480 mL NaCl溶液,应选择何种规格的容量瓶?计算所需溶质时应注意哪些问题?
提示:容量瓶的选择原则是“大而近”,故配制480 mL NaCl溶液时,应选择500 mL的容量瓶。计算所需溶质的质量或浓溶液的体积时,应根据所选容量瓶的体积进行计算,且结果保留到小数点后一位。
问题4:在整个配制过程中多次用到玻璃棒,其作用分别是什么?引流时玻璃棒的下端为什么应靠在容量瓶刻度线以下的内壁上?
提示:溶解时玻璃棒的作用是搅拌;向容量瓶中转移溶液时玻璃棒的作用是引流。若玻璃棒下端靠在容量瓶刻度线以上的内壁上,刻度线以上的内壁上附着的液体不能及时流下,定容后造成溶液体积偏大,所以玻璃棒的下端应靠在容量瓶刻度线以下的内壁上。
问题5:配制一定浓度的硫酸溶液,最后振荡摇匀后发现液面低于刻度线,再滴加蒸馏水到凹液面最低处与刻度线相切。这种操作有问题吗?
提示:这种操作不可以,会导致溶液的浓度偏小。
问题6:配制一定浓度的氢氧化钠溶液时,氢氧化钠在烧杯中刚好溶解,立即把溶液转移到容量瓶中,这样做可以吗?若不可以,这样所配制溶液的浓度会如何变化?
提示:不可以。溶液未冷却,液体膨胀,故向容量瓶中所加的水偏少,这样会使所配制溶液的浓度偏大。
探究2 配制过程中的误差分析
问题7:定容时俯视或仰视刻度线,会影响配制的结果吗?原理是什么?
提示:俯视刻度线,会导致所配制溶液的浓度偏大;仰视刻度线,会导致所配制溶液的浓度偏小;俯视造成所配制溶液的体积偏小;仰视造成所配制溶液的体积偏大。
1.配制溶液时的注意事项(1)溶解或稀释时若有明显的热量变化,必须等溶液的温度恢复至室温后才能转移到容量瓶中。(2)转移溶液时必须用玻璃棒引流。(3)溶解用的烧杯和玻璃棒一定要洗涤2~3次,洗涤液要转移到容量瓶中。(4)移液后要先定容,再振荡摇匀。(5)定容时一定要用胶头滴管小心操作,万一加水过多,则必须重新配制。(6)定容时观察刻度线要平视,使凹液面最低点与刻度线相切。(7)选择容量瓶的原则:选择容量瓶应遵循“大而近”的原则,所配溶液的体积等于或略小于容量瓶的容积。因为容量瓶的规格是固定的,配制溶液时要根据溶液的体积选择匹配的容量瓶。
2.溶液配制时的误差分析
(2)判断结论。①凡是使溶质mB或nB增大的因素(很少出现,多因称量造成)或使V减小的因素,均会使cB偏大。②凡是使mB或nB减小的因素或使V增大的因素,均会使cB偏小。(3)定容时仰视或俯视刻度线产生的误差。①原理图解。
②简记为:仰视看高,俯视看低(比实际液面)。
1.(2021·黑龙江哈尔滨期末)若配制90 mL 0.1 ml·L-1的FeCl3溶液,需要用到的仪器有托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管,还需要的仪器是( )A.100 mL圆底烧瓶B.100 mL量筒C.100 mL容量瓶 D.100 mL烧杯
题点一 仪器的使用与配制步骤
解析:实验室配制一定物质的量浓度的溶液时,需要准确控制溶液的最终体积,实验室使用容量瓶来配制一定体积、一定浓度的溶液,常见规格有50 mL、100 mL、250 mL、500 mL等,若配制90 mL 0.1 ml·L-1的FeCl3溶液,则需100 mL容量瓶,则A、B、D均错误,C正确。
2.(2021·山东济宁期末)配制500 mL 0.100 ml·L-1的NaCl溶液,部分实验操作示意图如图:
下列说法正确的是( )A.容量瓶需用蒸馏水洗涤、干燥后才可使用B.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低C.上述实验操作步骤的正确顺序为①②④①③D.实验中需用到的仪器有托盘天平、250 mL容量瓶、烧杯、玻璃棒、胶头滴管等
3.(2021·四川阆中中学期中)下列操作会导致配制的溶液浓度偏小的是( )A.颠倒摇匀后发现凹液面低于刻度线又加水补上B.加水定容时俯视刻度线C.容量瓶内壁附有水珠而未干燥处理D.使用的砝码已生锈
解析:颠倒摇匀后凹液面低于刻度线是正常现象,若补加水,导致溶液体积偏大,浓度偏小,故A符合题意;定容时俯视刻度线,导致溶液体积偏小,浓度偏大,故B不符合题意;配制过程中还需加水定容,容量瓶内壁附有水珠而未干燥处理,对溶液浓度无影响,故C不符合题意;使用的砝码已生锈,导致称取的溶质偏多,溶质的物质的量偏大,配制时浓度偏大,故D不符合题意。
4.(2021·上海中学期中)在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配制溶液浓度偏高( )A.所用NaOH已经潮解B.溶解后的溶液立刻转移、洗涤、定容C.有少量NaOH溶液残留在烧杯里D.定容时观察液面仰视
解析:所用NaOH已经潮解,实际称量的氢氧化钠的质量偏小,氢氧化钠的物质的量偏小,所配制溶液浓度偏低,A项错误;NaOH在烧杯中溶解后,未冷却就转移到容量瓶中并定容,待溶液冷却后体积偏小,则浓度偏高,B项正确;有少量NaOH溶液残留在烧杯里,移入容量瓶内氢氧化钠的物质的量偏小,所配制溶液浓度偏低,C项错误;定容时仰视观察液面,导致溶液的体积偏大,所配制溶液浓度偏低,D项错误。
常见导致实验误差的操作
1.误认为溶液混合后体积等于原来两种溶液的体积之和。其实除非题目作出说明,否则应该利用两溶液的质量和与混合后溶液的密度计算混合后溶液的体积。2.不能在容量瓶中直接配制溶液。因为容量瓶是精密仪器,需要在烧杯中溶解冷却后再转移到容量瓶中。
4.误认为配制溶液用的容量瓶需要干燥。其实定容时还需要加蒸馏水,所以容量瓶不必干燥。
5.误认为回答配制溶液的必需玻璃仪器时答出容量瓶就可以。其实还要答出其规格。6.误认为称量NaOH固体需要纸片。其实由于NaOH易潮解,应在小烧杯中称量NaOH固体。
在科学生产过程中,经常要用到各种溶液,其浓度的表示五花八门。
下面是几种常见的溶液,思考并回答下列问题:
(1)上图中有哪几种浓度表示形式?其计算公式是什么?
(2)已知伏特加酒中乙醇的密度为0.79 g·mL-1,其质量分数为多少?氯化钠注射液的密度可看作
为1 g·mL-1,这种注射液的物质的量浓度是多少?
答案:(2)95%,0.15 ml·L-1。
(3)若用BaCl2固体配制1.5 ml·L-1 BaCl2溶液200 mL,需要哪些主要仪器?简述用BaCl2固体配
制1.5 ml·L-1BaCl2溶液的步骤。
答案:(3)托盘天平、玻璃棒、烧杯、200 mL容量瓶、胶头滴管、量筒等;计算→称量→溶解→转移→定容→摇匀→保存。
解析:(3)用BaCl2固体配制200 mL 1.5 ml·L-1的BaCl2溶液时要用到托盘天平、玻璃棒、烧杯、200 mL容量瓶、胶头滴管、量筒;配制BaCl2溶液的步骤为计算→称量→溶解→转移→定容→摇匀→保存。
(4)糖尿病的化验就是检测病人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mml·L-1”和“mg·dL-1”(1 L=10dL)。以“mml·L-1”表示时,人的血糖正常值在3.61~6.11 mml·L-1之间。如果以“mg·dL-1”表示,血糖正常值范围是多少?
答案:(4)64.98~109.98 mg·dL-1
化学必修 第一册第3节 化学中常用的物理量——物质的量教案配套ppt课件: 这是一份化学必修 第一册第3节 化学中常用的物理量——物质的量教案配套ppt课件,共60页。PPT课件主要包含了分点突破1,物质的量浓度,分点突破2,分点突破3,物质的量浓度的计算,分点突破4等内容,欢迎下载使用。
化学必修 第一册第3节 化学中常用的物理量——物质的量习题ppt课件: 这是一份化学必修 第一册第3节 化学中常用的物理量——物质的量习题ppt课件,文件包含鲁科版高中化学必修第一册第1章认识化学科学第3节化学中常用的物理量__物质的量第3课时物质的量浓度课件ppt、鲁科版高中化学必修第一册第1章认识化学科学第3节化学中常用的物理量__物质的量第3课时物质的量浓度课后习题含答案doc等2份课件配套教学资源,其中PPT共51页, 欢迎下载使用。
高中第3节 化学中常用的物理量——物质的量授课课件ppt: 这是一份高中第3节 化学中常用的物理量——物质的量授课课件ppt,共60页。PPT课件主要包含了NO1,托盘天平,蒸馏水,冷却至室温,胶头滴管,NO2,NO3等内容,欢迎下载使用。













