




鲁科版 (2019)第1章 认识化学科学第3节 化学中常用的物理量——物质的量课文ppt课件
展开1.通过对1 ml任意物质的体积的比较,建立摩尔体积的概念,体会引入“气体摩尔体积”的意义。2.通过对气体摩尔体积定义的理解,能够对物质的量与气体体积间进行简单计算。3.通过对相同状况下不同气体的体积的研究,理解阿伏加德罗定律及推论,并能解决实际问题。
学习任务1 气体摩尔体积
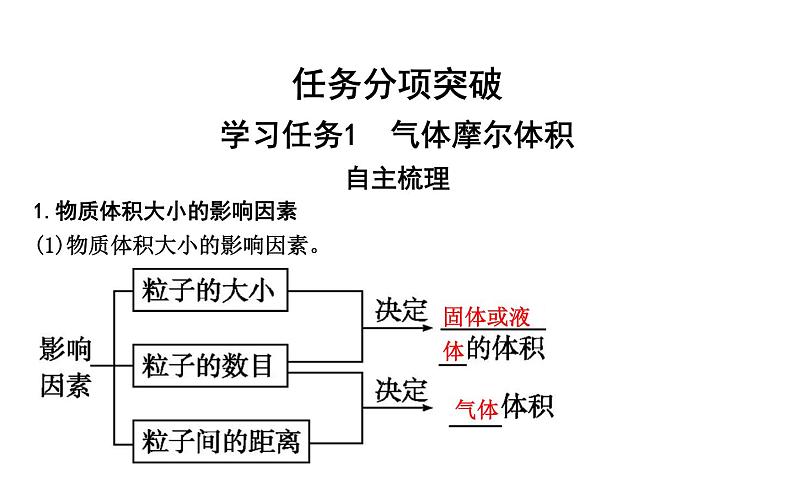
1.物质体积大小的影响因素(1)物质体积大小的影响因素。
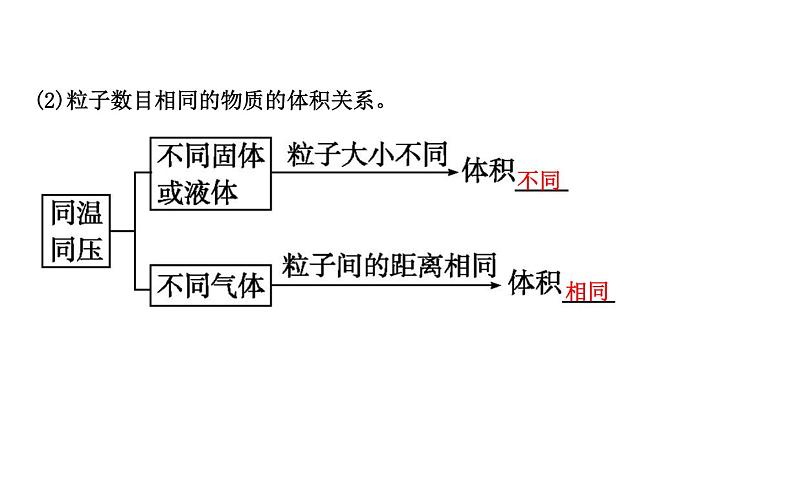
(2)粒子数目相同的物质的体积关系。
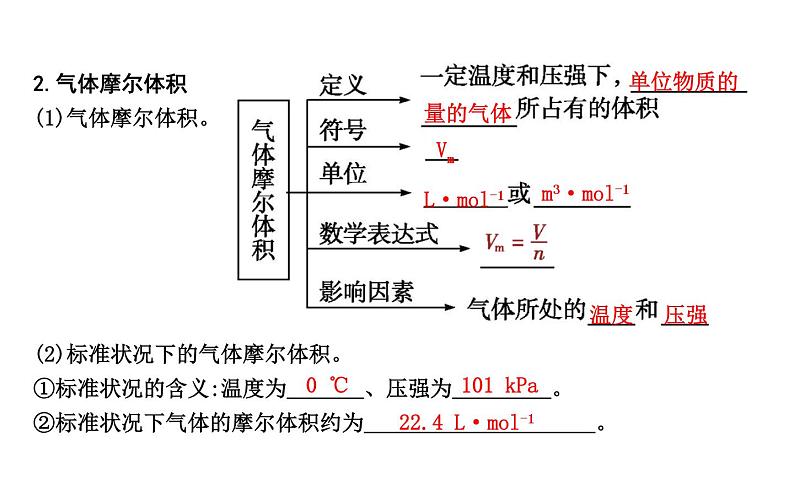
2.气体摩尔体积(1)气体摩尔体积。
(2)标准状况下的气体摩尔体积。①标准状况的含义:温度为 、压强为 。 ②标准状况下气体的摩尔体积约为 。
22.4 L·ml-1
同学们在生活中肯定见到过液压千斤顶,通过很小的力量就可以举起很重的物体。这是利用了液压原理,而液压原理就是利用了液体不能被压缩,可以把压强大小不变的传递向各个方向,就会在截面更大的方向产生很大的推力。在物质的三种状态中液体和固体都不能被压缩,但是气体却是可以被压缩的。我们给篮球打气的过程中,篮球的体积没怎么变化,但打入的气体却在增加,气体到哪儿去了呢?夏日,自行车受到曝晒时就容易爆胎。原因是什么?
问题1:液体、固体的体积不能被压缩,可以得出什么结论?一定微粒数目的液体、固体的体积大小与什么因素有关?
提示:液体、固体的体积不能被压缩,表明其微粒间的距离不能再减小;微粒数目一定的条件下,液体、固体的体积取决于其组成微粒的大小。
问题2:篮球中的气体不断增加,但篮球的体积几乎不变,但篮球的压强增大了。说明了什么?
提示:气体的分子数增加,但体积不变,说明气体分子间的距离减小了。压强增大,表明当气体的量一定时,其体积与压强成反比例关系。
探究1 决定物质体积的因素
问题3:曝晒后,自行车爆胎。说明气体的体积与什么因素有关?你能得出决定气体体积大小的因素是什么吗?
提示:说明在气体分子数量不变的条件下,温度升高,气体分子间的距离增大,导致气体体积增大,压强增大导致爆胎。说明当气体微粒数一定时,气体体积决定于分子间距离的大小,而分子间距离又与气体的温度、压强有关。温度越高、压强越小,分子间距离越大,气体体积越大。
问题4:如果一定量气体的温度、压强都保持不变,其体积会怎么样?
问题5:在标准状况下,若不知道气体的密度。你能通过气体的体积计算气体的质量吗?
提示:温度、压强一定,则气体分子间距离一定。气体微粒数确定,则气体的体积就有一个确定的值。
问题6:已知气体的相关参数有如下关系
你能利用学过的知识描述出标准状况下各序号表示的换算关系吗?
气体摩尔体积应用时的注意事项(1)不做特殊说明时,利用标准状况下的数据计算。若给出其他条件下的气体摩尔体积,则利用给出的数据计算。(2)必须为气体。一些在标准状况下不是气体的物质,如水、酒精等物质不能用Vm=22.4 L·ml-1计算。(3)气体可以是单一气体,也可以是混合气体。(4)非标准状况下,气体摩尔体积也可能等于22.4 L·ml-1。因此,在讨论气体摩尔体积时,必须注明气体所处的温度和压强。
题点一 影响物质体积的因素
1.(2021·浙江台州期中)对于给定物质的量的气态物质,决定其体积大小的主要因素是( )A.分子的直径 B.相对分子质量C.分子间的平均间距D.分子数目
解析:气态物质其分子之间是有较大间距的,间距大小至少是分子直径的十倍,故气体体积是气体分子所占据空间的总和,而不是物质分子体积的总和,故此气体体积与分子直径及相对分子质量无关;分子数目相同时,气态物质分子间距越大,气体总体积越大,所以决定气体体积的主要因素是气体分子间的平均间距,故选C。
2.下列关于决定物质体积的因素的说法不正确的是( )A.物质的体积取决于粒子数目、粒子大小和粒子间的距离B.相同条件下,粒子数相同的任何气体都具有相同的体积C.同温、同压下,1 ml任何物质所占有的体积均相同D.等质量的H2,压强越小、温度越高,气体所占的体积越大
解析:从微观角度来说,物质的体积由粒子数目、粒子大小和粒子间的距离决定,A正确;粒子数相同的气体,其物质的量相同,则相同条件下,气体所占的体积也相同,B正确;C项中此结论只适用于气态物质,C错误;压强越小、温度越高,气体所占的体积越大,D正确。
3.下列有关气体摩尔体积的说法错误的是( )A.当温度、压强一定时,任何具有相同数目微粒的气体都具有大致相同的体积B.单位物质的量的气体所占有的体积称为气体摩尔体积C.在标准状况下,气体的摩尔体积都约为22.4 L·ml-1D.在标准状况下,1 ml水的体积约为22.4 L
解析:当温度、压强一定时,气体分子间的距离一定,分子大小被忽略。当微粒数目相同时,气体体积也相同,A正确;B项是气体摩尔体积的定义,C项是标准状况下的气体摩尔体积,B、C都正确;在标准状况下,水是液体,1 ml水的体积不是22.4 L,D错误。
题点二 气体摩尔体积的概念与应用
4.(2021·上海同济大学第二附属中学期中)标准状况下,下列物质所占体积最大的是( )A.1.5 ml氧气 B.180 g H2OC.8 g氦气 D.约3.01×1023个氮气分子
学习任务2 阿伏加德罗定律
1.内容:同温、同压下,相同体积的任何气体都含有相同数目的 。2.适用范围:任何气体,可以是单一气体,也可以是混合气体。
图中是汽车上的安全气囊,在出现事故的时候,里面充满气体,形成一个缓冲,以防止乘车人员受到伤害。
问题1:对于图中的两个安全气囊,假定其体积是相同的,现在要检验其密封性。在相同温度、压强下,左面充满了氮气,右边充满了空气,哪一种气囊中充的气体分子数多呢?
提示:一样多。当温度、压强一定时,任何气体的分子间的间距是相同的,这样一个气体分子占据的空间就是相同的。当气囊容积相同时,里面容纳的气体分子数是一样多的。
问题2:同温、同压下,气体的体积大小与什么有关?
提示:同温、同压下,气体分子之间的距离相同,所以分子数越多,气体体积越大。即同温、同压下,气体的体积大小与气体分子数的多少(物质的量)有关。
探究 阿伏加德罗定律及其推论
问题3:根据你对阿伏加德罗定律和标准状况下气体摩尔体积的理解,两者有什么关系?
提示:阿伏加德罗定律是标准状况下气体摩尔体积的扩展和延伸,两者意义是相同的。或者说标准状况下气体摩尔体积是阿伏加德罗定律的一个特例。
问题4:气囊的体积是一定的,在相同的温度下,当左、右两个气囊分别充有1 ml、1.5 ml氮气时,其压强有什么关系?
提示:左、右两个气囊所盛有的氮气的物质的量之比为2∶3,因为气体的体积、温度是相同。故两个气囊的压强之比为2∶3。
阿伏加德罗定律及其推论的理解1.阿伏加德罗定律的推论
2.阿伏加德罗定律推论的归纳(1)“三同”定“一同”。同温、同压、同体积和同分子数,只要有三“同”成立,则另一“同”就必定成立。(2)“二同”成比例。温度、压强、气体体积、气体物质的量,若两个量相同,则另两个量成正比或反比。(3)气体摩尔体积是阿伏加德罗定律的一个特例。
1.(2022·四川成都期末)下列有关阿伏加德罗定律的说法正确的是( )A.同温、同压下,相同体积的物质,其物质的量一定相等B.同温、同压下,相同质量的N2和C2H4,其原子数目一定相等C.同温、同压下,含有相同原子数目的N2和O2,其质量一定相等D.同温、同压下,相同物质的量的气体A和气体B,其体积一定相等
题点一 阿伏加德罗定律
解析:根据体积求物质的量只限于气态物质,固体和液体没有规律,故A错误;因为N2和C2H4的摩尔质量相等,故相同质量的N2和C2H4,它们的分子物质的量相等,但原子数目不相等,因为它们的分子包含的原子数目不一样,故B错误;含有相同原子数目的N2和O2,其分子数也必然相同,但它们的相对分子质量不相同,故它们的质量也不相同,故C错误;同温、同压下,气体的摩尔体积是相同的,故相同物质的量的气体A和气体B,其体积一定相等,故D正确。
2.(2021·陕西西安期中)如图是两瓶体积相等的气体,在同温、同压时瓶内气体的关系一定正确的是( )A.气体质量相等 B.气体密度相等C.所含原子数相等D.摩尔质量相等
解析:同温、同压下,气体的体积之比等于物质的量之比,两瓶体积相等的气体,则两瓶气体的物质的量相等,结合分子的组成分析判断。左瓶中氮气和氧气的物质的量之比为1∶1时,相当于NO,与右瓶内NO的质量相等,但左瓶中氮气和氧气的物质的量之比不一定为1∶1,故质量不一定相等,故A错误;左瓶中氮气和氧气的物质的量之比为1∶1时,相当于NO,与右瓶内NO的密度相等,但左瓶中氮气和氧气的物质的量之比不一定为1∶1,故密度不一定相等,故B错误;都是双原子分子,物质的量相等的气体含有的原子数目相等,故C正确;左瓶中氮气和氧气的物质的量之比为1∶1时,相当于NO,与右瓶内NO的摩尔质量相等,但左瓶中氮气和氧气物质的量之比不一定为1∶1,故摩尔质量不一定相等,故D错误。
题点二 阿伏加德罗定律的推论
3.(2021·天津期中)同温、同压下,气体的密度之比等于相对分子质量之比,已知空气的平均相对分子质量为29,同温、同压下,下列气体的密度比空气密度小的是( )A.二氧化氮 B.二氧化碳 C.二氧化硫 D.一氧化碳
解析:同温、同压下,气体的密度之比等于相对分子质量之比,气体的密度比空气密度小,则气体的相对分子质量小于空气的相对分子质量29。二氧化氮的相对分子质量是46,二氧化碳的相对分子质量是44,二氧化硫的相对分子质量是64,一氧化碳的相对分子质量是28,所以气体密度小于空气密度的是一氧化碳。
4.(2021·天津南开中学期中)常温、常压下,取四支完全一样的针筒,分别充入等质量的CH4、O2、CO2、SO2四种气体(白色空白部分表示气体的存在),其中充装CH4的是( )
5.(2021·重庆月考)在体积相同的三个容器里分别充入三种气体①氢气、②二氧化碳、③氧气,并保持三个容器内气体的温度和质量均相等。下列说法正确的是( )A.密度关系:①<③<②B.压强关系:①>③>②C.原子数目:②>③>①D.分子数目:①=②=③
1.误认为22.4 L·ml-1就是气体摩尔体积,其实这只是气体摩尔体积在标准状况下的一个特殊值,在其他条件下气体摩尔体积有其他的值。2.误认为在标准状况下1 ml H2O的体积是22.4 L,其实在标准状况下H2O是液态,不适用标准状况下的气体摩尔体积。3.误认为阿伏加德罗定律只适用于纯净气体,其实气体分子间距只与温度、压强有关,所以只要温度、压强相同,任何气体都适用。4.误认为只有在标准状况下,气体摩尔体积才会是22.4 L·ml-1,其实在其他条件下,气体摩尔体积也可能是22.4 L·ml-1。
(1)三同定一同,也就是说当三个条件相同时,第四个条件一定相同。(2)两同成比例,两侧成正比,同侧成反比。当四个条件中的两个相同时,剩余两个条件成比例,在方程式同侧时成反比,在方程式两侧时则成正比。
为了更好地借助理想气体状态方程理解阿伏加德罗定律及其推论,一位同学设计了如图的实验模型,并设计了几个问题,请你帮助他分析设计的问题,并做出解答。
室温下,某容积固定的密闭容器由光滑的、可移动的活塞隔成A、B两室,两室都有用橡胶塞密封的导气孔(可用注射器针头作为气体、液体的通道)。开始状态如图甲所示,整个容器充满水。然后用注射器先向B室中充入1 ml空气,再向A室中充入一定量H2、O2的混合气体,把水全部排出,此时活塞的位置如图乙所示。
(1)此时A室中混合气体的物质的量为 。
(2)实验测得A室混合气体的质量为34 g,A室中含氧气的物质的量为 ml;该混合气体的密度是同温、
同压时H2密度的 倍。
答案:(2)1 8.5
(3)若将A室中的H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留在 刻度处,容器内气体压强
与反应前气体压强之比为 。
答案:(3)2 1∶2
高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量课堂教学课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量课堂教学课件ppt,共34页。PPT课件主要包含了分点突破1,气体摩尔体积,分点突破2等内容,欢迎下载使用。
高中鲁科版 (2019)第1节 走进化学科学图片课件ppt: 这是一份高中鲁科版 (2019)第1节 走进化学科学图片课件ppt,共53页。PPT课件主要包含了NO1,单位物质的量,L·mol-1,nVm,kPa,同体积,NO2,学习任务1学习任务2,NO3等内容,欢迎下载使用。
鲁科版 (2019)必修 第一册第1节 走进化学科学图文课件ppt: 这是一份鲁科版 (2019)必修 第一册第1节 走进化学科学图文课件ppt,共34页。PPT课件主要包含了分点突破1,气体摩尔体积,分点突破2等内容,欢迎下载使用。













