




化学九年级上册第三节 原子的构成说课课件ppt
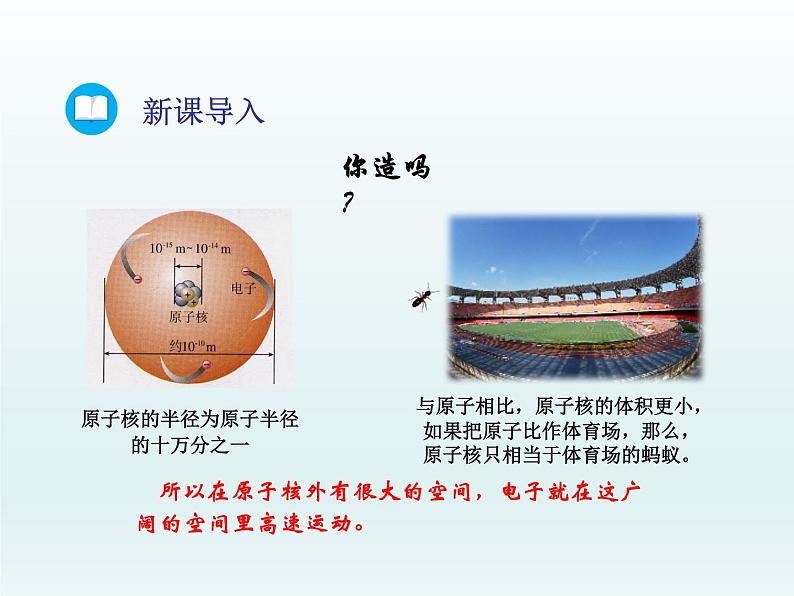
展开原子核的半径为原子半径的十万分之一
与原子相比,原子核的体积更小,如果把原子比作体育场,那么,原子核只相当于体育场的蚂蚁。
所以在原子核外有很大的空间,电子就在这广阔的空间里高速运动。
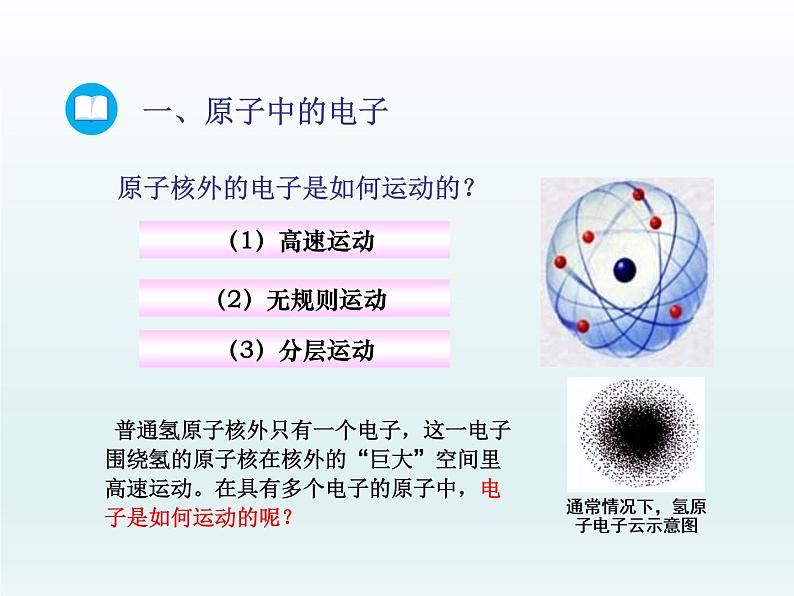
原子核外的电子是如何运动的?
普通氢原子核外只有一个电子,这一电子围绕氢的原子核在核外的“巨大”空间里高速运动。在具有多个电子的原子中,电子是如何运动的呢?
原子核外电子的分层排布
核外电子的运动有自己的特点,有经常出现的区域。科学家把这些区域称为电子层。核外电子是在不同的电子层内运动的,通常把电子在不同的区域内运动的现象叫做核外电子的分层排布。
原子核外电子是分层排布的,最少的有1层,最多的有7层。最外层电子数最多不超过8个(只有第1层的不超过2个)。电子排布时,总是最先排布在离核较近的能量较低的电子层里,然后再依据能量高低逐渐向外层排布。
核外电子分布排列规律(仅限前三层)
1、先“里”后“外”(能量由低到高原则);
2、第一层最多排2个,第二层最多排8个;
3、最外层最多排8个电子 (只有一 个电子层时最多只排 2个电子);
4、每个电子层最多容纳2n2个电 子(n代表电子层数)。
用原子结构示意图可以简明、方便地表示核外电子的分层排布。
我的结构只是为了方便科学探究,可不要把我当成原子的真实结构!
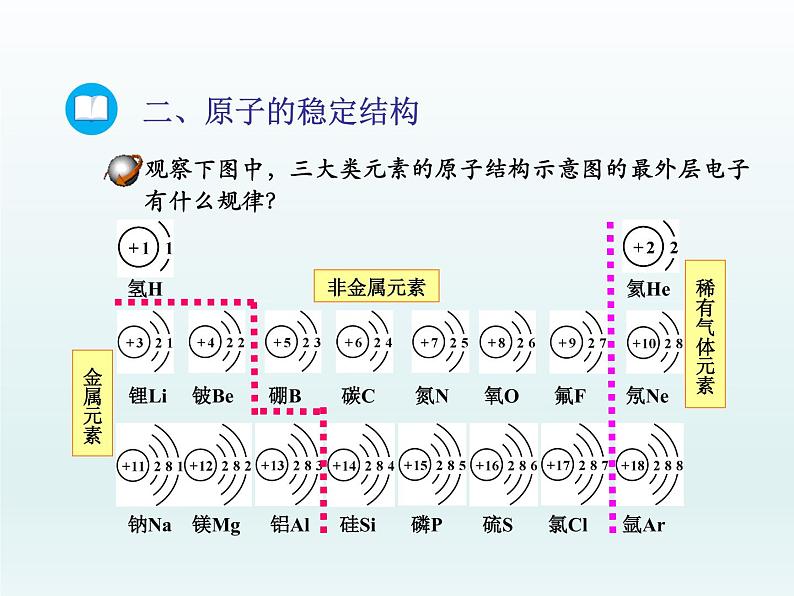
元素的性质与原子最外层电子数的关系
【结论】元素的化学性质与原子核外电子的排布,特别是最外层电子数有密切关系。
1、稀有气体一般不易与其他物质发生化学反应,原因是它们的原子最外层有8个(氦是2个)电子,这样的结构被认为是稳定结构。2、金属原子的最外层电子数一般小于4,在化学反应中易失去最外层电子,从而达到稳定结构。3、非金属原子的最外层电子数一般大于4,在化学反应中易得到电子,使最外层达到稳定结构。
钠原子最外层有1个电子、氯原子最外层有7个电子,最外层都没有达到相对稳定结构,它们发生化学反应时,怎样才能达到相对稳定结构?
钠与氯气反应生成氯化钠的形成过程
金属原子 阳离子
非金属原子 阴离子
离子:带电荷的原子或原子团叫做离子。
⑴阳离子:带正电荷的原子或原子团。
⑵阴离子:带负电荷的原子或原子团。
先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”“-”紧跟在数字后面。
⑴阳离子: H+ Na+ K+ Mg2+ Al3+ NH4+ H3O+ 氢离子 钠离子 钾离子 镁离子 铝离子 铵根离子 水合氢离子
⑵阴离子: F- Cl- O2- S2- 氟离子 氯离子 氧离子 硫离子 NO3- OH- CO32- SO42- 硝酸根离子 氢氧根离子 碳酸根离子 硫酸根离子
2.下列对某种离子变成原子的分析、判断中,正确的是( ) A.一定失去电子 B.一定得到电子 C.得、失电子都有可能 D.既不得电子,也不失电子
3.某元素原子最外层上有2个电子,则此元素是( ) A.一定是非金属元素 B.一定是金属元素 C.一定是稀有气体元素 D.以上说法都不正确
4.某元素的原子结构示意图为 ,该元素原子核内有_____个质子,核外共有_____个电子层,最外电子层上有_____个电子,它容易_____(填“得”或“失”)电子,形成_____(填“阴”或“阳”)离子。
初中化学鲁教版九年级上册第二单元 探索水世界第三节 原子的构成课前预习ppt课件: 这是一份初中化学鲁教版九年级上册第二单元 探索水世界第三节 原子的构成课前预习ppt课件,共27页。PPT课件主要包含了学习目标,新知导入,第一层,第二层,第三层,新知探究,原子结构示意图,核外电子排布规律,氦He,氖Ne等内容,欢迎下载使用。
初中化学鲁教版九年级上册第二单元 探索水世界第三节 原子的构成课文内容ppt课件: 这是一份初中化学鲁教版九年级上册第二单元 探索水世界第三节 原子的构成课文内容ppt课件,共23页。PPT课件主要包含了学习目标,新知导入,知识点1原子的结构,新知探究,原子结构发展史,由此可得出,不带电,原子的内部结构,个单位正电荷,个单位负电荷等内容,欢迎下载使用。
初中化学鲁教版九年级上册第三节 原子的构成习题课件ppt: 这是一份初中化学鲁教版九年级上册第三节 原子的构成习题课件ppt,共27页。PPT课件主要包含了电子的分层排布,电子数,电子层,失去最外层电子,得到电子,阳离子,阴离子,原子核带正电荷,核内质子数为7,该层上的电子数等内容,欢迎下载使用。













