

化学选择性必修2第2节 几种简单的晶体结构模型学案
展开第2节 几种简单的晶体结构模型
基础课时12 金属晶体 离子晶体
学 习 任 务 | 1.能借助金属晶体结构模型认识金属晶体的结构特点。能利用形成晶体的作用力解释金属的性质。培养宏观辨识与微观探析的核心素养。 2.认识几种常见离子晶体的模型,并能解释离子晶体的性质。建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律。 |
一、金属晶体
1.金属晶体的定义及结构特点
(1)金属晶体的定义:金属原子通过金属键形成的晶体称为金属晶体。
(2)金属键:金属阳离子和“自由电子”之间的强的相互作用。
(3)金属键的特点:由于自由电子为整个金属所共有,所以金属键没有饱和性和方向性,从而导致金属晶体最常见的结构型式具有堆积密度大,原子配位数高,能充分利用空间等特点。
2.常见金属晶体的结构
常见 金属 | Ca、Cu、Au、Al、 Pd、Pt、Ag | Li、Na、K、 Ba、W、Fe | Mg、Zn、Ti |
结构 示意图 |
3.物理通性
(1)通性:金属晶体具有金属光泽,有良好的延性、展性和可塑性。
(2)原因:金属键在整个晶体内部起作用。在锻压或锤打时,密堆积层的金属原子之间比较容易产生相对的滑动,这种滑动不会破坏密堆积的排列方式,而且在滑动过程中“自由电子”可以维系整个金属键的存在,因此金属之间虽然发生形变但不断裂。
(1)金属在发生变形延展时,金属键断裂吗?
提示:不断裂。
(2)金属在通常状况下都是晶体吗?金属晶体的性质与哪些因素有关?
提示:不是,如汞;金属键和金属原子的堆积方式决定金属的性质。
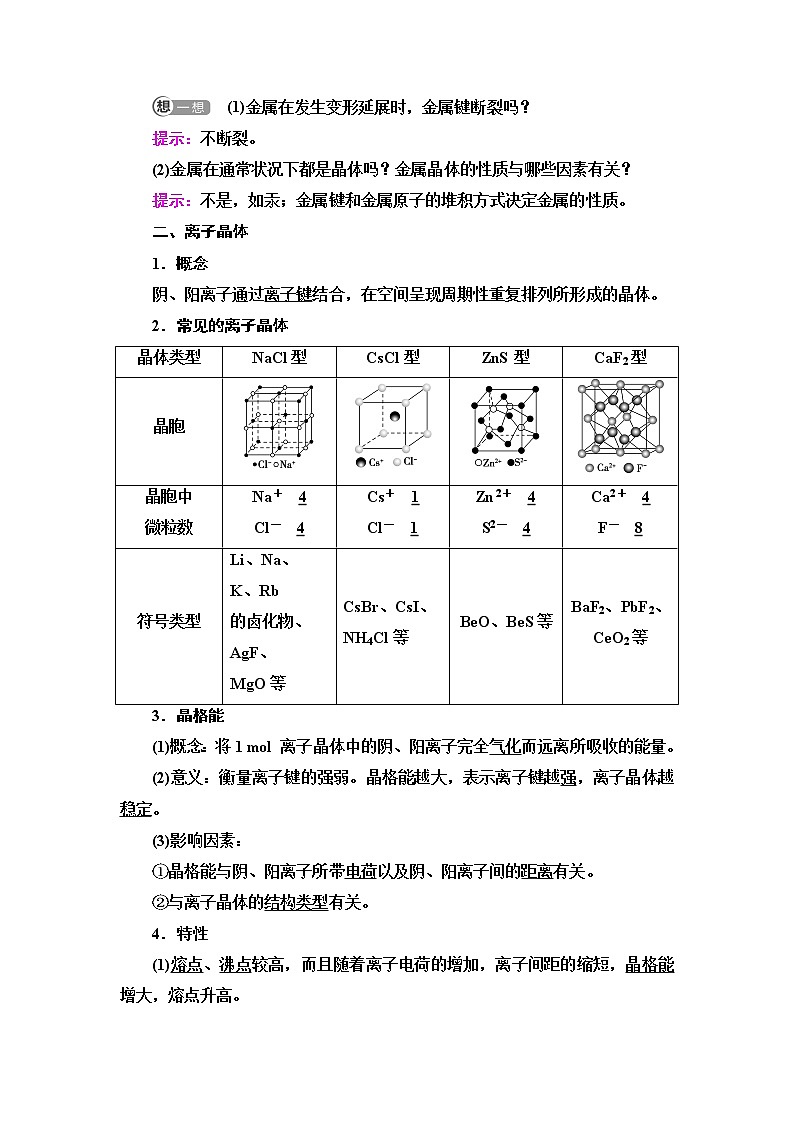
二、离子晶体
1.概念
阴、阳离子通过离子键结合,在空间呈现周期性重复排列所形成的晶体。
2.常见的离子晶体
晶体类型 | NaCl型 | CsCl型 | ZnS型 | CaF2型 |
晶胞 | ||||
晶胞中 微粒数 | Na+ 4 Cl- 4 | Cs+ 1 Cl- 1 | Zn2+ 4 S2- 4 | Ca2+ 4 F- 8 |
符号类型 | Li、Na、 K、Rb 的卤化物、 AgF、 MgO等 | CsBr、CsI、 NH4Cl等 | BeO、BeS等 | BaF2、PbF2、CeO2等 |
3.晶格能
(1)概念:将1 mol 离子晶体中的阴、阳离子完全气化而远离所吸收的能量。
(2)意义:衡量离子键的强弱。晶格能越大,表示离子键越强,离子晶体越稳定。
(3)影响因素:
①晶格能与阴、阳离子所带电荷以及阴、阳离子间的距离有关。
②与离子晶体的结构类型有关。
4.特性
(1)熔点、沸点较高,而且随着离子电荷的增加,离子间距的缩短,晶格能增大,熔点升高。
(2)一般易溶于水,而难溶于非极性溶剂。
(3)在固态时不导电,熔融状态或在水溶液中能导电。
(1)离子晶体一定含有金属阳离子。 ( )
(2)金属晶体和离子晶体的导电实质是一样的。 ( )
(3)固态不导电、水溶液能导电,这一性质能说明某晶体一定是离子晶体。 ( )
[答案] (1)× (2)× (3)×
离子晶体的化学式是表示真正的分子构成吗?
提示:不是。离子晶体的化学式仅代表晶体中阴、阳离子个数比,并不代表分子构成,所以离子晶体中不存在分子。
金属晶体的结构与性质 |
飞机制造中使用大量合金。
1.金属为什么具有较好的延展性?
提示:金属晶体中由于金属阳离子与自由电子间的相互作用没有方向性,各原子层之间发生相对滑动以后,仍可保持这种相互作用,因而即使在外力作用下,发生形变也不易断裂。金属晶体中原子的堆积方式也会影响金属的性质,具有最密堆积结构的金属延展性往往比其他结构的金属的延展性好。
2.合金为何比纯金属的性质优越?
提示:合金内加入了其他元素或大或小的原子,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难。因此,在一般情况下,合金比纯金属硬度大。
1.金属物理通性的解释
2.金属晶体熔点的影响因素
同类型的金属晶体的熔点由金属阳离子半径、离子所带的电荷决定,阳离子半径越小,所带电荷越多,相互作用力就越强,熔点就越高。例如熔点:Li>Na>K>Rb>Cs,Na<Mg<Al。
3.金属晶体的结构
常见金属晶体的四种结构如下表所示:
结构示意图 | ||||
晶胞 | ||||
配位数 | 6 | 8 | 12 | 12 |
a与r的关系(a为晶胞边长,r为金属原子半径) | a=2r(位于边上的两个原子相切) | a=4r(位于体对角线上的三个原子相切) | a=4r(位于面对角线上的三个原子相切) | 设底边边长为a,晶胞高为h,则a=2r(底边上的两个原子相切),h=a |
1.下列叙述错误的是( )
A.构成金属的微粒是金属阳离子和自由电子
B.金属晶体内部都有自由电子
C.金属晶体内自由电子分布不均匀,专属于某个特定的金属离子
D.同一类晶体间熔点(或沸点)相差最大的是金属晶体
C [金属晶体是由金属阳离子和自由电子构成的,自由电子几乎均匀分布在金属晶体内,不专属于某一个或几个特定的金属离子,故A、B正确,C错误;由于金属键的强度差别很大,不同金属晶体的熔、沸点相差较大,故D正确。]
2.铁有δ、γ、α三种晶体结构,如图是δ、γ、α三种晶体不同温度下转化的示意图,下列有关说法不正确的是( )
A.δ-Fe晶体中与每个铁原子距离相等且最近的铁原子有8个
B.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有12个
C.α-Fe晶胞边长若为a cm,γ-Fe晶胞边长若为b cm,则α-Fe和γ-Fe两种晶体的密度比为b3∶4a3
D.将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D [δ-Fe,中心Fe与8个顶点上的Fe距离相等且最近;γ-Fe,与每个铁原子距离相等且最近的铁原子数为8×3×=12,每个晶胞中含铁原子数为8×+6×=4,α-Fe晶胞中含铁原子数为8×=1,则α-Fe和γ-Fe两种晶体的密度比为∶=b3∶4a3;由三种晶体的转化温度关系可以看出急速冷却和缓慢冷却得到两种不同类型的晶体。]
3.(2021·九江高二检测)金属钠晶体的晶胞如下,晶胞的棱长为a。假定金属钠原子为等径的刚性球,且晶胞中处于体对角线上的三个球相切。则钠原子的半径r为( )
A. B. C. D.2a
B [如果沿着某一面的对角线对晶胞作横切面,可得如图所示的结构,其中AB为晶胞的棱长,BC为晶胞的面对角线,AC为晶胞的体对角线。根据立方体的特点可知:BC=a,结合AB2+BC2=AC2得:r=。]
离子晶体的结构与性质理解 |
氯化钠晶体及结构模型
1.1个NaCl晶胞中含有几个Na+、Cl-?
提示:4个Na+和4个Cl-。
2.NaCl晶体熔化时破坏的作用力是什么?
提示:离子键。
1.离子晶体的简单结构类型
晶体类型 | 晶胞示意图 | 结构特点 |
NaCl型(Li、Na、K和Rb的卤化物,AgF,MgO等) | ①Na+、Cl-的配位数均为6 ②每个Na+(Cl-)周围紧邻(距离最近且相等)的Cl-(Na+)构成正八面体 ③每个Na+(Cl-)周围紧邻的Na+(Cl-)有12个 ④每个晶胞中含4个Na+、4个Cl- | |
CsCl型(CsBr、CsI、NH4Cl等) | ①Cs+、Cl-的配位数均为8 ②每个Cs+(Cl-)周围紧邻的Cl-(Cs+)构成正六面体 ③每个Cs+(Cl-)周围紧邻的Cs+(Cl-)有6个 ④每个晶胞中含1个Cs+、1个Cl- | |
ZnS型(BeO、BeS等) | ①Zn2+、S2-的配位数均为4 ②每个Zn2+(S2-)周围紧邻的S2-(Zn2+)构成正四面体 ③每个晶胞中有4个S2-、4个Zn2+ ④Zn2+与S2-之间的最短距离为晶胞体对角线长的 | |
CaF2型 | ①Ca2+的配位数为8,F-的配位数为4,二者的配位数之比等于二者电荷(绝对值)之比 ②每个F-周围紧邻的4个Ca2+构成正四面体,每个Ca2+周围紧邻的8个F-构成立方体 ③每个晶胞中有4个Ca2+、8个F- ④Ca2+与F-之间的最短距离为晶胞体对角线长的 |
2.对离子晶体特性的理解
(1)离子晶体熔、沸点的比较:一般来说,阴、阳离子所带的电荷数越多,离子半径越小,则离子键越强,离子晶体的熔、沸点越高,如Al2O3>MgO;NaCl>CsCl等。
(2)对于离子晶体的熔、沸点,要注意“一般来说”和“较高”等字词。“一般来说”说明离子晶体的熔、沸点还有些特例;“较高”是与其他晶体类型比较的结果。
(3)离子晶体的一些特殊物理性质可用于确定晶体类型。如在固态时不导电,在熔融状态下能导电的晶体一定是离子晶体。
(4)离子晶体导电的前提是先电离出自由移动的阴、阳离子。难溶于水的强电解质如BaSO4、CaCO3等溶于水时,由于浓度极小,故导电性极弱。通常情况下,它们的水溶液不导电。
离子晶体的判断方法
(1)依据组成晶体的微粒和微粒间的作用力判断。
(2)依据物质类别判断。活泼金属氧化物、强碱和绝大多数盐类是离子晶体。
(3)依据导电性判断。离子晶体溶于水和熔融状态下均导电。
(4)依据熔、沸点和溶解性判断。离子晶体熔、沸点较高,多数能溶于水,难溶于有机溶剂。
1.下列描述符合离子晶体性质的是( )
A.熔点1 070 ℃,易溶于水,水溶液能导电
B.熔点10.31 ℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
D.熔点97.81 ℃,质软,导电,密度0.97 g·cm-3
A [离子晶体在液态(即熔融态)时能导电,所以B项描述的不是离子晶体的性质;CS2是非极性溶剂,根据“相似相溶”规律知,C项描述的应是非极性分子晶体的性质;由于离子晶体质硬易碎,且固态不导电,所以D项描述的不是离子晶体的性质。]
2.MgO、Rb2O、CaO、BaO四种离子晶体熔点的高低顺序是( )
A.MgO>Rb2O>BaO>CaO
B.MgO>CaO>BaO>Rb2O
C.CaO>BaO>MgO>Rb2O
D.CaO>BaO>Rb2O>MgO
B [四种离子晶体所含阴离子相同,所含阳离子不同。对Mg2+、Rb+、Ca2+、Ba2+进行比较,Rb+所带电荷数少,其与O2-形成的离子键最弱,故Rb2O的熔点最低。对Mg2+、Ca2+、Ba2+进行比较,它们所带电荷一样多,半径Mg2+<Ca2+<Ba2+,与O2-形成的离子键由强到弱的顺序是MgO>CaO>BaO,相应离子晶体的熔点由高到低的顺序为MgO>CaO>BaO。综上所述,四种离子晶体熔点的高低顺序是MgO>CaO>BaO>Rb2O。]
3.高温下,超氧化钾晶体(KO2)呈立方体结构。图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )
A.KO2中只存在离子键
B.超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O
C.晶体中与每个K+距离最近的O有6个
D.晶体中,所有原子之间都是以离子键结合
C [根据题给信息,超氧化钾晶体是面心立方晶体,超氧化钾晶体(KO2)是离子化合物,阴、阳离子分别为K+、O,晶体中K+与O之间是离子键,O中O—O键为共价键。作为面心立方晶体,每个晶胞中含有×8+×6=4个K+,1+×12=4个O,晶胞中与每个K+距离最近的O有6个(上、下、前、后、左、右)。]
1.可用自由电子与金属离子的碰撞中有能量传递来解释的物理性质是( )
A.金属是热的良导体 B.金属是电的良导体
C.金属有良好的延展性 D.有金属光泽,不透明
A [金属中的自由电子受热后运动速率增大,与金属阳离子碰撞频率增大,可以传递能量,故金属有良好的导热性,A正确。]
2.(2021·浏阳高二检测)一种金属晶体与一种离子晶体相比较,正确的是( )
A.金属晶体一定比离子晶体微粒堆积更密集
B.金属晶体一定比离子晶体硬度大
C.金属晶体一定比离子晶体熔点高
D.金属晶体固态时一定能导电,但离子晶体不能
D [一般来说,金属晶体和离子晶体的微粒堆积方式均为密堆积,但具体到某一种金属晶体或离子晶体,就很难说谁的微粒堆积更密集了。离子晶体的熔点和硬度普遍较高;金属晶体的熔点和硬度有的很高,也有的很低。金属晶体都有导电性,离子晶体熔融态时都能导电,固态时不导电。]
3.下列关于晶格能的叙述中正确的是( )
A.晶格能是气态原子形成1 mol离子晶体所释放的能量
B.晶格能仅与形成晶体的离子半径有关
C.晶格能是指相邻的离子间的静电作用
D.晶格能越大的离子晶体,其熔点越高、硬度越大
D [晶格能是将1 mol离子晶体中的阴、阳离子完全气化而远离所吸收的能量,晶格能与离子所带电荷的多少成正比,与阴、阳离子核间距离成反比。晶格能越大,晶体的熔、沸点越高,硬度也越大,所以D项正确。]
4.氟在自然界中常以CaF2的形式存在。下列有关CaF2的表述正确的是( )
A.Ca2+与F-间仅存在静电吸引作用
B.F-的离子半径小于Cl-,则CaF2的熔点低于CaCl2
C.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
D.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
D [CaF2为离子化合物,熔融状态下能导电,Ca2+与F-间既有静电吸引作用,又有静电排斥作用,A错,D对;离子半径越小,离子键越强,故CaF2的熔点高于CaCl2的熔点,B错;阴阳离子比为2∶1的物质,其晶体构型与阴阳离子的半径的相对大小有关,C错。]
5.下图是ZnS、CsCl、NaCl晶体的结构模型,根据图示回答下列问题:
甲 乙 丙
(1)分别写出三种晶体结构模型对应物质的化学式:甲________、乙________、丙________。在这三种晶体中,与阳离子最近且等距离的阴离子在空间围成的几何构型分别为__________________________。
(2)在NaCl、CsCl晶体中,每个Cl-的周围和它等距离且最近的Cl-分别有________个、________个。
[解析] 在ZnS晶体中,阴、阳离子的配位数都是4,故丙表示该晶体结构,与Zn2+等距离且最近的S2-构成正四面体结构;在NaCl晶体中阴、阳离子的配位数都是6,故乙表示该晶体结构,与Na+等距离且最近的6个Cl-构成正八面体,由于晶体中Cl-采用A1型最密堆积,故每个Cl-的周围和它等距离且最近的Cl-有12个;在CsCl晶体中,阴、阳离子的配位数都是8,故甲表示该晶体结构,与Cs+等距离且最近的8个Cl-构成立方体,设定甲的中心离子为Cl-,每个Cl-的周围和它等距离且最近的Cl-位于该立方体周围的6个立方体的体心,所以有6个。
[答案] (1)CsCl NaCl ZnS 立方体、正八面体、正四面体 (2)12 6
化学选择性必修3第3节 醛和酮 糖类和核酸导学案: 这是一份化学选择性必修3第3节 醛和酮 糖类和核酸导学案,共15页。学案主要包含了常见的醛酮等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体第2课时导学案: 这是一份高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体第2课时导学案,共12页。学案主要包含了离子晶体,过渡晶体与混合型晶体等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体第2课时学案设计: 这是一份高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体第2课时学案设计,共12页。学案主要包含了离子晶体,过渡晶体与混合型晶体等内容,欢迎下载使用。













