






鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型教学课件ppt
展开【归纳整合】1.晶胞计算的类型(1)根据晶胞的结构,计算其组成微粒间的距离。(2)根据晶胞的质量和晶体有关的摩尔质量间的关系,计算微粒个数、微粒间距、ρ等。(3)计算晶体(晶胞)的空间利用率。
2.晶胞计算的原理与步骤(1)确定晶胞的组成:利用“均摊法”计算一个晶胞所含微粒的数目。 注意:a.当晶胞为正六棱柱时,其顶点上的粒子被6个晶胞共用,每个粒子属于该晶胞的部分为 ,而不是 。
b.审题时一定要注意是“分子结构”还是“晶体结构”,若是分子结构,其化学式由图中所有实际存在的原子个数决定,且原子个数可以不互质(即原子个数比可以不约简)。(2)计算晶体的密度或体积①关系式ρ= (V表示晶胞体积,ρ表示晶体的密度,NA表示阿伏加德罗常数,N表示一个晶胞实际含有的微粒数,M表示微粒的摩尔质量)。
②计算模式晶体的密度:③晶胞空间利用率(占有率)的计算表达式晶胞的空间利用率= ×100%。
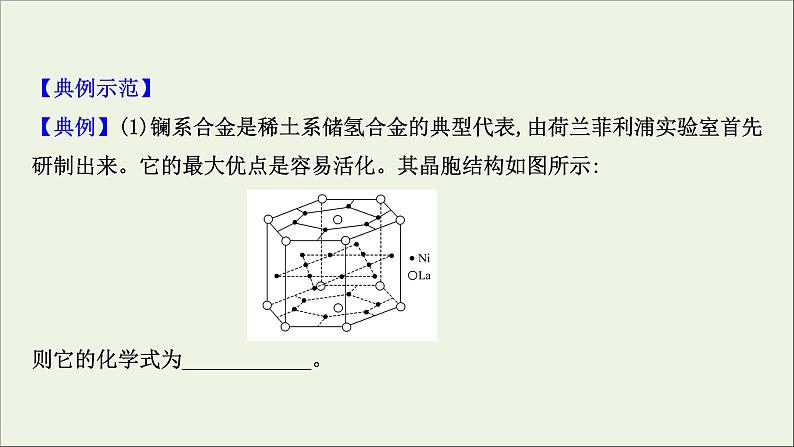
【典例示范】【典例】(1)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示: 则它的化学式为____________。
(2)GaAs的熔点为1 238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键结合。Ga和As的摩尔质量分别为MGa g·ml-1和MAs g·ml-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为________。 【解题指南】解答本题注意以下两点:(1)会利用“切割法”计算晶胞的组成;(2)注意一些常见公式的应用。
【解析】(1)根据晶胞结构图可知,晶面上的原子为2个晶胞所共有,顶角上的原子为6个晶胞所共有,内部的原子为整个晶胞所有,所以晶胞中La原子个数为3,Ni原子个数为15,则镧系合金的化学式为LaNi5。(2)根据晶胞结构示意图用切割法计算出1个晶胞中含有As原子的个数:8× +6× =4,再通过观察可知1个晶胞中含有4个Ga原子。4个As原子和4个Ga原子的总体积V1=4×( π×10-30× ×10-30× ) cm3;1个晶胞的质量为4个As原子和4个Ga原子的质量之和,即( ) g,所以1个晶胞的体积V2= (MAs+MGa) cm3。最后由 ×100%即得结果。
答案:(1)LaNi5(2)共价晶体 共价 ×100%
【素养训练】1.下列有关晶体结构的叙述正确的是( ) A.SiO2晶体中最小环上的原子个数为6B.在晶体中只要有阳离子就一定有阴离子C.12 g石墨烯(如图1)中含有六元环的个数为0.5×6.02×1023D.720 g C60晶体中含有0.5×6.02×1023个晶胞(如图2)
【解析】选C。A项,二氧化硅晶体结构中,每个硅原子结合4个氧原子,同时每个氧原子结合2个硅原子,最小环上有6个Si原子和6个O原子,所以共有12个原子,错误;B项,含有阳离子的晶体不一定含有阴离子,错误;C项,12 g石墨烯为1 ml,石墨烯中平均每个六元环含有2个碳原子,则1 ml石墨烯中含有六元环的个数为0.5×6.02×1023,正确;D项,C60为分子晶体,晶胞中含有C60的个数为8× +6× =4,720 g C60晶体中含有6.02×1023个C60,所以720 g C60晶体中含有0.25×6.02×1023个晶胞,错误。
2.金属钾、铜的晶体的晶胞结构分别如图A、B所示。 据此回答以下两个问题:(涉及计算的说明具体的计算过程)(1)钾、铜两种晶体晶胞中金属原子的配位数之比是多少?提示:钾原子的配位数是8,铜原子的配位数是12,所以钾、铜两种晶体晶胞中金属原子的配位数之比为8∶12=2∶3。
(2)金属钾的晶胞中,若设该晶胞的密度为a,阿伏加德罗常数为NA,钾原子的摩尔质量为M,则表示钾原子半径的计算式是什么?提示:金属钾的晶胞中,钾原子数目=1+8× =2,钾原子的摩尔质量为M,阿伏加德罗常数为NA,则晶胞质量= ,该晶胞的密度为a,则晶胞体积 ,晶胞棱长= ,设钾原子半径为r,则晶胞体对角线长度=4r,故3( )2=(4r)2,故r= 。
3.(2020·山东等级考模拟节选)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属于正交晶系(长方体形),晶胞参数为a pm,b pm和c pm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为________;CsSiB3O7的摩尔质量为M g·ml-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为________g·cm-3(用代数式表示)。
【解析】原子分数坐标为(0.5,0.2,0.5)的Cs原子位于晶胞体内,原子分数坐标为(0,0.3,0.5)及(1.0,0.3,0.5)的Cs原子位于晶胞的yz面上,原子分数坐标为(0.5,0.8,1.0)及(0.5,0.8,0)的Cs原子位于晶胞xy面上,原子分数坐标为(0,0.7,1.0)(1.0,0.7,1.0)(0,0.7,0)(1.0,0.7,0)的Cs原子位于晶胞平行于y轴的棱上,利用均摊法可计算该晶胞中共含Cs原子4个;代入晶胞密度求算公式可得:ρ= g·cm-3= g·cm-3= ×1030 g·cm-3。答案:4 ×1030
4.(1)(2018·海南卷节选)四方晶系CuFeS2的晶胞结构如右图所示。①Cu+的配位数为________,S2-的配位数为________。 ②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________g·cm-3(列出计算式)。 (2)(2016·全国卷Ⅰ节选)锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为 ;C为( 0)。则D原子的坐标参数为__________。 ②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为__________g·cm-3(列出计算式即可)。
【解析】(1)①根据晶胞图,1个Cu+周围有4个S2-,Cu+配位数为4,1个S2-周围有2个Fe、2个Cu,配位数为4。②该晶胞中Cu个数为6× +4× =4,Fe个数为8× +4× +1=4,S个数为8,即含有4个CuFeS2,该晶胞的质量为m= 4 g,晶胞体积为V=0.524×10-7 cm×0.524×10-7 cm×1.032×10-7 cm,故晶体密度为ρ=( 4 g)÷(0.524×10-7 cm×0.524×10-7 cm×1.032×10-7 cm)= g·cm-3。
(2)①原子坐标参数是表示晶胞内部各原子的相对位置,根据Ge单晶的晶胞图,分析原子坐标参数A为(0,0,0);B为( ,0, );C为( , ,0)可知D原子的坐标参数为( , , )。②Ge单晶的晶胞参数a=565.76 pm,晶胞的体积为a3,a需要进行单位换算,晶胞的质量为 ,晶胞的密度为晶胞质量除以晶胞体积,所以晶胞密度= ×107(g·cm-3)。答案:(1)①4 4 ② (2)①( , , ) ② ×107
5.(2019·福州高二检测)X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57。Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态。(1)U2+的外围电子排布式为________。 (2)X、Y、Z 可以形成化学式为XYZ的分子。该分子中各原子均达到稀有气体稳定结构,则该分子中Y采取的杂化轨道类型为________。 (3)比较Y和W的第一电离能,较大的是__________(填元素符号)。 (4)X与Z形成的最简单化合物Q的分子构型为________。(5)U+与Z3-形成的晶胞结构如图所示,阴、阳离子间的核间距为a cm。与同一个Z3-相连的U+有______个,该晶体的密度为________ g·cm-3。(设NA表示阿伏加德罗常数)
【解析】X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57,Y原子的L层p轨道中有2个电子,则Y为碳元素;Z的原子核外有三个未成对电子,Z原子序数大于Y,W与Y原子的价电子数相同,W原子序数大于Z,所以W是硅元素、Z为氮元素;U原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态,则U为铜元素,根据核电荷数知,X是氢元素;
(1)U2+为Cu2+,其3d能级上9个电子为其外围电子,据此书写其外围电子排布式为3d9;(2)H、C、N 可以形成化学式为HCN的分子。该分子中各原子均达到稀有气体稳定结构,则该分子中碳原子价层电子对数是2且不含孤电子对,根据价层电子对互斥理论判断碳原子采取的杂化方式为sp;(3)Y是C、W是硅元素,二者处于同一主族,同一主族元素第一电离能随着原子序数增大而减小,所以第一电离能较大的是C;(4)H与N形成的最简单化合物NH3的分子构型为三角锥形;(5)Cu+与N3-形成的晶胞结构如图所示,则晶胞边长为2a cm,该晶胞中白色球个数=8× =1、灰色球个数=12× =3,根据化合价知,白色球表示氮离子、灰色球表示亚铜离子,与同一个N3-相连的Cu+有6个,该晶体的密度ρ= g·cm-3= g·cm-3。
答案:(1)3d9 (2)sp (3)C (4)三角锥形 (5)6
6.M是第4周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:M与Y形成的一种化合物的立方晶胞如图所示。 (1)该化合物的化学式为_________,已知晶胞参数a=0.542 nm,此晶体的密度为___________g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA) (2)该化合物难溶于水,但易溶于氨水,其原因是___________。 此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为________。
【解析】M是第4周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,则M为29号铜元素。元素Y的负一价离子的最外层电子数与次外层的相同,则Y为17号的氯元素。(1)该晶胞中含4个氯原子和4个铜原子,所以该化合物的化学式为CuCl,晶胞参数a=0.542 nm=5.42×10-8 cm,先计算1 ml晶胞的质量为m=4×M(CuCl)=4×99.5 g·ml-1,体积为V=NA×a3=NA(5.42×10-8 cm)3=5.423NA×10-24 cm3,所以此晶体的密度ρ= g·cm-3。
(2)该化合物难溶于水但易溶于氨水,其原因是Cu+可与氨形成易溶于水的配位化合物。由此化合物的氨水溶液遇到空气被氧化为深蓝色,联系我们学过的配合物[Cu(NH3)4]SO4,所以此深蓝色溶液中阳离子的化学式为[Cu(NH3)4]2+。答案:(1)CuCl (2)Cu+可与氨形成易溶于水的配位化合物[Cu(NH3)4]2+
7.碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题:(1)氮气分子中σ键和π键的比值为______;基态铜原子的电子排布式为_____.(2)C、N、F三种元素第一电离能由大到小的顺序为_________;三种元素分别形成的最简单氢化物中属于非极性分子的是__________(填化学式)。 (3)NF3是微电子工业中优良的等离子刻蚀气体,NF3分子的空间构型为___________; 在NF3中,氮原子的杂化轨道类型为___________。(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示。金刚砂晶体类型为__________,每个碳原子周围最近的碳原子数目为__________,若晶胞参数为a cm,阿伏加德罗常数为NA,则金刚砂的密度为________g·cm-3(不需要化简)。
【解析】(1)1个氮气分子中有1个σ键和2个π键,所以比值为1∶2;铜为29号元素,基态铜原子的电子排布式为1s22s22p63s23p63d104s1。(2)一般非金属性越强,第一电离能越大,因此C、N、F三种元素第一电离能由大到小的顺序为F>N>C;三种元素分别形成的最简单氢化物分别为CH4、NH3、HF,甲烷呈正四面体形,属于非极性分子,氨气呈三角锥形,属于极性分子,HF是双原子形成的极性分子,所以属于非极性分子的是CH4。(3)NF3的中心氮原子价电子对数为(5+3)/2=4,氮原子的杂化轨道类型为sp3杂化,氮原子有一对孤电子对,NF3分子的空间构型为三角锥形。
高中第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型教学课件ppt: 这是一份高中第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型教学课件ppt,共60页。PPT课件主要包含了课前自主学习,非金属单质,非金属化合物,氧化物,sp3,°28′,正四面体,2堆积方式,较弱的分子间作用力,分子间作用等内容,欢迎下载使用。
高中化学第2节 几种简单的晶体结构模型教学ppt课件: 这是一份高中化学第2节 几种简单的晶体结构模型教学ppt课件,共51页。PPT课件主要包含了课前自主学习,概念及物理性质,金属原子,金属键,金属阳离子,自由电子,阳离子和阴离子,离子键,阴离子,晶格能等内容,欢迎下载使用。
高中化学第3节 元素性质及其变化规律习题ppt课件: 这是一份高中化学第3节 元素性质及其变化规律习题ppt课件,共29页。













