






化学鲁科版 (2019)第4节 离子反应课文内容ppt课件
展开1.通过离子方程式书写规则的学习,能用化学用语正确表示水溶液中的离子反应。2.通过离子平衡知识的学习,能从离子反应的角度分析溶液的性质。
学习任务1 离子反应发生的条件
1.离子反应的定义:通常将溶液中 之间发生的反应称为离子反应。2.离子反应的类型(1)离子交换型(复分解型)离子反应。没有元素化合价变化,一般没有分子或原子参加,一般是阴、阳离子间反应。(2)氧化还原型离子反应。有元素化合价变化,可能是离子—离子、离子—原子或离子—分子之间发生反应。
离子之间以及离子与原子或分子
3.离子反应发生的条件(1)离子交换型(复分解型)离子反应。通常必须是“阴、阳离子间才可能反应”,当阴、阳离子间结合为 、 或 才能反应。(2)氧化还原型离子反应。①自发氧化还原反应:符合以强制弱(即氧化性为氧化剂>氧化产物,还原性为还原剂>还原产物)才能发生。②非自发氧化还原反应:通过外加直流电源才能发生。
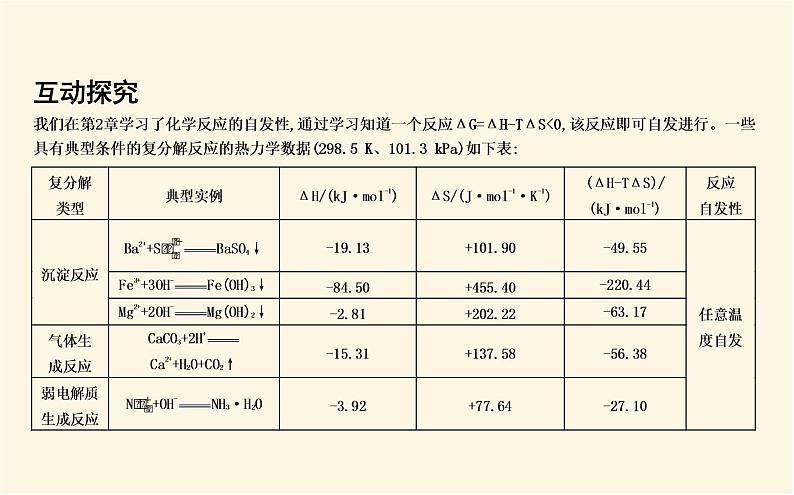
我们在第2章学习了化学反应的自发性,通过学习知道一个反应ΔG=ΔH-TΔS<0,该反应即可自发进行。一些具有典型条件的复分解反应的热力学数据(298.5 K、101.3 kPa)如下表:
据上表可知常见的生成沉淀、气体、弱电解质的反应一般可以发生。除了从热化学角度分析离子反应是否可以发生,也可以从平衡常数角度出发分析离子反应是否可以发生及反应程度。探究1 从平衡常数角度探究复分解型离子反应(平衡常数单位省略)问题1:已知Ksp[Ca(OH)2]=4.7×10-6 ml3·L-3,分析 0.1 ml·L-1的CaCl2溶液与0.1 ml·L-1的NaOH溶液等体积混合能否反应?
问题2:0.01 ml·L-1的CaCl2溶液与0.01 ml·L-1的NaOH溶液等体积混合能否反应?提示:同上计算Q=1.25×10-7 ml3·L-3<4.7×10-6 ml3·L-3,所以反应不能发生。
探究2 从氧化性、还原性强弱角度探究氧化还原型离子反应问题5:根据阳离子放电顺序(即氧化性顺序),分析为什么印刷电路板反应可以发生。
提示:O与S在同一主族,O在S上一周期,所以氧化性O2>S,符合“以强制弱”原则,所以反应可以发生。
常见类型离子反应总结1.离子交换型(复分解型)离子反应(1)生成难溶物或微溶物:常见酸、碱、盐溶解性可参考必修第一册最后附录,沉淀转化型反应也属于此类型。
(2)配位反应:Fe3+与SCN-生成Fe(SCN)3;Ag+与NH3·H2O生成[Ag(NH3)2]+;Cu2+与NH3·H2O生成[Cu(NH3)4]2+等。
(1)离子大量共存问题,本质上就是离子反应发生的条件问题,离子间发生反应则必然不能大量共存。(2)离子大量共存问题解题思路:首先考虑离子间是否能发生氧化还原反应,如果不能发生氧化还原反应,再考虑是否能发生复分解型离子反应。复分解型离子反应一般反应原则是“阴、阳离子反应”,阴、阳离子结合为沉淀、弱电解质、气体、配合物时就不能共存。
学习任务2 离子方程式
1.离子方程式的书写方法以CaCO3与HCl的反应为例。
微点拨:化学式拆写要点(1)易溶于水的强电解质均写成离子形式,包括强酸、强碱、大多数可溶性盐;其他均用化学式表示,如单质、氧化物、气体、弱电解质(弱酸、弱碱、水)、非电解质、难溶性盐。(2)微溶物写法:微溶物作为反应物,若是溶液,写离子符号,若是浊液,写化学式;微溶物作为生成物,一般写化学式。(3)酸式盐的写法:多元弱酸根离子不能拆开写;强酸酸式酸根离子拆开写。(4)一水合氨写法:一水合氨作为反应物时写NH3·H2O;作为生成物时,若加热条件或浓度大时,NH3·H2O分解,写成NH3↑+H2O,若无加热条件且浓度很小,写成NH3·H2O。
(2)检查化学式拆写是否正确。
(7)检查是否符合用量关系,即过量、少量、等物质的量、适量、任意量、逐滴加入引起的用量变化等对反应产物的影响。
(8)检查反应条件的影响。①有的反应与试剂的滴加顺序有关。如Na2CO3溶液中逐滴加入稀盐酸,离子方程式为 。稀盐酸中逐滴加入Na2CO3溶液,离子方程式为 ;再如AlCl3溶液与NaOH溶液、Na[Al(OH)4]溶液与盐酸反应等。
②浓度条件:如硝酸与铜反应时,浓硝酸被还原为 ,稀硝酸一般被还原为 ;再如浓硫酸与Zn反应,浓硫酸被还原为 ,稀硫酸被还原为 等。
离子方程式用实际参加反应的离子的符号表示反应,相对化学方程式来讲,离子方程式更简洁,能从更深层次表示一个反应的本质。探究 离子方程式的书写问题1:盐酸与NaOH溶液混合发生中和反应,盐酸中有哪些离子?氢氧化钠溶液中有哪些离子?这些离子是否自由?提示:盐酸中含有H+、Cl-、OH-(极少);NaOH溶液中含有Na+、OH-、H+(极少);离子均为自由离子。问题2:盐酸与氢氧化钠溶液混合后,离子种类有没有改变?离子的数量如何改变?提示:种类没有改变;但H+与OH-数量大幅度降低,两者结合为H2O分子。
问题3:盐酸与氢氧化钠溶液反应过程中Cl-与Na+数量有没有改变?两者反应前后自由度有无改变?提示:两者数量没有改变;反应前后均为自由离子。问题4:通过上述分析,你认为离子方程式的本质是什么?提示:离子方程式实际上是把没有参与反应的离子(种类、数量、自由度均没有变化)删除之后,用实际参与反应的离子(种类改变或数量改变或自由度改变的离子)表示化学反应。
“定一法”书写酸式盐与碱反应的离子方程式(1)根据相对量将少量物质定为“1 ml”,若少量物质有两种或两种以上离子参加反应,则参加反应的离子的物质的量之比与物质组成之比相符。(2)根据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的物质的量。(3)根据“先中和后沉淀”的思路正确书写离子方程式。
警惕离子方程式书写与判断四大陷阱1.“拆分”陷阱离子方程式的正误判断中,常常设置物质是否能“拆分”的陷阱,氧化物、弱电解质、沉淀、多元弱酸的酸式酸根离子在离子方程式中均不能拆分。在学习时,应熟记常见的弱电解质、溶解度表及常见多元弱酸的酸式酸根离子。2.“守恒”陷阱离子方程式除符合质量守恒外,还应符合电荷守恒,做题时往往只注意质量守恒,而忽略电荷守恒,这也是命题者经常设置的“陷阱”。
4.“量比”陷阱在离子方程式正误判断中,做题时往往忽略相对量的影响,命题者往往设置“离子方程式正确,但不符合相对量”的陷阱。突破“陷阱”的方法:一是审准“相对量”的多少,二是看离子反应是否符合该相对量。
【易错提醒】1.误认为电解质参加的反应都能写成离子方程式。其实不然,固体之间的反应不能写成离子方程式,如高锰酸钾受热分解、氯化铵固体与氢氧化钙固体反应等。2.误认为澄清透明溶液一定为无色溶液,其实无色溶液是没有颜色的溶液,而澄清透明溶液是没有不溶物质、透明的溶液,比如CuSO4溶液就是澄清透明的溶液,但不是无色溶液。
4.误认为离子之间可以反应就永远能反应,其实离子反应是有条件的,随着条件改变,反应可能也会变化,比如Ca2+与OH-,因为Ca(OH)2是微溶物,所以两种离子浓度较大时(满足Q>Ksp)就会反应,而浓度较小时(Q
离子反应与氧化还原反应在生产、生活中用途广泛,请按要求完成反应并配平。(2)胃液中含有盐酸,胃酸过多的人常有胃疼、烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式: 。
离子反应与氧化还原反应在生产、生活中用途广泛,请按要求完成反应并配平。(3)写出铁和水蒸气反应的化学方程式: 。
离子反应与氧化还原反应在生产、生活中用途广泛,请按要求完成反应并配平。
命题解密与解题指导情境解读:离子反应、氧化还原反应在生产、生活中的应用。素养立意:通过离子反应发生的条件分析,培养学生模型认知素养。思维建模:新情境下陌生化学方程式、离子方程式的书写1.掌握常见的氧化剂、还原剂(1)强氧化性物质或离子:Na2O2、Fe3+、NO2、HNO3(浓)、HNO3(稀)、O2、O3、H2O2、H2SO4(浓)、Cl2、Br2、HClO、NaClO、Ca(ClO)2、KMnO4(H+)等。
2.掌握常见的氧化剂、还原剂发生氧化还原反应的产物
高中化学鲁科版 (2019)选择性必修1第4节 离子反应课前预习课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第4节 离子反应课前预习课件ppt,共55页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,离子反应,原子或分子,浓度降低,离子方程式,答案C,答案B等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第4节 离子反应公开课课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第4节 离子反应公开课课件ppt,共23页。PPT课件主要包含了学习目标,离子与原子或分子,浓度降低等内容,欢迎下载使用。
化学选择性必修1第4节 离子反应备课ppt课件: 这是一份化学选择性必修1第4节 离子反应备课ppt课件,共52页。PPT课件主要包含了内容索引,必备知识,自我检测,问题探究,归纳拓展,应用体验,答案C,答案A,答案B等内容,欢迎下载使用。













