



高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化课文内容ppt课件
展开自主预习·新知导学
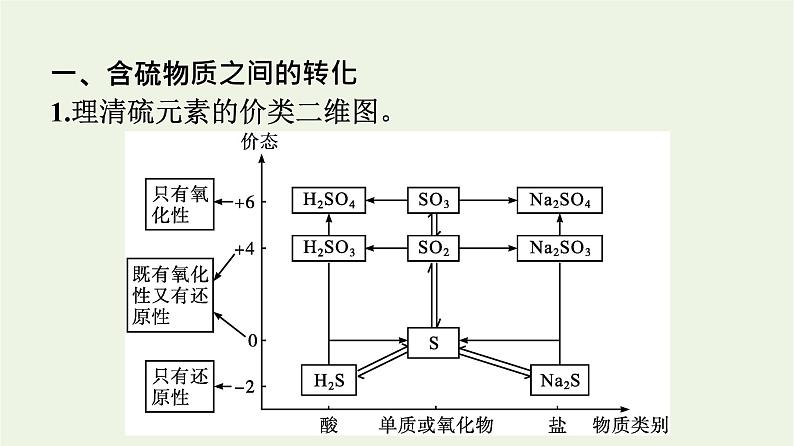
一、含硫物质之间的转化1.理清硫元素的价类二维图。
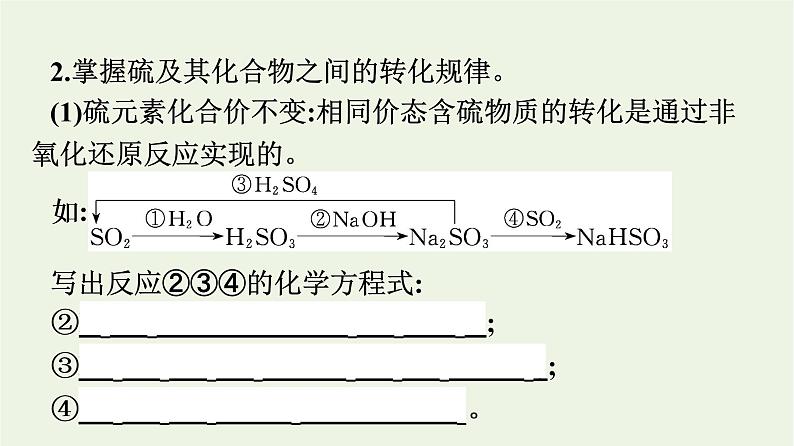
2.掌握硫及其化合物之间的转化规律。(1)硫元素化合价不变:相同价态含硫物质的转化是通过非氧化还原反应实现的。
写出反应②③④的化学方程式:
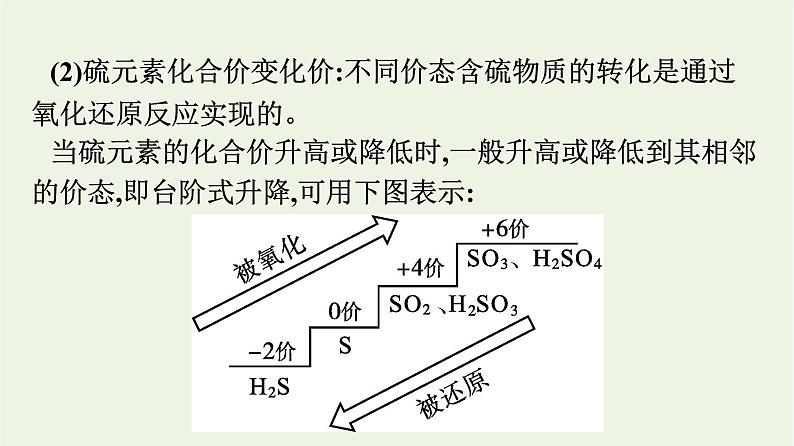
(2)硫元素化合价变化价:不同价态含硫物质的转化是通过氧化还原反应实现的。当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,可用下图表示:
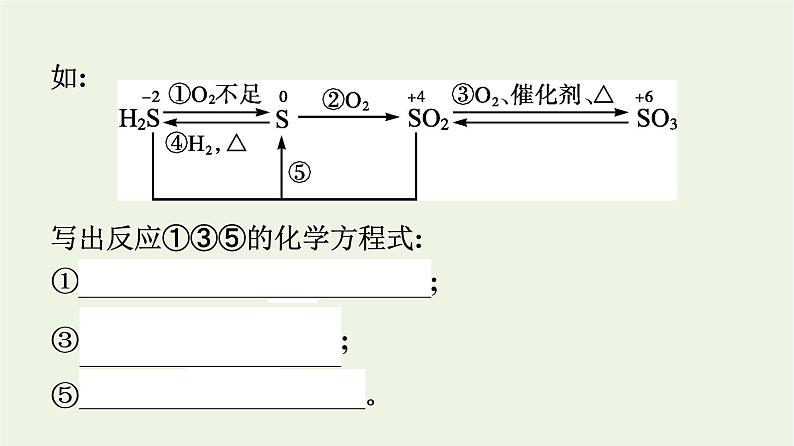
如:写出反应①③⑤的化学方程式:
二、氧化还原反应方程式的配平1.配平原则。(1)原子守恒原则:反应物和生成物中各原子种类及其原子个数不变。(2)得失电子守恒原则:氧化剂所得电子总数等于还原剂所失电子总数。
2.配平的四个步骤。以碳和浓硫酸反应生成二氧化碳、二氧化硫和水为例,化学方程式的配平步骤如下:(1)写出反应物、生成物的化学式。在化学方程式中标出。
答案:化合价发生变化的元素的化合价
(2)根据化合价的变化标出电子转移的方向和数目。
(3)使得失电子的总数相等。
(4)根据质量守恒定律配平其他物质的化学计量数,并添加气体符号,注明反应条件,将单线改为双线。
【自主思考1】 浓硫酸具有强氧化性,能否与SO2发生氧化还原反应呢?提示:不能。同种元素相邻价态的物质间不发生氧化还原反应,如S和H2S、S和SO2、SO2和浓硫酸之间均不发生氧化还原反应。
【自主思考3】 氧化还原反应方程式配平过程中,只需保证化合价升降总数相等就可以了,这句话正确吗?提示:根据化合价升降只能确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,可保证得失电子总数相等,但不代表其他元素原子守恒,还必须通过观察法,用已确定的化学计量数配未知的化学计量数,保证其他原子或电荷守恒,还要考虑溶液的酸碱性。
【效果自测】 1.写出下图关系中有关反应的化学方程式:
2.已知A是一种不溶于水的固体,在一定条件下有下列转化关系(部分产物及H2O省略)。试回答下列问题:(1)写出物质的化学式:A ,E 。 (2)写出下列反应的化学方程式:B+C→A: , F(浓)→C: 。 (3)写出D和F的稀溶液反应的离子方程式: 。
解析:由A+H2→B,A+O2 C知:A元素的化合价既能升高,也能降低,故A为非金属元素,B为氢化物,C为氧化物,且B+C→A,则A为硫,进一步推知B为H2S,C为SO2,D为FeS,E为SO3,F为H2SO4。
3.配平下列反应的方程式:(1) KI+ KIO3+ H2SO4══ I2+ K2SO4+ H2O
答案:(1)5 1 3 3 3 3(2)2 16 10 2 5 8(3)1 5 8 1 5 4(4)2 5 8 5 2 5
合作探究·释疑解惑
探究任务 陌生氧化还原反应方程式的书写
问题引领1.完成“氧化除铁”反应的离子方程式:
2.KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴、阳离子个数比为1∶1。写出该反应的化学方程式: 。 提示:KClO3(Cl的化合价为+5价)受热分解生成的无氧酸盐是KCl,另一含氧酸盐中氯元素的化合价必须比+5价高,可能为+6价或+7价,若为+6价,形成的盐中阴、阳离子个数比不可能为1∶1,只能是+7价,故该含氧酸盐为KClO4,据此可写出该反应的化学方程式:4KClO3 KCl+3KClO4。
归纳提升陌生氧化还原反应方程式的书写步骤1.配平的三原则:
2.配平按以下四步进行:
注意配平顺序,首先须根据题目信息,推出氧化剂、还原剂、氧化产物、还原产物,再使化合价升降总数相等,最后使原子或电荷守恒,用已知化学计量数确定未知化学计量数,注意环境。
典型例题【例题1】 将NaBiO3固体(黄色,微溶)加入 MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
解析:(1)由溶液显紫色可推知有 生成,确定含有化合价变化元素物质的化学计量数:化合价分析如下:Bi由+5价→+3价,化合价降低2价,Mn由+2价→+7价,化合价升高5价,根据最小公倍数法可知,NaBiO3和Bi3+前的化学计量数为5,Mn2+和 前的化学计量数为2。(2)利用原子守恒确定缺项物质及其他物质的化学计量数。
(3)据补项原则,在酸性条件下,方程式左边多O,故应补H+,而方程式右边少O,故应补H2O,再根据原子守恒配平H+和H2O之前的化学计量数:
【例题2】 KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的离子方程式是 。
解析:第一步,依题意,锰元素的化合价降低,故KMnO4是氧化剂,Mn2+是还原产物;碳元素的化合价升高,故Na2C2O4(碳元素化合价为+3价)是还原剂,CO2是氧化产物。
【变式训练1】 配平下列反应的化学方程式。
答案:(1)3 6 5 1 3(2)3 6 2 1 3(3)1 3 3 3 1(4)1 1 1 4
【变式训练2】 写出下列反应的离子方程式。(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 。 (2)硫化氢具有还原性,可以与许多氧化剂反应,在酸性条件下,H2S与KMnO4溶液反应生成S、MnSO4、K2SO4和H2O,写出该反应的离子方程式: 。 (3)KClO3与KI淀粉溶液混合后溶液显蓝色,假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为 。
(4)Na2S2O3还原性较强,在溶液中易被Cl2氧化成 ,常用作脱氯剂,该反应的离子方程式为 。 (5)利用钴渣[含C(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:C(OH)3溶解还原反应的离子方程式为 。
高中化学苏教版 (2019)必修 第一册专题4 硫与环境保护第二单元 硫及其化合物的相互转化背景图ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册专题4 硫与环境保护第二单元 硫及其化合物的相互转化背景图ppt课件,共44页。PPT课件主要包含了氧化还原,蓝紫色,有刺激性,√√×,含硫物质之间的转化等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化评课课件ppt: 这是一份苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化评课课件ppt,共52页。PPT课件主要包含了分点突破1,含硫物质之间的转化,分点突破2,点击此处进入文档,基础全面练等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化课文课件ppt: 这是一份苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化课文课件ppt,共35页。PPT课件主要包含了概念认知·自主学习,能力形成·合作探究,学情诊断·课堂测评等内容,欢迎下载使用。













