

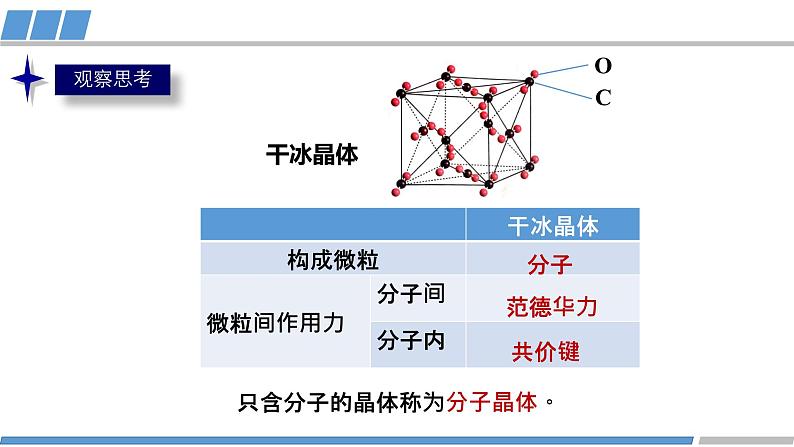



高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第二节 分子晶体与共价晶体教学课件ppt
展开只含分子的晶体称为分子晶体。
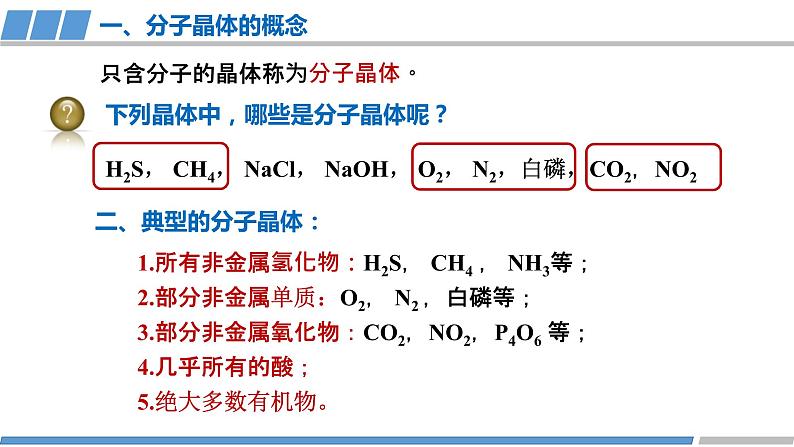
一、分子晶体的概念
下列晶体中,哪些是分子晶体呢?
H2S, CH4, NaCl, NaOH, O2, N2,白磷,CO2,NO2
1.所有非金属氢化物:H2S, CH4 , NH3等;2.部分非金属单质:O2, N2 ,白磷等;3.部分非金属氧化物:CO2,NO2,P4O6 等;4.几乎所有的酸;5.绝大多数有机物。
2.稀有气体的晶体是否含有共价键?
稀有气体是单原子分子,不存在共价键。
1.所有的分子晶体内部都只有范德华力吗?
有的分子晶体如冰晶体,分子间还存在氢键。
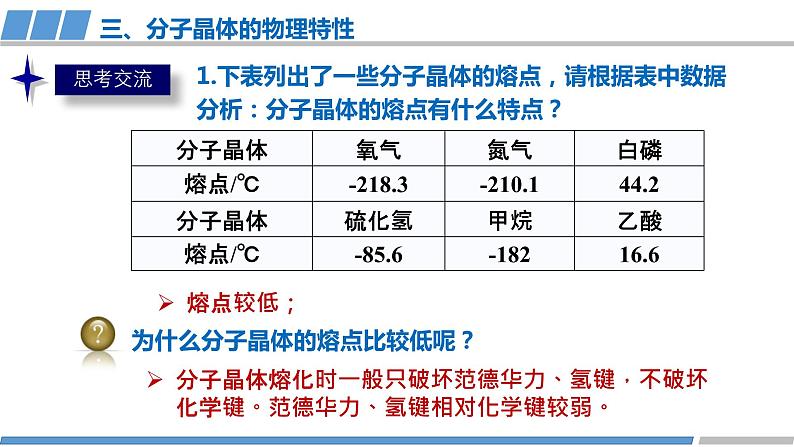
1.下表列出了一些分子晶体的熔点,请根据表中数据分析:分子晶体的熔点有什么特点?
分子晶体熔化时一般只破坏范德华力、氢键,不破坏化学键。范德华力、氢键相对化学键较弱。
三、分子晶体的物理特性
为什么分子晶体的熔点比较低呢?
(2Mg+CO2 2MgO+C)。
块状的干冰与镁粉接触面积不大,为什么镁粉可以继续燃烧呢?
现象:镁粉在干冰内继续燃烧,像冰灯中装进一个电灯泡一样,发出耀眼的白光。(切勿用手接触干冰,以免冻伤!)
干冰在常压下极易升华,通常用作制冷剂
2.溜冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
原因:分子间作用力较弱,容易被克服
分子晶体(如冰晶体)一般硬度比较小,如何从结构的角度进行解释呢?
构成分子晶体的微粒都是分子,熔融时没有产生自由移动的离子,因此分子晶体一般不导电。
3.分子晶体(如乙醇)一般都是绝缘体,熔融状态下也不导电。从结构的角度又应该如何解释呢?
熔沸点低硬度小不导电溶解性——“相似相溶”
冰晶体,不易升华,密度小于干冰
1.上图中,每个干冰晶胞中有多少个CO2分子?
四、分子晶体的微粒堆积方式——干冰晶体
2.在干冰晶体中,每个CO2分子周围等距紧邻的CO2分子有多少个?
每个CO2分子周围等距紧邻的CO2分子有12个。
如果分子间作用力只是范德华力,若以一个分子为中心,其周围最多可以有12个紧邻的分子,分子晶体的这一特征称为分子密堆积。
冰晶体中,每个水分子周围有多少个紧邻的水分子?和干冰晶体一样吗?若不一样,可能的原因是什么?
在冰晶体中,每个水分子周围只有4个紧邻的水分子。因为水分子间存在氢键,氢键具有方向性,每个水分子都与4个相邻的水分子相互吸引,构成四面体,属于非密堆积。
四、分子晶体的微粒堆积方式——冰晶体
冰晶体中1 ml H2O最多有多少ml 氢键?
冰晶体中,每个水分子与其它4个水分子形成氢键,每个氢键由2个水分子均摊,故4×1/2=2,每个水分子平均形成2个氢键。即冰晶体1 ml H2O中最多含有2 ml氢键。
冬季河水结冰后,冰块往往浮在水面,为什么冰的密度比水小呢?
由于氢键的方向性,使冰晶体中每个水分子与四面体顶角方向的4个相邻水分子相互吸引,形成空隙较大的网状体。冰融化后,分子间的空隙减小。所以冰的密度比水小,结的冰会浮在水面上。
(1)0-4℃时,温度升高,热运动使缔合水分子的部分氢键断裂,分子间空隙减小,密度增大;
水的密度随温度变化的曲线如下图所示。0-4℃,水的密度随温度的升高而增大。超过4℃,水的密度随温度的升高而减小。为什么会这样呢?
(2)超过4℃时,温度升高,水分子热运动速度加快,使得分子的平均距离加大,密度减小。
四、分子晶体的微粒堆积方式
硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
硫化氢晶体中分子之间只有范德华力,范德华力无饱和性与方向性,能够形成分子密堆积。因此,一个硫化氢分子周围有12分紧邻分子。而冰晶体中水分子间存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子形成氢键。因此,冰中一个水分子周围只有4个紧邻分子。
20世纪末,科学家发现海底存在大量天然气水合物晶体——可燃冰。
科学 ∙ 技术 ∙社会 P80
天然气水合物—一种潜在的能源
2017年5月18日,我国南海神狐海域天然气水合物试采实现连续超过7天稳定产气。
一种甲烷水合物晶体中,平均每46个分子构成8个水分子笼,每个水分子笼可容纳1个甲烷分子或水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,这种可燃冰的平均分子组成是 A. CH4·5H2O B. CH4·6H2O C. CH4·7H2O D. CH4·8H2O
科学 ∙ 技术 ∙社会
分子晶体 一、概念 组成微粒及微粒间相互作用 二、典型的分子晶体 三、物理特性 四、微粒堆积方式 1.只有范德华力,无分子间氢键——密堆积 2.有分子间氢键——非密堆积
1.下列关于分子晶体的说法正确的是A. 分子内均存在共价键B. 分子间一定存在范德华力C. 分子间一定存在氢键D. 晶体的熔、沸点一般较高
2.下列各组物质都属于分子晶体的是A.碘、二氧化碳、白磷、C60B.NaCl、二氧化碳、白磷、二氧化硫C.SO2、金刚石、N2、铜D.醋酸、甲烷、石墨、氧化钠
3.下列性质适合于分子晶体的是( ) ①熔点1 070 ℃,易溶于水,水溶液导电 ②熔点10.31 ℃,液态不导电,水溶液导电 ③能溶于CS2,熔点112.8℃,沸点444.6 ℃ ④熔点97.81 ℃,质软、导电,密度为0.97 g·cm-3 A.①② B.①③ C.②③ D.②④
4.下列说法正确的是A. 范德华力普遍存在于分子之间,如液态水中因范德华力的存在使水分子发生缔合B. H2SO4为强电解质,硫酸晶体是能导电的C. 冰中1个H2O分子可通过氢键与4个水分子相连,所以冰中H2O分子与氢键的数目之比为1∶4D. 氢键有饱和性和方向性,所以液态水结成冰时体积会变大
A.4个 B.8个C.12个 D.6个
高中化学第二节 分子晶体与共价晶体多媒体教学ppt课件: 这是一份高中化学第二节 分子晶体与共价晶体多媒体教学ppt课件,共32页。
人教版 (2019)选择性必修3第二节 醇酚教学ppt课件: 这是一份人教版 (2019)选择性必修3第二节 醇酚教学ppt课件,共21页。PPT课件主要包含了茶多酚,茶和茶多酚,苯酚的结构,C6H6O,官能团,苯酚的物理性质,苯酚的还原性,得到浑浊溶液,溶液变得澄清,出现浑浊等内容,欢迎下载使用。
化学选择性必修3第二节 醇酚教学ppt课件: 这是一份化学选择性必修3第二节 醇酚教学ppt课件,共22页。PPT课件主要包含了酒的主要成分是什么,参考答案,③⑤⑥,2①②③⑤等内容,欢迎下载使用。














