




2021学年第四章 化学反应与电能第二节 电解池教学课件ppt
展开氯气和烧碱是重要的化工原料。工业上利用电解饱和食盐水制氯气和烧碱,称为氯碱工业。
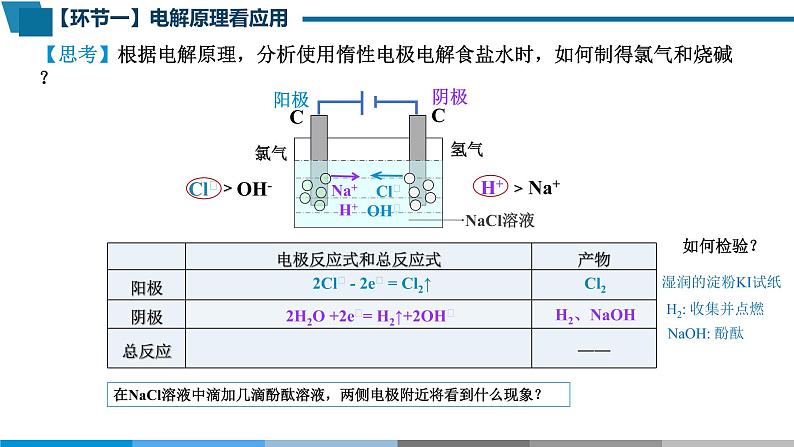
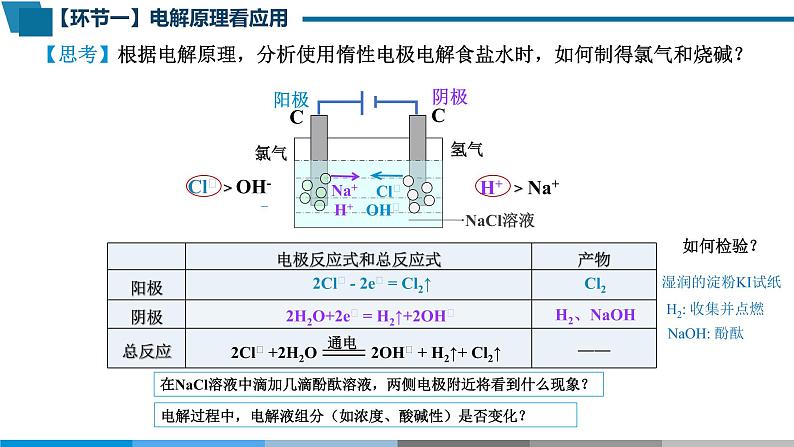
H+ Na+
Cl﹣ OH-
2H2O +2e﹣= H2↑+2OH﹣
2Cl﹣ - 2e﹣ = Cl2↑
在NaCl溶液中滴加几滴酚酞溶液,两侧电极附近将看到什么现象?
【思考】根据电解原理,分析使用惰性电极电解食盐水时,如何制得氯气和烧碱?
电解过程中,电解液组分(如浓度、酸碱性)是否变化?
2H2O+2e﹣ = H2↑+2OH﹣
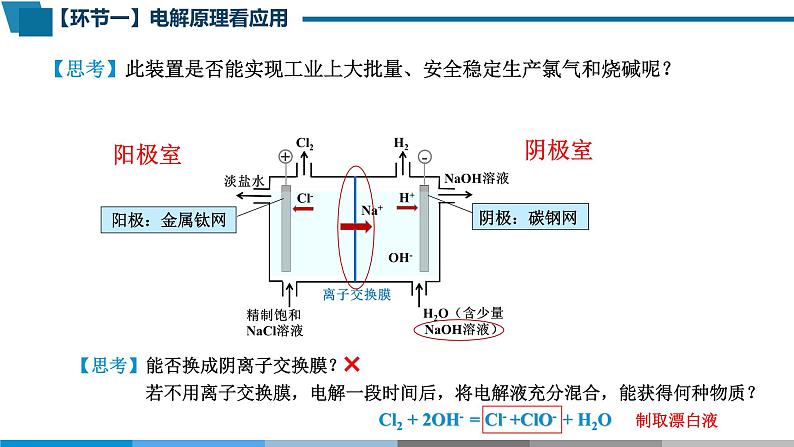
【思考】此装置是否能实现工业上大批量、安全稳定生产氯气和烧碱呢?
离子交换膜的作用: a. 防止Cl2和H2混合而引起爆炸; b. 避免Cl2与NaOH反应生成NaClO,影响NaOH的产量和质量。
【思考】能否换成阴离子交换膜? 若不用离子交换膜,电解一段时间后,将电解液充分混合,能获得何种物质?
Cl2 + 2OH- = Cl- +ClO- + H2O
(含Zn、Fe、Ni、Ag、Au等杂质)
Cu2+ +2e- =Cu
①Zn-2e-=Zn2+ ②Fe-2e-=Fe2+③Ni-2e-=Ni2+ ④
活性电极放电顺序: Zn > Fe > Ni > Cu > Ag > Au
电解精炼过程中,电解液组分(如浓度、酸碱性)是否变化?
Cu-2e-=Cu2+
请应用电解原理,设计实验方案,在铁钉上镀铜。
Cu2+ +2e-=Cu
电镀过程中,电镀液组分(如浓度、酸碱性)是否发生变化?
Cu2+ +2e-=Cu
【思考】工业上是如何制备金属钠的?
2Na+ +2e﹣ = 2Na
2Cl﹣ —2e﹣ = Cl2↑
1921年,电解熔融氯化钠制取金属钠得以实现工业化。
1807年,英国化学家戴维通过电解熔融碳酸钠制得金属钠。
2Al2O3(熔融) 4Al+3O2↑
6O2- -12e﹣ == 3O2↑
4Al3+ +12e﹣ == 4Al
MgCl2(熔融) Mg+Cl2↑
2Cl﹣ -2e﹣== Cl2↑
Mg2+ +2e﹣ == Mg
【思考】电解熔融NaCl的方法可制备金属钠,金属Mg、Al如何制备呢?
阴极:Mn+ + ne﹣ == M
1. 下列叙述错误的是( )A.生铁中含有碳,抗腐蚀能力比纯铁弱B.用锡焊接的铁质器件,焊接处易生锈C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液D.铁管上镶嵌锌块,铁管不易被腐蚀
2. 利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )A. 电解时以精铜作阳极B.电解时阳极发生还原反应C.粗铜连接电源负极,其电极反应是Cu = Cu2+ + 2e-D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
3. 下列描述中,不符合生产实际的是( )A.电解熔融的氧化铝制取金属铝,用铁作阳极B.电解法精炼粗铜,用纯铜作阴极C.在冶金工业上,常用电解法制取钠、镁、铝等金属D.在镀件上电镀锌,用锌作阳极
人教版 (2019)选择性必修1第二节 电解池图文课件ppt: 这是一份人教版 (2019)选择性必修1第二节 电解池图文课件ppt,共41页。PPT课件主要包含了拓展延伸,方法技巧等内容,欢迎下载使用。
化学第二节 电解池图文ppt课件: 这是一份化学第二节 电解池图文ppt课件,共39页。PPT课件主要包含了拓展延伸,特别提醒等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池教学课件ppt,共44页。PPT课件主要包含了课前·新知导学,抗腐蚀,CuSO4溶液,阳极泥,获得电子,活泼金属,课堂·重难探究,重难突破,典例精练,2计算的方法等内容,欢迎下载使用。













