






鲁科版 (2019)微项目 青蒿素分子的结构测定——晶体在分子结构测定中的应用教课内容课件ppt
展开1.测定分子结构及组成的方法(1)质谱法:用电场和磁场将运动的离子(带电荷的原子、分子或分子碎片,有分子离子、同位素离子、碎片离子、重排离子、多电荷离子、亚稳离子、负离子和离子-分子相互作用产生的离子)按它们的质荷比分离后进行检测的方法。可以进行相对分子量测定、化学式的确定及结构鉴定等。(2)红外光谱法:将分子吸收红外光的情况用仪器记录就得到该试样的红外吸收光谱图,利用光谱图中吸收峰的波长、强度和形状来判断分子中的基团,对分子进行结构分析。
(3)核磁共振谱法:NMR是研究原子核对射频辐射的吸收,它是对各种有机和无机物的成分、结构进行定性分析的最强有力的工具之一,有时亦可进行定量分析。(4)X射线衍射法:使用X射线探测某些分子或晶体结构的科研方法。
2.分子空间结构的测定程序分析图像→测定晶胞参数→推算原子坐标→计算原子距离→判断化学键及其类型→确定分子结构。3.借助晶体X射线衍射测定分子结构的基本思路
【情境·思考】将具有一定波长的X射线照射到结晶性物质上时,X射线因在结晶内遇到规则排列的原子或离子而发生散射,散射的X射线在某些方向上相位得到加强,从而显示与结晶结构相对应的特有的衍射现象,这种方法可以测定分子的结构。
我国科学家在1975年利用晶体X射线衍射的方法,确定了青蒿素的分子结构。已知青蒿素的分子式为C15H22O5,据此思考:(1)青蒿素的分子量是多少?提示:282。(2)青蒿素分子中存在的化学键的类型有哪些?提示:极性共价键和非极性共价键。
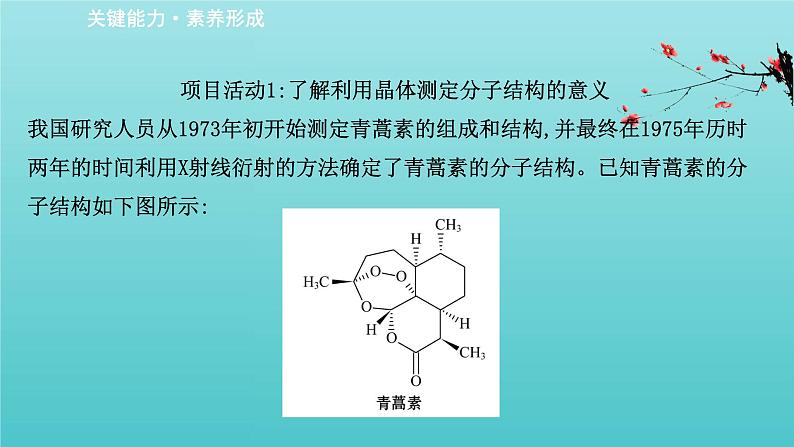
项目活动1:了解利用晶体测定分子结构的意义我国研究人员从1973年初开始测定青蒿素的组成和结构,并最终在1975年历时两年的时间利用X射线衍射的方法确定了青蒿素的分子结构。已知青蒿素的分子结构如下图所示:
青蒿素的分子结构的测定历时很长,那么研究人员是如何测定的青蒿素的分子结构呢?又是使用了何种方式测定的其结构呢?带着这些问题,让我们一起研究以下具体过程吧。
【活动探究】根据教材内容,填写下表,说明青蒿素分子的测定过程。
【思考·讨论】(1)测定青蒿素分子结构时,科研人员遇到了什么困难?提示:不论是常规的实验方法还是质谱、红外光谱等仪器的测定手段,都只能帮助我们认识分子的官能团等的结构特点。(2)为什么用一般的测定方法无法准确测定青蒿素分子的空间结构?提示:因为一般方法只能测定简单分子的官能团以及分子结构,但是对于青蒿素这种复杂的分子的结构,一般方法难以进行精准判断。
【探究总结】晶体X射线衍射法测定分子结构的程序
【迁移应用】1.下列可用于判断某物质为晶体的方法是( )A.质谱法 B.红外光谱法C.核磁共振法D.X射线衍射法
【解析】选D。质谱法用于测定有机物的相对分子质量,不能判断某物质为晶体,故A错误;红外光谱仪能测定出有机物的官能团和化学键,不能判断某物质为晶体,故B错误;核磁共振氢谱用于测定有机物分子中氢原子的种类和数目,不能判断某物质为晶体,故C错误;晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,X射线衍射可以看到微观结构,可以鉴别晶体与非晶体,故D正确。
2.化学分析的手段通常有定性分析、定量分析、仪器分析等,现代化学中仪器分析是研究物质结构的基本方法和实验手段。下列仪器分析手段的运用科学可行的是( )A.光谱分析:利用原子光谱上的特征谱线来鉴定元素B.质谱分析:利用质荷比来测定分子立体结构C.红外光谱分析:利用分子吸收与化学键振动频率相同的红外线来测定晶体晶型D.X衍射图谱分析:利用X射线透过物质时记录的分立斑点或谱线来测定分子结构
【解析】选A。光谱分析:利用原子光谱上的特征谱线来鉴定元素,选项A正确;质谱分析:利用质荷比来测定有机物相对分子质量,选项B错误;红外光谱分析:利用有机化合物分子中不同基团的特征吸收频率不同来初步判断有机化合物中具有哪些基团,选项C错误;X衍射图谱分析:利用X射线透过物质时记录的分立斑点或谱线来测定晶体结构,选项D错误。
【补偿训练】 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如图所示。
随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m g NaCl固体并转移到定容容器A中;②用滴定管向定容容器A中加入苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为V mL。回答下列问题:
(1)步骤①中A仪器最好用________(填仪器名称); (2)你认为步骤②中用________(填“酸式”或“碱式”)滴定管,原因是____; (3)能否用胶头滴管代替步骤②中的滴定管________,其原因是___________。 (4)经X射线衍射仪测得NaCl晶体中最邻近Na+和Cl-平均距离为a cm。则利用上述方法测得的阿伏加德罗常数的数学表达式为NA=____________。
【解析】(1)定容容器为容量瓶,具有一定体积并便于振荡;(2)苯具有腐蚀性,易腐蚀碱式滴定管中的橡皮管,只能用酸式滴定管;(3)不能,因为胶头滴管无法准确测出苯的体积;(4)NaCl的密度为m/V g·cm-3,NaCl晶胞的体积为(2a)3 cm3,则NaCl晶胞的质量为m/V×(2a)3 g,一个NaCl晶胞含4个“NaCl”,而每个“NaCl”的质量为M(NaCl)/NA=58.5/NA g,故:m/V×(2a)3 g=4×58.5/NA g,即
答案:(1)容量瓶(2)酸式 因苯能腐蚀碱式滴定管的橡皮管(3)否 无法测出滴加苯的体积 (4)
项目活动2:借助原子位置确定分子空间结构通过X射线衍射可以确定每个原子的位置,但究竟哪些原子通过化学键连接在一起?他们以何种化学键连接?带着这个问题,结合数学中学习的空间坐标系,让我们进一步勾勒出青蒿素分子的空间结构吧!
【思考·讨论】(1)借助X射线衍射测定原子坐标,我们可以得到哪些重要数据?提示:可以得到分子的结构、键长、键角等反映分子或晶体结构特点的重要数据。(2)如何理解现代化学已经发展成为实验与理论并重的科学?提示:一是实验手段不断升级优化,出现了各种分析和测试物质组成的实验技术,推动了化学的发展;二是基于计算机支持的理论化学与计算化学的发展,推动人们对物质结构的研究进入一个新的时代。
【迁移应用】1.南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,经X射线衍射测得晶体结构,其局部结构如图所示(其中 的立体结构是平面五元环)。下列说法正确的是( )
A.所有N 原子的价电子层均有孤电子对B.氮氮键的键能: >H2N—NH2C.两种阳离子是等电子体D.阴阳离子之间只存在离子键
【解析】选B。 中N原子N形成4个σ键,没有孤电子对,故A错误; 中氮氮原子间除形成σ键外,还形成一个大π键,氮氮键的键能: >H2N—NH2,故B正确;H3O+、 原子数不同,不是等电子体,故C错误;由图可知,除阴、阳离子间形成离子键外,氯离子与铵根离子中H原子、H3O+中H原子与 中N原子、 中H原子与 中N原子形成氢键,故D错误。
2.(1)X射线衍射测定等发现,I3AsF6中存在 离子。 离子的几何构型为________,中心原子的杂化类型为________。 (2)CS2分子中,C原子的杂化轨道类型是________。 (3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为____________。 (4)CH3COOH中C原子轨道杂化类型为________。
【解析】(1)X射线衍射测定等发现,I3AsF6中存在 离子。 离子的价层电子对数为 ,由于中心原子只形成2个共价键,故其有2个孤电子对,故其几何构型为角形,中心原子的杂化类型为sp3。(2)CS2分子中,C原子价层电子对数为 ,中心原子没有孤电子对,故其杂化轨道类型是sp。 (3)OF2分子的中心原子的价层电子对数为 ,中心原子还有2个孤电子对,故其分子的空间构型为角形,其中氧原子的杂化方式为sp3。
(4)CH3COOH中C原子有两种,甲基中的碳原子与相邻原子形成4个共用电子对、没有孤电子对,故其轨道杂化类型为sp3;羧基中的碳原子与氧原子形成双键,还分别与甲基上的碳原子、羟基中的氧原子各形成1个共用电子对,没有孤电子对,故其轨道杂化类型为sp2。答案:(1)角形 sp3 (2)sp (3)角形 sp3 (4)sp3、sp2
3.铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:(1)用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,阿伏加德罗常数为______________(已知Ar(Cu)=63.6);
(2)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为______;
(3)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是____________________________________________, 反应的化学方程式为_______________________________________________。
【解析】(1)设面心立方晶胞的边长为a,则晶胞的体积为a3,每个晶胞中有四个原子,则这四个原子的质量为4M/NA(M为该原子的相对原子质量),所以晶体密度为 。将ρ=9.00 g·cm-3,a=361 pm,M=63.6,代入上式可以计算NA=6.01×1023 ml-1。(2)a位置上Cl原子形成2个单键,含有2对孤电子对,杂化轨道数为4,杂化轨道类型为sp3。一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,阴离子构成与[CuCl3]-一样,但因为Cu为+1价,所以应该为 ,其化学式为K2CuCl3。
(3)氨水、过氧化氢和铜单独不反应,而同时混合能反应,说明两者能互相促进反应,是两种物质共同作用的结果:其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,方程式可表示为Cu+H2O2+4NH3==== +2OH-。答案:(1)6.01×1023 ml-1(2)sp3 K2CuCl3(3)过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行Cu+H2O2+4NH3==== +2OH-
1.下列关于晶体的叙述正确的是( )A.晶体中只要有阳离子就一定有阴离子B.区分晶体和非晶体最可靠的方法是对固体进行X射线衍射实验C.分子晶体中共价键键能越大熔点和沸点越高D.金属晶体发生形变时,内部金属离子与“自由电子”的相互作用消失
【解析】选B。金属晶体是由金属阳离子和自由电子构成的,所以晶体中有阳离子不一定存在阴离子,故A错误; 构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X射线衍射图谱反映出来。因此,区分晶体和非晶体的最可靠的科学方法是对固体进行X射线衍射实验,故B正确; 分子晶体熔点和沸点与分子间作用力有关,与共价键键能无关,故C错误; 金属晶体发生形变时其内部金属离子与“自由电子”发生滑动,但金属离子和自由电子之间的相互作用仍然存在,故D错误。
2.(2020·武汉高一检测)下列说法中,不正确的是( )A.NH5中所有原子的最外层都符合相应稀有气体原子电子层结构,1 ml NH5中含有4NA个N—H键B.金属键无方向性,金属晶体中原子尽可能采取紧密堆积C.凡AB3型的共价化合物,其中心原子A均采用sp2杂化轨道成键D.乙醇与水互溶可以用“相似相溶”原理和氢键来解释
【解析】选C。A项,NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,根据N原子价电子数为5,H原子价电子数为1,可知该物质为离子晶体NH4H,含有的阳离子 与阴离子H-之间通过离子键结合,在 中含有N与H原子之间通过4个极性键N—H结合,因此1 ml NH5含有4NA个N—H键,正确;B项,金属键无方向性,金属原子总是尽可能多地吸引其他原子,金属晶体中原子尽可能采取紧密堆积,从而使空间被充分利用,正确;C项,AB3型共价化合物中,若A上没有孤电子对,则A采用sp2杂化轨道成键,如BF3等,若A上有1对孤电子对,则A采用sp3杂化轨道成键,如NH3等,错误;D项,乙醇与水互溶的原因是:(1)乙醇和水都是极性分子,(2)乙醇和水分子中都含O—H键,乙醇和水分子间形成氢键,乙醇与水互溶可以用“相似相溶”原理和氢键解释,正确。
3.(2020·杭州高一检测)化合物NH3与BF3可以通过配位键形成NH3·BF3,下列说法正确的是( )A.NH3与BF3都是极性分子B.NH3与BF3都是平面三角形结构C.可以通过晶体X射线衍射等技术测定BF3的结构D.NH3·BF3中,NH3提供空轨道,BF3提供孤电子对
【解析】选C。BF3分子为非极性分子,故A错误;BF3分子构型为平面三角形,NH3分子构型为三角锥形,故B错误;可以通过晶体X射线衍射等技术测定BF3的结构,故C正确;NH3·BF3中B原子有空轨道,N原子有孤电子对,所以NH3提供孤电子对,BF3提供空轨道,形成配位键,故D错误。
4.(2020·南京高一检测)某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应)。
(1)用A、B、O表示这类特殊晶体的化学式__________。在图中,与A原子配位的氧原子数目为__________。 (2)基态Cr原子的核外电子排布式为________________,其中电子的运动状态有__________种。 (3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为__________。
(4)如表是几种碳酸盐的热分解温度和阳离子半径:
请解释碳酸钙热分解温度最低的原因:___________________________。 (5)用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为a pm,阿伏加德罗常数的值为NA,金属钙的密度为________g·cm-3(用含a和NA的式子表示)。
【解析】试题分析:(1)A位于顶点,B位于体心,O位于面心,则晶胞中A的个数为8×1/8=1,B的个数为1,O的个数为6×1/2=3,所以化学式为ABO3。晶胞中与A最近的氧原子位于同一平面内的面心,每个晶胞中有3/2个氧与A距离最近,而A为8个晶胞共有,则与A原子配位的氧原子数目为8×3/2=12。(2)铬元素为24号,原子核外有24个电子,所以电子排布为1s22s22p63s23p63d54s1;每个电子的运动状态都不同,所以有24种不同的电子。(3)氮原子和氧原子的价电子排布分别为2s22p3,2s22p4,则未成对的电子数目比为3∶2。
(4)从表格中得出,这些物质的阴离子是相同的,均为碳酸根,阳离子的半径越大,分解温度越高,碳酸盐的热分解是由于晶体中的阳离子结合碳酸根中的氧离子,使碳酸根分解为二氧化碳分子的结果。钙离子由于半径小和氧离子结合更为容易,氧化钙晶格能大,所以碳酸钙分解温度低。(5)钙的晶胞为面心立方最密堆积,则晶胞中含有钙的数目为4,晶胞的体积为(a×10-10)3 cm3,则密度=
高中化学鲁科版 (2019)选择性必修2微项目 青蒿素分子的结构测定——晶体在分子结构测定中的应用教学演示课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修2微项目 青蒿素分子的结构测定——晶体在分子结构测定中的应用教学演示课件ppt,共60页。PPT课件主要包含了确定分子式,官能团,碳骨架上的位置,课前自主学习,质量分数,相对分子质量,质谱仪,nC+1-,原子核,射频辐射等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2微项目 青蒿素分子的结构测定——晶体在分子结构测定中的应用课堂教学ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2微项目 青蒿素分子的结构测定——晶体在分子结构测定中的应用课堂教学ppt课件,共60页。PPT课件主要包含了必备知识·素养奠基,共价键,立体网状,sp3,°28′,正四面体,氢化物,非金属单质,非金属氧化物,有机物等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2微项目 青蒿素分子的结构测定——晶体在分子结构测定中的应用背景图ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2微项目 青蒿素分子的结构测定——晶体在分子结构测定中的应用背景图ppt课件,共40页。PPT课件主要包含了必备知识·素养奠基,对称轴,对称面,旋光性,不相同,分子极性的判断,关键能力·素养形成,常见分子的极性,课堂回眸,课堂检测·素养达标等内容,欢迎下载使用。













