






高中化学鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键课文配套ppt课件
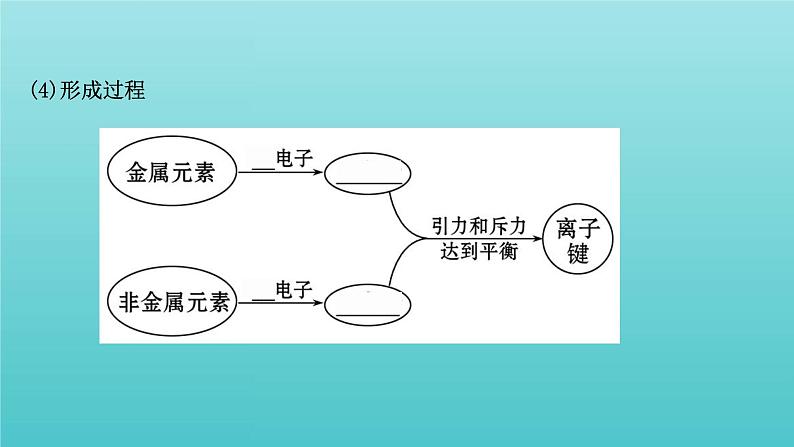
展开一、离子键1.离子键的形成(1)概念阴、阳离子间通过_________而形成的化学键。(2)成键元素活泼金属与非金属原子之间(3)形成条件一般认为,当成键原子所属元素的电负性差值大于____时,原子间才有可能形成离子键,且成键原子的电负性差值_____,原子之间越容易形成离子键。
2.离子键的特征(1)实质:静电作用。 (2)特征:①无方向性:一种离子可以对_________的带异性电荷的离子产生_____作用。②无饱和性:每个离子周围最邻近的带异性电荷的离子数目的多少,取决于阴、阳离子的_________。
【想一想】(1)金属元素与非金属元素化合时一定形成离子键吗?提示:不一定。金属元素与非金属元素也有可能形成共价键,如Al、Cl两种元素以共价键形成AlCl3。(2)离子键是通过阴、阳离子间的静电吸引形成的吗?提示:不是。离子键是阴、阳离子通过静电作用形成的,这种静电作用是指阴、阳离子之间静电吸引力与电子和电子之间、原子核和原子核之间的排斥力处于平衡时的总效应。
二、配位键1.配位键的形成(1)配位键①概念:成键原子一方提供_________,另一方具有_____________________而形成的特殊的共价键。②表示方法:配位键常用符号_____表示,其中A是___________________,B是___________________________________。
具有能够接受孤电子对的空轨道的原子
③实例:N 的结构式(表示出配位键)可表示为 ,N原子杂化类型为___,N 中的配位键和其他三个N—H的键长和键能_____,N 的空间构型为___________。
(2)配位化合物①概念:组成中含有配位键的物质。②组成:
【情境·思考】向AgNO3溶液中滴入氨水,现象:生成白色沉淀,随氨水的增加,沉淀逐渐溶解,生成了[Ag(NH3)2]+。(1)整个过程中发生了哪些反应?提示:Ag++NH3·H2O ==== AgOH↓+N ,AgOH+2NH3====[Ag(NH3)2]++OH-
(2)利用化学平衡移动原理解释配离子是如何形成的?提示:AgOH水溶液中存在AgOH(s) Ag+(aq)+OH-(aq)平衡,继续滴入氨水时,NH3分子与Ag+形成[Ag(NH3)2]+配离子,且配离子很稳定,促使以上平衡右移,AgOH逐渐溶解。(3)[Ag(NH3)2]+中哪一个提供孤电子对,哪一个提供空轨道?提示:在二氨合银离子中氨分子提供孤电子对,银离子提供空轨道。
2.配合物的制备与应用(1)配合物的制备实验目的:制备简单的络合物,体验配合物的应用。实验用品:(见教材)
[Cu(H2O)4]2+
[Fe(H2O)6]3+
【想一想】指出下列配离子的中心离子和配体。
三、金属键1.金属键及实质
2.金属键与金属性质(1)金属光泽当可见光照射到金属表面上时,固态金属中的“_________”能够吸收所有频率的光并迅速释放,使得金属不透明并具有金属光泽。(2)导电性金属内部自由电子的运动不具有方向性,在外加电场的作用下,金属晶体中的“自由电子”发生_____移动而形成电流。
(3)导热性当金属中有温度差时,通过不停运动着的“自由电子”与______________________,把能量由高温处传向低温处。(4)金属具有良好的延展性当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但排列方式不变,金属晶体中的_______没有被破坏。
【巧判断】(1)金属键具有方向性和饱和性。( )提示:×。金属键不具有方向性和饱和性。(2)金属键是金属阳离子与自由电子间的相互作用。( )提示:√。金属阳离子和自由电子之间的相互作用就是金属键。(3)金属导电是因为在外加电场作用下产生自由电子。( )提示:×。金属导电是因为自由电子的定向移动。(4)金属具有光泽是因为金属阳离子吸收并放出可见光。( )提示:×。金属光泽是因为自由电子吸收光并迅速释放,而非金属阳离子。
知识点一 常见的化学键【重点释疑】1.常见化学键的比较
2.化学键类型与物质类别的关系(1)离子化合物中一定含有离子键,可能含有共价键。简单离子组成的离子化合物中只有离子键,如MgO、NaF等,复杂离子组成的化合物中既有离子键、又有共价键,如NH4NO3、NaOH、Na2O2、NH4Cl等。(2)共价化合物中只有共价键,一定没有离子键。
(3)中学常见物质中的化学键①只有非极性键的物质:H2、O2、N2、P4、S2、S8、金刚石、晶体硅等。②只有极性键的物质:HX、CO、SO2等。③既有极性键、又有非极性键的物质:H2O2、C2H2、C2H4、C6H6、C2H5OH等。④只有离子键的物质:如CaCl2、K2O、KH等(固体)。⑤既有离子键、又有非极性键的物质:Na2O2、Na2S2、CaC2等。⑥既有离子键、共价键,又有配位键的物质:铵盐、配合物如[Cu(NH3)4]SO4等。⑦稀有气体中不存在化学键。⑧金属或合金中存在金属键。
【易错提醒】(1)化学键是相邻原子间的较强的相互作用,既存在相互吸引,又存在相互排斥。(2)稀有气体是单原子分子,其原子已经达到稳定结构,分子内不存在化学键。(3)活泼金属与活泼非金属间能够形成离子键,有些金属和非金属元素间能够形成共价键,如AlCl3。(4)电负性差值大于1.7时,不一定都形成离子键,如H—F中化学键为共价键,但电负性差值为1.9。(5)配合物是含配位键的化合物,不一定含过渡元素,如NH4Cl。
【思考·讨论】(1)所有的化学键都有方向性和饱和性吗?提示:不是。共价键有方向性和饱和性,但是离子键和金属键没有方向性与饱和性。(2)有人说:“金属键就是共价键。”这种说法对吗?提示:不对。从某种意义上来说金属键属于一种特殊的共价键,共价键的共用电子对属于提供电子对的两个原子,但是金属键中的自由电子却属于整个金属。
【案例示范】【典例】(2020·滨州高二检测)下列叙述正确的是( )A.带相反电荷离子之间的相互吸引称为离子键B.金属元素和非金属元素化合时不一定形成离子键C.原子最外层只有1个电子的主族元素与卤素所形成的化学键一定是离子键D.非金属元素形成的化合物中不可能含有离子键【解题指南】解答本题注意以下两点:(1)离子键的含义。(2)离子键形成的本质。
【解析】选B。离子键的本质是阴、阳离子之间的静电作用,静电作用包括静电引力和静电斥力,A不正确;活泼金属与活泼非金属容易形成离子键,一般当成键原子所属元素的电负性差值小于1.7时,原子间不易形成离子键,如AlCl3和BeCl2中金属与非金属原子形成共价键,B正确;原子最外层只有1个电子的主族元素包括H元素和碱金属元素,H元素与卤素形成共价键,碱金属元素与卤素形成离子键,C不正确;由非金属元素形成的化合物中可能含有离子键,如铵盐中N 与阴离子形成离子键,D不正确。
【规律方法】离子键与共价键中的两种特殊情况(1)金属与非金属形成的化学键有可能是共价键。(2)完全由非金属元素形成的化合物中有可能含离子键。
【迁移·应用】1.(2020·新乡高二检测)下列叙述错误的是( )A.离子键没有方向性和饱和性,而共价键有方向性和饱和性B.金属键的实质是在整块固态金属中不停运动的“自由电子”与金属阳离子相互作用,使得体系的能量大大降低C.配位键在形成时,由成键双方各提供一个电子形成共用电子对D.根据元素电负性的差值可以判断化学键类型
【解析】选C。A项为离子键和共价键的特征,正确;B项,金属键为自由电子与金属阳离子所形成的相互作用。C项,配位键在形成时,由成键原子的一方提供孤电子对,另一方提供空轨道,错误;根据形成化学键的元素的电负性差值与1.7的关系可以判断化学键类型,D正确。
2.下列物质中,既含有离子键,又含有非极性共价键的是( )A.Na2O2 B.NaOH C.Na2O D.MgCl2【解析】选A。Na2O2中含有Na+与 的离子键, 中含有O—O非极性键,A项正确;NaOH中含有Na+与OH-的离子键,OH-中含有H—O极性键,B项错误;Na2O中只含有Na+与O2-的离子键,C项错误;MgCl2中只含有Mg2+与Cl-的离子键,D项错误。
3.(2020·三明高二检测)NaF、KI、MgO均为离子化合物,现有下列数据,据此判断这三种化合物熔点高低的顺序( )A.①>②>③B.③>①>②C.③>②>①D.②>①>③
【解析】选B。离子化合物中,离子所带电荷数越多、半径越小,离子键越强,其熔、沸点就越高。因为r(F-)
据此回答下列问题:(1)合金是什么?合金中存在金属键吗?提示:合金就是由两种或两种以上的金属或者金属与非金属组成的具有金属特性的物质。合金中含有金属阳离子和自由电子,所以,含有金属键。(2)记忆合金是否具有一定的导热性?为什么?提示:具有。因为记忆合金中也存在金属键,也存在金属阳离子和自由电子,所以二者相互碰撞可以传递热量。
(3)根据上图可知,记忆金属在医学上有何应用?提示:TiNi合金的生物相容性很好,利用其形状记忆效应和超弹性的医学实例相当多。如血栓过滤器、脊柱矫形棒、牙齿矫形丝、脑动脉瘤夹、接骨板、髓内针、人工关节、避孕器、心脏修补元件、人造肾脏用微型泵等。(此答案合理即可)
知识点二 配合物【重点释疑】1.配合物的组成配合物由中心原子(提供空轨道)和配位体(提供孤电子对)组成,分为内界和外界,以[Cu(NH3)4]SO4为例表示为
(1)配位体配位体可以是阴离子,如X-(卤素离子)、OH-、SCN-、CN-、RCOO-(羧酸根离子)、P 等;也可以是中性分子,如H2O、NH3、CO、醇、胺、醚等。配位体中直接同中心原子(或离子)配合的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O中的O原子,配位原子常是ⅤA族、ⅥA族、ⅦA族的元素。
(2)配位数直接同中心离子(或原子)配位的原子数目叫中心离子(或原子)的配位数。要注意只含有一个配位原子的配位体称为单基配位体,中心离子(或原子)同单基配位体结合的数目就是该中心离子的配位数,如[Fe(CN)6]4-中Fe2+的配位数为6。含有两个以上配位原子的配位体叫多基配位体,中心离子(或原子)同多基配位体配合时,配位数等于同中心离子(或原子)配位的原子数。例如,乙二胺分子中含有两个配位N原子,故在[Pt(en)2]Cl2(en代表乙二胺分子)中Pt2+的配位数为2×2=4,而配位体只有两个,依次类推。
2.配合物的形成对性质的影响(1)溶解性的影响一些难溶于水的金属氯化物、溴化物、碘化物、氰化物,可以依次溶解于含过量的Cl-、Br-、I-、CN-和氨的溶液中,形成可溶性的配合物。(2)颜色的改变当简单离子形成配离子时其性质往往有很大差异。颜色发生变化就是一种常见的现象,我们根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-在溶液中可生成配位数为1~6的铁的硫氰酸根配离子,这种配离子的颜色是血红色的,反应的离子方程式如下:Fe3++nSCN- ====[Fe(SCN)n]3-n
(3)稳定性增强配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
【易错提醒】配位键与一般共价键的区别:配位键成键电子由单方提供,而一般共价键成键电子由双方提供。
【思考·讨论】(1)配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些?提示:[Cu(NH3)4]SO4中含有的化学键有离子键{[Cu(NH3)4]2+与S 之间形成的}、一般共价键、配位键。(2)如何表示[Cu(H2O)4]2+中的配位键?提示:
【案例示范】【典例】(2020·南昌高二检测)配位键是一种特殊的共价键,即由单方面提供孤电子对的某原子和另一种接受孤电子对的空轨道的粒子结合。如N 就是由NH3(氮原子提供孤电子对)和H+(提供空轨道)通过配位键形成的。据此,回答下列问题:(1)下列粒子中可能存在配位键的是________。 A.CO2 B.H3O+ C.CH4 D.H2SO4
(2)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了两种观点:甲: 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓硫酸反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2作还原剂)。如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)_______________________________________________________________________________。
【解题指南】解答本题需注意以下两点:(1)配位键的形成条件是成键原子一方提供孤电子对,另外一方提供空轨道;(2)O→O键遇到还原剂时易断裂。【解析】解题时要注意配位键形成条件中的一方提供孤电子对,另一方提供空轨道。(1)由题中信息可得出结论:凡能给出H+的物质中一般含有配位键。(2)由题中所含配位键的物质的反应特点分析。
答案:(1)B、D(2) +H2 C2H5OC2H5+H2O
【母题追问】(1)过氧化氢(H—O—O—H)分子中存在什么键?分子是极性的还是非极性的?提示:过氧化氢分子中存在极性共价键和非极性共价键,是极性分子。(2)为了进一步确定c反应是否发生,还需要在实验c后添加一步实验d,请设计d的实验方案。提示:用无水硫酸铜检验c的反应产物中有没有水。若无水硫酸铜变蓝色,则有水生成,否则没有水生成。
【迁移·应用】1.(双选)(2020·惠州高二检测) 某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )A.配合物中中心原子的电荷数和配位数均为6B.该配合物可能是八面体形结构C.Cl-和NH3分子均与Pt4+配位D.配合物中Cl-与Pt4+配位,而NH3分子不配位
【解析】选B、C。在PtCl4·2NH3水溶液中加入AgNO3溶液无沉淀生成,以强碱处理无NH3放出,说明Cl-、NH3均处于内界,故该配合物中中心原子的配位数为6,电荷数为4,Cl-和NH3分子均与Pt4+配位,A、D错误,C正确;因为配体在中心原子周围配位时采取对称分布状态以达到能量上的稳定状态,Pt4+配位数为6,则其空间构型为八面体形,B正确。
2.向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )A.[C(NH3)4Cl2]Cl B.[C(NH3)3Cl3]C.[C(NH3)6]Cl3D.[C(NH3)5Cl]Cl2【解析】选B。配合物的内界与外界由离子键结合,只要外界存在Cl-,加入AgNO3溶液即有AgCl沉淀产生。对于B项配合物分子[C(NH3)3Cl3],C3+、NH3、Cl-全处于内界,不能电离出Cl-,所以不能生成AgCl沉淀。
【补偿训练】(2020·济宁高二检测)下列物质不属于配位化合物的是( )A.CuSO4·5H2O B.[Fe(SCN)2]Cl2C.NH4Cl D.[Ag(NH3)2]OH【解析】选C。配位化合物是过渡元素的原子提供空轨道,其他粒子提供孤电子对形成的化合物,但C选项中虽有配位键但无过渡元素的原子,因此不属于配位化合物。A、B、D中均有,所以选C。
【素养提升】水是生命之源,与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。水分子在配位化学中也有着非常重要的地位。
(1)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的有哪些?①氧原子的杂化类型发生了改变②微粒的形状发生了改变③微粒的化学性质发生了改变④微粒中的键角发生了改变
提示:①。水中氧原子以sp3杂化形成4个轨道,其中2个轨道是由孤电子对占据的,依据价层电子对互斥理论,孤电子对也参与互相排斥,水的空间构型为角形。在一定条件下水与氢离子结合形成配位键,这样氧原子与3个氢原子间的共用电子对和剩下的一对孤电子对相互排斥形成了三角锥形分子;同时其键角也发生改变,形成的微粒兼有水和氢离子的性质。故只有①不正确。(2)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配离子。请写出生成此配离子的离子方程式。提示:Cu2++4H2O====[Cu(H2O)4]2+
1.(2020·东莞高二检测) 下列关于离子键特征的叙述中,正确的是( )A.一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性B.因为离子键无方向性,故阴、阳离子的排列是没有规律的,随意的C.因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl-D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子
【解析】选A。离子键的特征是无方向性和饱和性。因为离子键无方向性,故带异性电荷的离子间的相互作用与其所处的方向无关,但为了使物质的能量最低,体系最稳定,阴、阳离子的排列是有规律的,而不是随意的;离子键无饱和性,体现在每个离子周围可以尽可能多地吸引带异性电荷的离子,但也不是任意的,每个离子周围吸引带异性电荷的离子的多少主要取决于阳离子与阴离子的半径比,如NaCl晶体中,每个离子周围吸引六个带异性电荷的离子,而在CsCl晶体中,每个离子周围吸引八个带异性电荷的离子,其原因于 。
2.关于配合物[Zn(NH3)4] Cl2的说法正确的是( )A.配位数为6B.配体为NH3和Cl-C.[Zn(NH3)4]2+为内界D.Zn2+和NH3以离子键结合
【解析】选C。Zn2+的配位原子个数是4,所以其配位数是4,故A错误;该配合物中氮原子提供孤电子对,所以NH3是配体,故B错误;[Zn(NH3)4]Cl2中外界是Cl-,内界是[Zn(NH3)4]2+,故C正确;该配合物中,锌离子提供空轨道,氮原子提供孤电子对,所以Zn2+和NH3以配位键结合,属于特殊共价键,不属于离子键,故D错误。
3.下列各种说法中错误的是( )A.配位键是一种特殊的共价键B.NH4NO3、H2SO4都含有配位键C.共价键的形成条件是成键原子必须有未成对电子D.形成配位键的条件是一方有空轨道,一方有孤电子对【解析】选C。NH4NO3、H2SO4中的N 、S 含有配位键,B正确;配位键是一种特殊的共价键,成键的两个原子一方提供孤电子对,另一方提供空轨道,A、D正确,C错误。
4.(2020·三门峡高二检测) 下列有关叙述正确的是( )A.任何固体中,若含有阳离子也一定含有阴离子B.金属键越强,则该金属的熔点越低C.将铁制品做成炊具,金属键没有被破坏D.常温下,金属单质都以固体金属形式存在【解析】选C。固体金属中有金属阳离子、自由电子,但无阴离子;金属键越强,金属的熔点越高;常温下,金属汞是液体。
5.具有下列电子排布的原子中最难形成离子键的是( )A.1s22s22p2 D.1s22s22p63s1【解析】选A。对应元素A—C、B—F、C—Mg、D—Na,碳和氟都是非金属元素,碳最难形成离子键。
6.(2020·济南高二检测) 回答下列问题:(1)下列金属的金属键最强的是________(填字母序号)。 a.Na b.Mg c.K d.Ca(2)下列分子或离子中不存在配位键的是________。 ①H3O+ ②[Al(OH)4]- ③NH3 ④N ⑤[Cu(H2O)4]2+ ⑥Ni(CO)4 ⑦Fe(SCN)3 ⑧B ⑨CH4
(3)在配离子[Fe(CN)6]3-中,中心离子的配位数为________,提供空轨道的是________,与其配位体互为等电子体的一种微粒是________。 (4)钛是20世纪50年代发展起来的一种重要的结构金属,与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有______________(填元素符号),现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5]2+中的化学键类型是________,该配合物的配位体是________。
(5)B和Al均为ⅢA族元素。①AlCl3·NH3和Al 中均含有配位键。在AlCl3·NH3中,配位体是________,提供孤电子对的原子是________,AlC 中Al原子采用________杂化。 ②NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 ml NH4BF4含有________ ml配位键。
【解析】(1)金属阳离子半径越小,金属价电子数越多金属键越强,四种金属中阳离子电荷数最多而半径最小的是Mg2+,故金属镁的金属键最强。(2)配位键的形成条件是一方能够提供孤电子对,另一方具有能够接受孤电子对的空轨道。H3O+中H+与H2O形成配位键,H+提供空轨道,H2O中的O原子提供孤电子对。[Al(OH)4]-中Al(OH)3与OH-形成配位键,Al提供空轨道,OH-提供孤电子对;N 中NH3与H+形成配位键;[Cu(H2O)4]2+ 中Cu2+与H2O形成配位键;Ni(CO)4中Ni与CO形成配位键;Fe(SCN)3中Fe3+与SCN-形成配位键;B 中BF3与F-形成配位键。CH4、NH3分子中不存在提供空轨道的原子,不存在配位键,故选③⑨。
(3)[Fe(CN)6]3-中的配位数为6,Fe3+提供空轨道。配位体为CN-,其等电子体有N2、CO、 等。(4)Ti的价电子排布式为3d24s2,未成对电子数为2,同周期基态原子未成对电子数为2的价电子排布式为3d84s2、4s24p2、4s24p4,即为Ni、Ge、Se。[TiCl(H2O)5]2+中的化学键有极性键(或共价键)、配位键,配位体为H2O、Cl-。
(5)①AlCl3·NH3中,Al3+提供空轨道,配位体为NH3,NH3中的N原子提供孤电子对。Al 中Al的价电子对数为 ×(3+1+4)=4,孤电子对数为0,Al原子杂化类型为sp3杂化。②N 含有1个配位键,B 含有1个配位键,故1 ml NH4BF4含有2 ml配位键。
高中化学鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键评课ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键评课ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键图片课件ppt: 这是一份鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键图片课件ppt,共44页。PPT课件主要包含了内容索引,自主梳理,自我检测,答案A,问题探究,归纳拓展,应用体验,答案B等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键集体备课ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键集体备课ppt课件,共41页。PPT课件主要包含了内容索引,自主梳理,自我检测,问题探究,归纳拓展,4成键条件,应用体验等内容,欢迎下载使用。













