




- 第10讲 物质的检验-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册) 学案 0 次下载
- 第11讲 物质的性质和变化探究-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册) 试卷 学案 0 次下载
- 第13讲 溶液的配制与分析-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册) 试卷 学案 0 次下载
- 第14讲 化学反应的计算-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册) 试卷 学案 0 次下载
- 第15讲 原子核的构成-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册) 试卷 学案 0 次下载
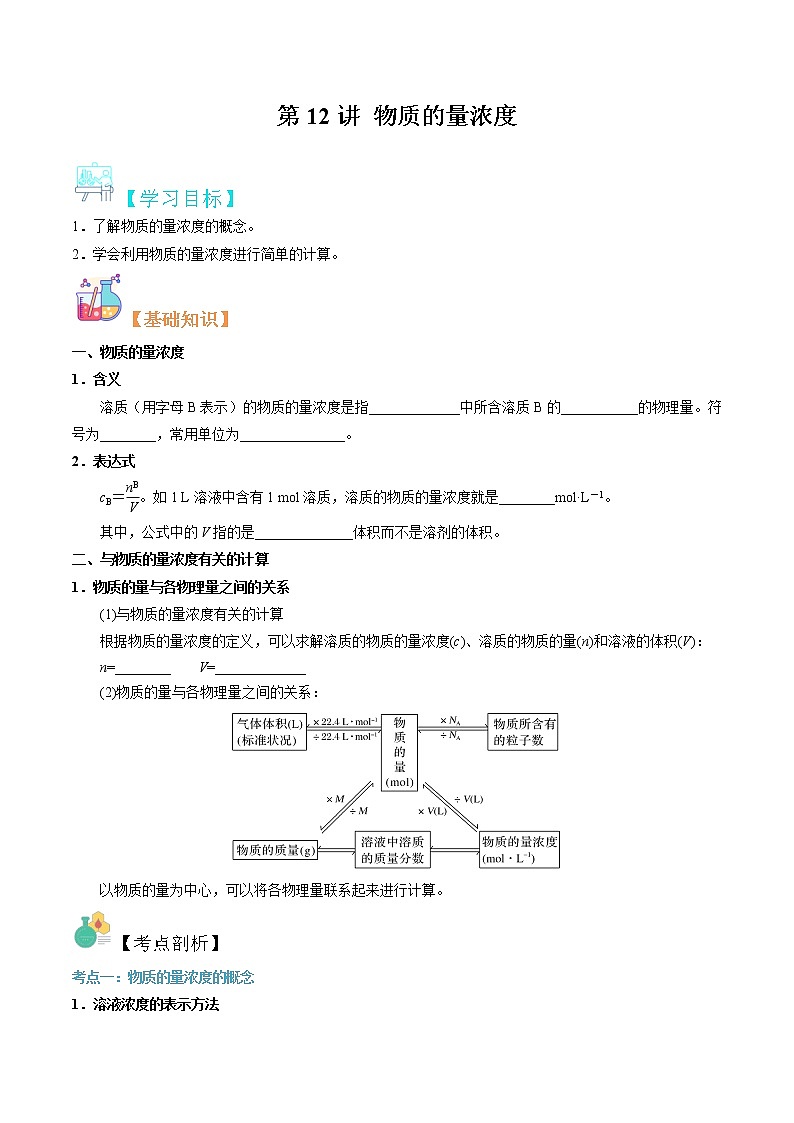
第12讲 物质的量浓度-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册)
展开第12讲 物质的量浓度
【学习目标】
1.了解物质的量浓度的概念。
2.学会利用物质的量浓度进行简单的计算。
【基础知识】
一、物质的量浓度
1.含义
溶质(用字母B表示)的物质的量浓度是指_____________中所含溶质B的___________的物理量。符号为________,常用单位为_______________。
2.表达式
cB=。如1 L溶液中含有1 mol溶质,溶质的物质的量浓度就是________mol·L-1。
其中,公式中的V指的是______________体积而不是溶剂的体积。
二、与物质的量浓度有关的计算
1.物质的量与各物理量之间的关系
(1)与物质的量浓度有关的计算
根据物质的量浓度的定义,可以求解溶质的物质的量浓度(c)、溶质的物质的量(n)和溶液的体积(V):
n=________ V=_____________
(2)物质的量与各物理量之间的关系:
以物质的量为中心,可以将各物理量联系起来进行计算。
【考点剖析】
考点一:物质的量浓度的概念
1.溶液浓度的表示方法
(1)溶质的质量分数
质量分数是指溶质的质量占溶液质量的百分数,可用以下公式表示:
溶质的质量分数=×100%
配制一定质量分数的溶液的方法(以配制100g 15%NaCl溶液为例):
用天平称取25gNaCl固体,用天平称取75g水,将NaCl溶解在水中,用玻璃棒搅拌。
(2)对溶质的物质的量浓度的概念的理解
①一定物质的量浓度的某溶液,其浓度不因所取体积不同而变化。
②表达式中的体积(V)是指溶液的体积,不是溶剂的体积,也不是溶质与溶剂的体积之和。
③计算时要找准溶质。比如Na2O溶于水,溶质是NaOH而不是Na2O。
④若将气体通入溶液中,则不能将气体体积与溶剂体积进行简单加和。例如:将1 L HCl气体(标准状况)通入1 L 1 mol·L-1盐酸中,盐酸的体积将发生变化,既不等于1 L,也不等于2 L,准确的体积需要通过计算求得。
⑤溶液与溶液相混合,除特殊说明溶液体积可相加外,其他情况仍用公式V溶液=计算。
【例1】(1)62 g Na2O溶于水配成1 L溶液,溶质的物质的量浓度为__________。
(2)250 g胆矾溶于水得到1 L溶液,所得CuSO4溶液中溶质的物质的量浓度为________。
(3)0.3 mol·L-1 Na2SO4溶液中的Na+浓度与0.3 mol·L-1 NaCl溶液中的Na+浓度________(填“相等”或“不相等”)。
(4)100 mL 0.2 mol·L-1的H2SO4溶液中含H2SO4________ mol,含H+________个。
考点二:有关物质的量浓度的计算
1.根据定义式计算溶质的物质的量浓度
根据概念表达式cB=,欲求cB,先求nB和V。
计算溶质的物质的量浓度的关键是从已知条件中找出溶质的物质的量(n)和溶液的体积(V),据此求出溶质的物质的量浓度cB。
【例2】游泳池里的水一般常加适量的硫酸铜,用以杀灭其中的细菌,而对游泳者的身体无害。现取一水样300 mL,经分析其中含有0.019 2 g Cu2+,则水样中硫酸铜的物质的量浓度为_____mol·L-1。
2.气体体积(标准状况下)与溶质的物质的量浓度的关系
若已知溶液的体积
【例3】用1 L水吸收560 L氨气(标准状况),所得氨水的密度是0.90 g·mL-1,求:
(1)氨气的物质的量是______________。
(2)所得氨水的物质的量浓度是______________。
3.溶液中离子浓度的计算
(1)单一溶液中溶质组成计算
根据组成规律求算:在溶液中,阴离子与阳离子浓度之比等于化学组成中阴、阳离子个数之比。
如K2SO4溶液中:c(K+)=2c(SO)=2c(K2SO4)。
(2)混合溶液中电荷守恒计算
根据电荷守恒,溶质所有阳离子带正电荷总数与阴离子带负电荷总数相等。
如在Na2SO4、NaCl混合溶液中,c(Na+)=2c(SO)+c(Cl-),c(Na+)、c(Cl-)分别为7 mol/L、3 mol/L,则c(SO)= mol/L=2 mol/L。
【例4】在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10 mol·L-1,c(Mg2+)=0.25 mol·L-1,c(Cl-)=0.20 mol·L-1,则c(SO)为( )
A.0.15 mol·L-1 B.0.10 mol·L-1 C.0.25 mol·L-1 D.0.20 mol·L-1
考点三:溶液的稀释或混合问题
1.溶液的稀释或混合的计算依据
(1)将浓溶液加水稀释,稀释前后溶质的物质的量和质量都保持不变。
c(浓)·V(浓)=c(稀)·V(稀)
m(浓)·w(浓)=m(稀)·w(稀)
(2)同一溶质不同浓度的两溶液相混合,混合后,溶质的总物质的量(或总质量)等于混合前两溶液中溶质的物质的量之和(或质量之和)。
c1·V1+c2·V2=c(混)·V(混)
m1·w1+m2·w2=m(混)·w(混)
2.混合后溶液的体积
①若题目中指出不考虑溶液体积的改变,可认为是原两溶液的体积之和;
②若题目中给出混合后溶液的密度,应根据V(混)==来计算。
【例5】(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为________mol·L-1。
(2)若从中取出50 mL,其物质的量浓度为________mol·L-1;溶质的质量为________g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为________mol·L-1,SO的物质的量浓度为________mol·L-1。
【过关检测】
1.在物质的量浓度公式c=中,n是指( )
A.溶液的物质的量 B.溶质的物质的量
C.溶剂的物质的量 D.物质的量
2.标准状况下,将11.2 L的氯化氢气体溶于水配成1 L溶液,所得溶液的浓度是( )
A.2 mol·L-1 B.1.5 mol·L-1
C.1 mol·L-1 D.0.5 mol·L-1
3.下列溶液中溶质的物质的量浓度是1 mol·L-1的是( )
A.将40 g NaOH溶解于1 L水中
B.将11.2 L HCl气体通入水配成0.5 L的溶液
C.将1 L 10 mol·L-1的盐酸与9 L水混合
D.0.5 mol Na2O加入适量水中,配成1 L溶液
4.将14.2 g硫酸钠溶于水中,配制成500 mL溶液,下列说法正确的是( )
A.硫酸钠溶液中溶质的物质的量浓度为1 mol·L-1
B.硫酸根离子的物质的量浓度为2 mol·L-1
C.钠离子的物质的量浓度为0.4 mol·L-1
D.硫酸钠溶液中溶质的物质的量浓度为2 mol·L-1
5.设NA为阿伏加德罗常数,下列关于0.2 mol·L-1的Ba(NO3)2溶液不正确的说法是( )
A.2 L溶液中有阴、阳离子总数为0.8NA
B.500mL溶液中NO3-离子浓度为0.4 mol·L-1
C.500mL溶液中Ba2+离子浓度为0.2 mol·L-1
D.500mL溶液中NO3-离子总数为0.2NA
6.下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是( )
A.150 mL 1 mol·L-1的NaCl溶液 B.75 mL 2 mol·L-1 NH4Cl溶液
C.25 mL 2 mol·L-1的KCl溶液 D.75 mL 1 mol·L-1的FeCl3溶液
7.现有一瓶500mL的矿泉水,其水质成分表中标示其“Ca2+”含量为4 mg·L-1,则其物质的量浓度为( )
A.1×10-4mol·L-1 B.2×10-4mol·L-1 C.0.5×10-4mol·L-1 D.1×10-3mol·L-1
8.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.NA个氧气分子与NA个氖气分子的质量比是4∶5
B.17gOH-与19gH3O+所含电子数相等
C.14g14C和12g12C所含的中子数相等
D.11.2LCO2与常温常压下8.5gNH3所含分子数相等
9.(1)物质的量浓度为2 mol·L-1的H2SO4溶液250 mL,含H2SO4的物质的量为________。
(2)已知75 mL 2 mol·L-1的NaOH溶液的质量为80 g,则该溶液中溶质的质量分数为________。
10.(1)62 g Na2O溶于水配成1 L溶液,溶质的物质的量浓度为__________。
(2)250 g胆矾溶于水得到1 L溶液,所得CuSO4溶液中溶质的物质的量浓度为________。
(3)0.3 mol·L-1 Na2SO4溶液中的Na+浓度与0.3 mol·L-1 NaCl溶液中的Na+浓度________(填“相等”或“不相等”)。
(4)100 mL 0.2 mol·L-1的H2SO4溶液中含H2SO4________ mol,含H+________个。
11.将24.4gNaOH固体溶于水配成100mL溶液,其密度为1.219g•mL-1。
(1)该溶液中NaOH的物质的量浓度为 ,该溶液中NaOH的质量分数 。
(2)从上述溶液中取出10mL,其中NaOH的物质的量浓度为 ,NaOH的质量分数为 ,溶液的密度为 ,含NaOH的质量为 ,含NaOH的物质的量为 。
(3)将取出的10mL溶液加水稀释到100mL,所得溶液中NaOH的物质的浓度为 。
第14讲 化学反应的计算-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册): 这是一份第14讲 化学反应的计算-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册),文件包含第14讲化学反应的计算-暑假自学课2022年新高一化学暑假精品课苏教版2019必修第一册解析版docx、第14讲化学反应的计算-暑假自学课2022年新高一化学暑假精品课苏教版2019必修第一册原卷版docx等2份学案配套教学资源,其中学案共14页, 欢迎下载使用。
第04讲 物质的量-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册): 这是一份第04讲 物质的量-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册),文件包含第04讲物质的量-暑假自学课2022年新高一化学暑假精品课苏教版2019必修第一册解析版docx、第04讲物质的量-暑假自学课2022年新高一化学暑假精品课苏教版2019必修第一册原卷版docx等2份学案配套教学资源,其中学案共12页, 欢迎下载使用。
第03讲 化学反应的分类-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册): 这是一份第03讲 化学反应的分类-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册),文件包含第03讲化学反应的分类-暑假自学课2022年新高一化学暑假精品课苏教版2019必修第一册解析版docx、第03讲化学反应的分类-暑假自学课2022年新高一化学暑假精品课苏教版2019必修第一册原卷版docx等2份学案配套教学资源,其中学案共12页, 欢迎下载使用。












