
2021省大庆铁人中学高三冲刺模拟考化学试题(二)含答案
展开大庆铁人中学高三冲刺模拟试题(二)
化学测试
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24 S 32 Fe 56 Cu 64
一、选择题:本题共13个小题,每小题6分。共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.(原创)新材料的发展充分体现了“中国技术”“中国制造”和“中国力量”。下列说法正确的是( )
A.国产大飞机C919使用的“现代工业骨骼”碳纤维是一种新型有机高分子材料
B.“华为麒麟980”手机中芯片的主要二氧化硅
C.制作N95型口罩的“熔喷布”,其主要组成为聚丙烯,聚丙烯是有机高分子化合物
D.2021年3月31日起中国天眼FAST全球开放,中国天眼FAST用到的高性能碳化硅是一种新型的有机高分子材料
8.(改编)嫦娥五号于2020年11月24日成功发射,其助燃剂为四氧化二氮。此次嫦娥五号飞行搭乘了水稻种子进行太空育种,并取回了1.8公斤月球土壤。安徽华茂集团与武汉纺织大学等单位,经历了无数次试验和攻关,最终选用两种国产高性能纤维材料,成功研制出符合登月要求的第一面“织物版”五星红旗。下列有关说法正确的是( )
A.五星红旗选用材料之一芳纶纤维可由对苯二甲酸和对苯二胺缩聚而成
B.太空育种的目的是利用紫外线照射使作物种子的蛋白质发生变性
C.嫦娥五号寻找并带回的土壤中含3He,3He与4He互为同素异形体
D.标准状况下92g助燃剂所含分子数为2NA
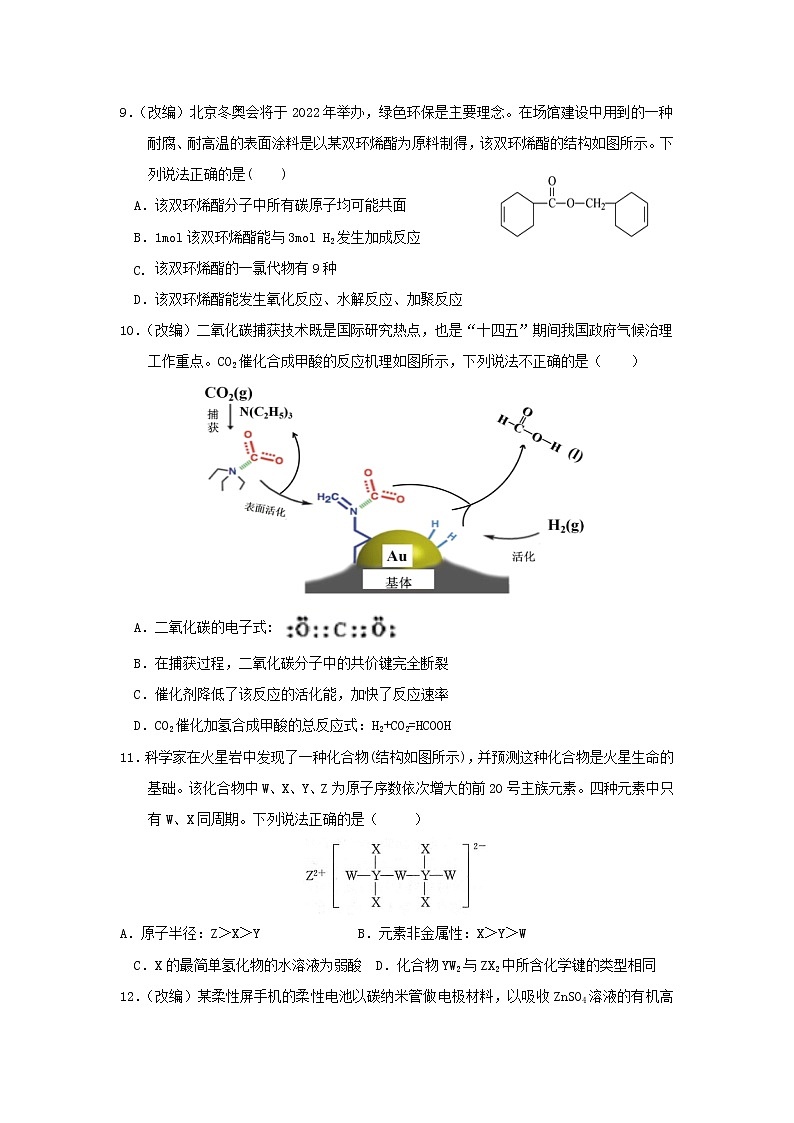
9.(改编)北京冬奥会将于2022年举办,绿色环保是主要理念。在场馆建设中用到的一种耐腐、耐高温的表面涂料是以某双环烯酯为原料制得,该双环烯酯的结构如图所示。下列说法正确的是( )
A.该双环烯酯分子中所有碳原子均可能共面
B.1mol该双环烯酯能与3mol H2发生加成反应
- 该双环烯酯的一氯代物有9种
D.该双环烯酯能发生氧化反应、水解反应、加聚反应
10.(改编)二氧化碳捕获技术既是国际研究热点,也是“十四五”期间我国政府气候治理工作重点。CO2催化合成甲酸的反应机理如图所示,下列说法不正确的是( )
A.二氧化碳的电子式:
B.在捕获过程,二氧化碳分子中的共价键完全断裂
C.催化剂降低了该反应的活化能,加快了反应速率
D.CO2催化加氢合成甲酸的总反应式:H2+CO2=HCOOH
11.科学家在火星岩中发现了一种化合物(结构如图所示),并预测这种化合物是火星生命的基础。该化合物中W、X、Y、Z为原子序数依次增大的前20号主族元素。四种元素中只有W、X同周期。下列说法正确的是( )
A.原子半径:Z>X>Y B.元素非金属性:X>Y>W
C.X的最简单氢化物的水溶液为弱酸 D.化合物YW2与ZX2中所含化学键的类型相同
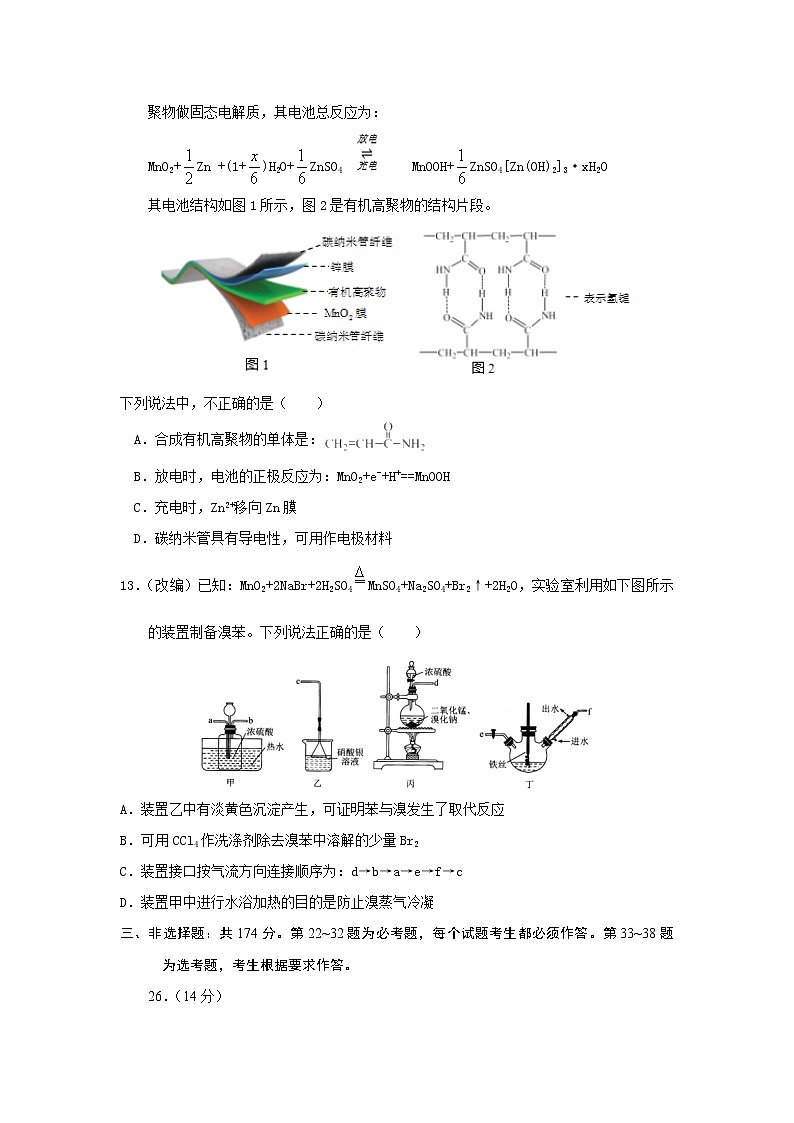
12.(改编)某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:
MnO2+Zn +(1+)H2O+ZnSO4 MnOOH+ZnSO4[Zn(OH)2]3·xH2O
其电池结构如图1所示,图2是有机高聚物的结构片段。
下列说法中,不正确的是( )
A.合成有机高聚物的单体是:
B.放电时,电池的正极反应为:MnO2+e−+H+==MnOOH
C.充电时,Zn2+移向Zn膜
D.碳纳米管具有导电性,可用作电极材料
13.(改编)已知:MnO2+2NaBr+2H2SO4MnSO4+Na2SO4+Br2↑+2H2O,实验室利用如下图所示的装置制备溴苯。下列说法正确的是( )
A.装置乙中有淡黄色沉淀产生,可证明苯与溴发生了取代反应
B.可用CCl4作洗涤剂除去溴苯中溶解的少量Br2
C.装置接口按气流方向连接顺序为:d→b→a→e→f→c
D.装置甲中进行水浴加热的目的是防止溴蒸气冷凝
三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
26.(14分)
以金属切削废料(由铁屑和镍钴合金、金刚砂组成)为原料回收镍钴生产NiSO4·7H2O和CoCl2·6H2O的工艺如图:
已知:①相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Co3+ | Co2+ | Fe3+ | Fe2+ | Ni2+ |
开始沉淀的pH | 0.3 | 7.2 | 1.5 | 6.3 | 6.9 |
沉淀完全的pH | 1.1 | 9.2 | 2.8 | 8.3 | 8.9 |
②常温下,Ksp(NiCO3)=1.0×10-7。
回答下列问题:
(1)将废料研磨成粉的作用是__________________。
(2)理论上“除铁”需控制pH的范围为____________,“滤渣2”中除Fe(OH)3外,还有少量黄钠铁矾[Na2Fe6(SO4)4(OH)12],写出Fe3+生成黄钠铁矾的离子方程式:______________________。
(3)写出“钴镍分离”时发生反应的离子方程式:_______________________________________。
“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液2”中c(CO)=10-5mol·L-1,则沉镍率=_____________________[沉镍率=]。
(4)“转化”时产生的气体为____________。
(5)碱性镍氢电池是国产比亚迪汽车车载电池之一,其电池反应为:
NiOOH+MHNi(OH)2+M。放电时,负极反应式为_____________________________。
27.(16分)
NaClO2是一种杀菌消毒剂,常用于饮用水净化。某兴趣小组电解ClO2制备NaClO2的过程如图所示:
已知:
①ClO2是一种强氧化性气体,浓度大时易分解爆炸。一般使用时用稀有气体或空气稀释,以增加安全性。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,高于38℃时析出晶体NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
回答下列问题。
(1)装置I中发生反应的化学方程式为__________________________________________,
该方法制备ClO2最突出的优点是____________________________________________。
(2)装置II是电解装置,a极为_______(填“正”“负”“阴”或“阳”)极,其所连电极的反应式为_______________________________,离子交换膜为_________(填“阴”或“阳”)膜。
(3)用NaOH和H2O2混合液吸收电解排出的少量ClO2尾气,该装置需控制反应温度为3℃,可采取的措施为___________________________,处理后将所得溶液与装置II的成品液合并,处理后可得产品,尾气处理过程的离子方程式为_____________________________。
(4)从装置II和尾气处理所得成品液中,获得产品NaClO2的操作为___________(填字母)。
a.减压,55℃蒸发结晶 b.冷却过滤 c.趁热过滤
d.用38~60℃温水洗涤 e.加热快速烘干 f.低于60℃干燥
(5)上述所得NaClO2产品可能含有NaCl等杂质。为测定其纯度,取上述产品5 g溶于水配成500 mL溶液,取出10.00 mL溶液于锥形瓶中,再加入足量酸化的KI溶波,充分反应后(杂质不参加反应),加入2~3滴淀粉溶液,然后用0.200 mol·L-1 Na2S2O3标准液滴定,当__________________时达到滴定终点,重复操作2~3次,平均消耗标准液20.00 mL,则产品NaClO2的纯度为___________。(已知2Na2S2O3+I2=Na2S4O6+2NaI)
28.(原创)(13分)
“低碳经济”是建设美丽中国的发展方向,减少机动车尾气中NOx和CO的排放及如何对废气中的CO综合利用是科学家一直关注研究的课题。
(1)许多含碳燃料在不完全燃烧时会产生大量CO。
已知:①
②
写出和不完全燃烧生成CO和的热化学方程式:_______。
(2)汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除CO、NO等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
I.NO+Pt(s)=NO* II.CO+Pt(s)=CO* III.NO*=N*+O*
IV.CO*+O*=CO2+Pt(s) V.N*+ N*=N2+Pt(s) VI.NO*+N*=N2O+Pt(s)
经测定汽车尾气中反应物浓度及生成物浓度随温度T变化关系如图1和图2所示。
①图1中温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是_______。
②图2中温度T2℃时反应V的活化能_______反应VI的活化能(填“<”、“>”或“=”);温度T3℃时发生的主要反应为_______(填“IV”、“V”或“VI”)。
③模拟汽车的“催化转化器”,将2 mol NO(g)和2mol CO(g)充入1L的密闭容器中,发生反应2NO(g)+2CO(g) N2(g)+2CO2(g),测得CO的平衡转化率α随温度T变化曲线如图所示。
图像中A点逆反应速率_______C点正反应速率(填“>”“=”或“<”);实验测得:
v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),k正、k逆分别是正、逆反应速率常数。则T1℃时A点处对应的v正:v逆=_______。
(3)工业上常用CO制备,进一步制得,常用于钙镁离子的测定。将某样品灼烧并用酸处理成溶液,使钙离子溶解在溶液中。向溶液中加入足量,使完全形成白色沉淀。将白色沉淀过滤洗涤后溶于一定量的稀硫酸中,再用高锰酸钾溶液滴定。已知:常温下,的,取酸溶后的溶液,向其中加入时,开始沉淀,则溶液中的浓度为_______。洗涤沉淀时经常先用稀溶液洗涤后,再用水洗原因是_______。
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一题计分。
35.[化学——选修3:物质结构与性质](15分)
中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。龙骨要耐冲击,甲板要耐高温,外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为_______,铬元素在周期表中______区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为_______杂化。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______填元素符号
②根据价层电子对互斥理论,预测ClO3-的空间构型为________________形,写出一个ClO3-的等电子体的化学符号______。
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?_____(填“是”或“否”);该立方体是不是Fe3O4的晶胞?______(填“是”或“否”);立方体中铁离子处于氧离子围成的_______(填空间结构)空隙;根据下图计算Fe3O4晶体的密度为________g/cm3。(图中a=0.42nm,计算结果保留两位有效数字)
36.[化学——选修5:有机化学基础](15分)
阿比朵尔能有效抑制新型冠状病毒,化合物G是合成阿比朵尔的中间体,其合成路线如下:
回答下列问题:
(1)A的化学名称为_______________,B的结构简式为______________________。
(2)由B到C、E到F的反应类型分别为___________________________。
(3)在合成化合物G的流程中,由A到B的目的是_____________________。
(4)苯硫酚的性质与苯酚相似,苯硫酚的官能团为_________________(写结构简式);用NaOH标准溶液可滴定苯硫酚溶液,该过程选用的指示剂为_________________,写出该反应的化学方程式:________________________。
(5)由D的结构可判断,D应存在立体异构,该立体异构体的结构简式为________________。
(6)H是A的同系物,其相对分子质量比A大14。H的同分异构体能同时满足如下条件的共有_____________________种(不考虑立体异构);
①苯环上有3个取代基,且遇溶液显色 ②既能发生银镜反应又能发生水解反应
写出其中一种核磁共振氢谱有五组峰,峰面积之比为1:1:1:2:2的结构简式_________________(写一种即可)。
高考模拟题(答案)
一、选择题(每小题6分,共42分)
7 | 8 | 9 | 10 | 11 | 12 | 13 |
C | A | D | B | C | B | D |
二、填空题
26.【14分,没空2分】
(1)增大固液接触面积,加快酸溶速率,提高原料利用率
(2)2.8~6.9或2.8≤pH<6.9 6Fe3++4SO+2Na++12OH-=Na2Fe6(SO4)4(OH)12↓
(3)ClO-+2Co2++4OH-+H2O=2Co(OH)3↓+Cl- 99%或0.99
(4)Cl2
(5)MH-e-+OH-=M+H2O
27.【16分,除标注外均为2分】
(1)2NaClO3+H2C2O4+H2SO42ClO2↑+2CO2↑+Na2SO4+2H2O
(或2NaClO3+2H2SO4+H2C2O4=2ClO2↑+2NaHSO4+2H2O+2CO2↑)
反应中生成的CO2对ClO2起到稀释作用,提高了实验的安全性
(2) 负(1分) ClO2+e-=ClO (1分) 阳 (1分)
(3)3 ℃冷水浴(1分) H2O2+2ClO2+2OH-=2ClO+O2+2H2O
(4)acdf
(5)当溶液由蓝色变无色,且半分钟内不恢复 90.5%
- 【13分,除标注外均为2分】
(1)
(2)①温度升高,催化剂活性增强,反应速率加快,所以反应物浓度快速减小
② > (1分) IV
③< (1分) 40.5
(3) 减少的溶解损失 (1分)
35.【 15分,除标注外均为2分】
(1)1s22s22p63s23p63d8 d(1分)
(2) sp3 (1分)
(3) Ⅰ(1分) 三角锥 SO32-
(4)是 (1分) 是 (1分) 正八面体 5.2
36.【15分,除标注外均为2分】
(1)对硝基苯酚(1分); (2)还原反应(1分);取代反应(1分)
(3)保护官能团酚羟基(1分)
(4)SH(1分);酚酞(1分);
(5) (1分) (6)16;(或)
2021省大庆铁人中学高三上学期期中考试化学试题含答案: 这是一份2021省大庆铁人中学高三上学期期中考试化学试题含答案
2021省大庆铁人中学高三上学期阶段考试化学试题含答案: 这是一份2021省大庆铁人中学高三上学期阶段考试化学试题含答案
2021省大庆铁人中学高三下学期冲刺模拟考试化学试题(一)含答案: 这是一份2021省大庆铁人中学高三下学期冲刺模拟考试化学试题(一)含答案,共12页。试卷主要包含了[化学——选修3等内容,欢迎下载使用。












