



2020-2021学年第六章 化学反应与能量第二节 化学反应的速率与限度教学演示ppt课件
展开2 mL 0.01 ml•L-1 KI溶液、 1 mL 0.01 ml•L-1 FeCl3溶液、0.1 ml•L-1 KSCN 溶液。
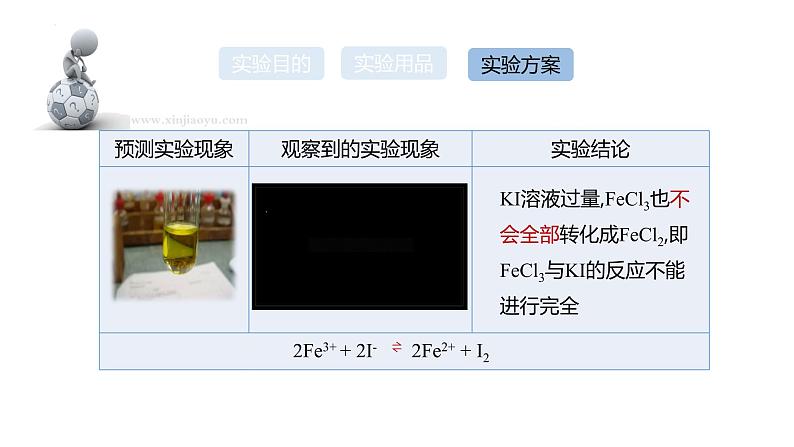
KI溶液过量,FeCl3也不会全部转化成FeCl2,即FeCl3与KI的反应不能进行完全
2Fe3+ + 2I- 2Fe2+ + I2
反应进行得不彻底的原因是什么?
某班同学以二氧化硫与氧气生成三氧化硫的反应为例,分析为什么即使氧气过量二氧化硫也不能全部转化成三氧化硫。他们在讨论过程中形成了以下三种观点,请结合相关资料对他们的观点进行分析论证。
观点 1 :只有部分二氧化硫与氧气发生反应。
观点 2 :二氧化硫全部转化成三氧化硫后,部分三氧化硫分解又生成二氧化硫。
观点 3 :二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫分解生成二氧化硫和氧气。
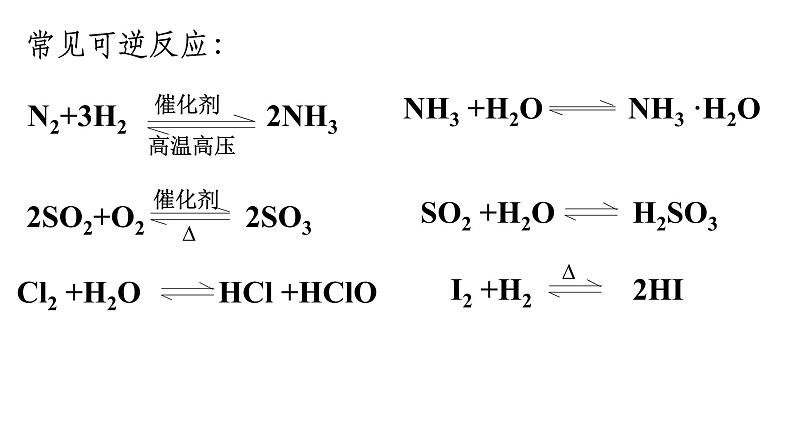
信息1:实验发现,一定条件下向一密闭容器中充入SO2与18O2,反应一段时间后,核素18O存在于SO2、O2、SO3中。
信息2:密闭容器中SO2与O2在一定条件下发生反应,反应过程中SO3的物质的量的变化趋势如图所示。
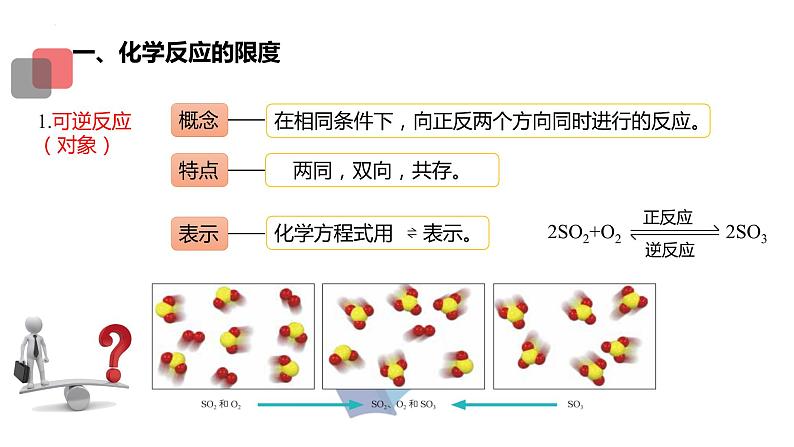
在相同条件下,向正反两个方向同时进行的反应。
1.反应刚开始时,反应物和生成物的浓度哪个大?随着反应的进行,反应物和生成物浓度如何变化?
2.反应刚开始时,正反应与逆反应哪个反应速率大?随着反应的进行,v(正)与v(逆)怎样变化?
3.反应会进行到什么时候“停止”?
4.此时,反应物和生成物浓度如何变化?
5.反应真的停止了吗?
化学平衡状态建立的过程如对于可逆反应2SO2+O2 2SO3,在一定温度下,将2 ml SO2(g)和1 ml O2(g)通入一定体积的密闭容器中。其化学反应过程如图所示。
达到反应限度后,反应物和生成物浓度不在变化(定)
达到反应限度后V正=V逆(等)≠0(动)
2.化学平衡状态的建立及特征
v(正)>v(逆), 向正反应方向,建立平衡
如果外界条件(温度、浓度、压强等)不发生改变,当可逆反应进行到一定程度时,正反应速率与逆反应速率相等,反应物的浓度与生成物的浓度都不再改变,达到一种表面静止的状态,称之为化学平衡状态,简称化学平衡。
可逆反应达到平衡状态后,平衡状态能否改变呢?
条件改变,原平衡被破坏,发生移动,在新的条件下建立新的化学平衡。
动态平衡,v(正)= v(逆) ≠0
条件一定,平衡混合物中各物质的浓度不变,体系的组成不变。
化学平衡状态是可逆反应在一定条件下所能达到的或完成的最大限度。
任何可逆反应在给定条件下的进程都有一定的限度,只是不同反应的限度不同,转化率小于100%。
改变反应条件可以在一定程度上改变一个化学反应的限度,即改变该反应的化学平衡状态。
4.化学平衡状态的判断依据
速率必须一个是正反应速率,一个是逆反应速率,且经过换算后同一物质的消耗(断键)速率和生成(成键)速率相等。(不同物质速率应体现正逆方向且符合系数比)
如果一个物理量随着反应的进行而改变,当其不变时为平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据。
☂归纳总结 判断可逆反应达到平衡状态的方法
1.可逆反应2NO2(g) 2NO(g)+O2(g)在容积固定的密闭容器中进行,达到平衡状态的标志是 (填序号)。(1)单位时间内生成n ml O2的同时生成2n ml NO2(2)单位时间内生成n ml O2的同时生成2n ml NO(3)用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态(4)混合气体的颜色不再改变的状态(5)混合气体的密度不再改变的状态(6)混合气体的压强不再改变的状态(7)混合气体的平均相对分子质量不再改变的状态(8)容器内温度不变
(1)(4)(6)(7)(8)
【答案】(1)3X(g)+Y(g) ⇌ 2Z(g) (2)③④⑤⑧ (3)AC
二、化学反应条件的控制
化工生产中化学反应条件的控制
改变可逆反应进行的程度
温度低,反应速率小,氨的产率高
压强大反应速率大,氨的产率高,但对动力与设备要求高
使用催化剂能很大程度加快化学反应速率,但在高温时催化剂失效
采用条件温度400~500℃压强10~30MPa使用催化剂
生产中炼铁所需焦炭的实际用量远高于按照化学方程式计算所需用量,而且高炉顶部排出的气体中总含有没有利用的CO。这使炼铁工程师疑惑不解。
猜想:炼铁工程师们认为是CO与铁矿石接触不充分造成的。 措施:设法增加高炉的高度,以增加接触时间。 结果:高炉尾气中CO的比例竟然没有改变。
1.下列措施可以提高燃料燃烧效率的是( )①提高燃料的着火点 ②降低燃料的着火点 ③将固体燃料粉碎 ④将液体燃料雾化 ⑤将煤气化处理 ⑥通入足量的空气 A.①③④⑤ B.②③⑤⑥ C.③④⑤⑥ D.①②③④
2.下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是_______________(填序号)。
(1)步骤①中“净化”可以防止催化剂中毒(2)步骤②中“加压”可以加快反应速率(3)步骤②采用的压强是2×107 Pa,因为在该压强下铁触媒的活性最大(4)步骤③,选择高效催化剂是合成氨反应的重要条件(5)目前,步骤③一般选择控制反应温度为700 ℃左右(6)步骤④⑤有利于提高原料的利用率,能节约生产成本
(1)(2)(4)(6)
3.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: (正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。
下列叙述中正确的是( )A.c点处正反应速率和逆反应速率相等B.a点的正反应速率比b点的大C.d点(t1时刻)和e点(t2时刻)处n(N2)不同D.在t2时刻,正反应速率大于逆反应速率
高中人教版 (2019)第二节 化学反应的速率与限度获奖课件ppt: 这是一份高中人教版 (2019)第二节 化学反应的速率与限度获奖课件ppt,共30页。PPT课件主要包含了学习目标,科学史话,课堂练习,①②④⑤等内容,欢迎下载使用。
高中化学必修2 第2课时 化学反应的限度 化学反应条件的控制: 这是一份高中化学必修2 第2课时 化学反应的限度 化学反应条件的控制,共38页。
高中化学必修2 6.2.2 化学反应的限度和化学反应条件的控制 课件(共29张): 这是一份高中化学必修2 6.2.2 化学反应的限度和化学反应条件的控制 课件(共29张),共29页。













