

一轮复习难溶电解质的溶解平衡
展开
一轮复习||难溶电解质的溶解平衡
难溶电解质的溶解平衡
最新课程标准1.认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化。 2.能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
考点一 沉淀溶解平衡及其应用
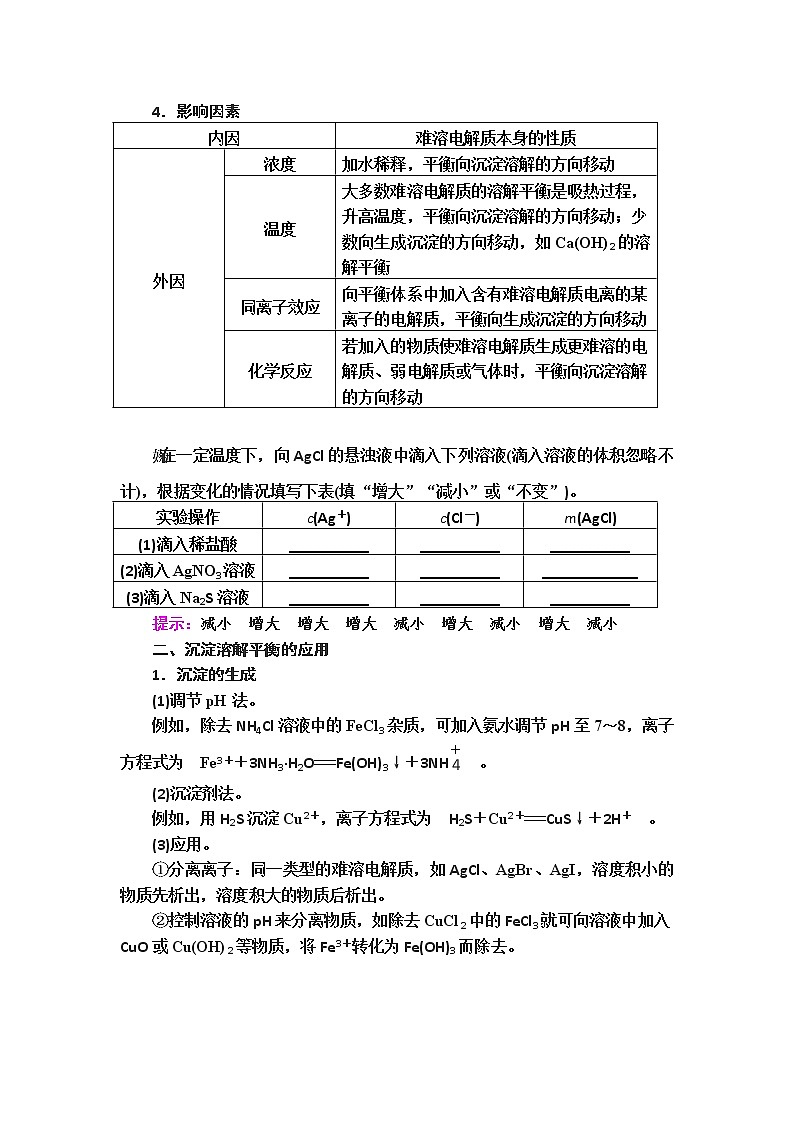
一、沉淀溶解平衡
1.沉淀溶解平衡的概念
在一定温度下,当难溶强电解质溶于水形成饱和溶液时,溶解速率和生成沉淀速率相等的状态。
难溶电解质一定是弱电解质吗?
提示:不一定,如BaSO4、AgCl等都是强电解质。
①AgCl(s)Ag+(aq)+Cl-(aq);②AgCl===Ag++Cl-,①②两式表示的意义相同吗?
提示:不同。①式表示难溶电解质AgCl在水溶液中的沉淀溶解平衡方程式;②式表示强电解质AgCl在水溶液中的电离方程式。
2.溶解平衡的建立
固体溶质溶解沉淀溶液中的溶质。
(1)v(溶解)>v(沉淀),固体__溶解__。
(2)v(溶解)=v(沉淀),溶解__平衡__。
(3)v(溶解)Ag2S,故D正确。
能力二 有关“沉淀溶解平衡”的实验探究
4.将等体积的0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液混合得到浊液,过滤后进行如下实验:
下列分析不正确的是()
A.①的现象说明上层清液中不含Ag+
B.②的现象说明该温度下Ag2S比Ag2SO4更难溶
C.③中生成Ag(NH3)2(+),促进AgCl(s)溶解平衡正向移动
D.若向③中滴加一定量的硝酸,也可以出现白色沉淀
解析:选A。向①的滤液中滴加0.1 mol/L Na2S溶液,出现浑浊,此实验说明①的溶液中仍然存在银离子,故A错误;向①的溶液中滴加0.1 mol/L Na2S溶液,出现浑浊,此实验说明硫化银比Ag2SO4更难溶,故B正确;取少量氯化银沉淀,滴加氨水,发生反应AgCl(s)+2NH3·H2OAg(NH3)2(+)+Cl-+2H2O,沉淀逐渐溶解,故C正确;若向③中滴加一定量的硝酸,氨水浓度减小,AgCl(s)+2NH3·H2OAg(NH3)2(+)+Cl-+2H2O平衡逆向移动,出现氯化银沉淀,故D正确。
5.已知:Ag++SCN-===AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
下列说法中,不正确的是()
A.①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B.②中现象产生的原因是发生了反应Fe(SCN)3+3Ag+ ===3AgSCN↓+Fe3+
C.③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D.④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
解析:选C。A.AgNO3与KSCN恰好完全反应,上层清液中滴加Fe(NO3)3溶液,出现浅红色溶液,说明上层清液中含有SCN-,即说明Ag+与SCN-生成AgSCN沉淀的反应有限度,故A说法正确;B.根据②中现象:红色褪去,产生白色沉淀,Fe(SCN)3被消耗,白色沉淀为AgSCN,即发生:Fe(SCN)3+Ag+===3AgSCN↓+Fe3+,故B说法正确;C.前一个实验中滴加0.5 mL 2 mol·L-1 AgNO3溶液,Ag+过量,反应②中Ag+有剩余,即滴加KI溶液,I-与过量Ag+反应生成AgI沉淀,不能说明AgI溶解度小于AgSCN,故C说法错误;D.白色沉淀为AgSCN,加入KI后,白色沉淀转化成黄色沉淀,即AgSCN转化成AgI,随后沉淀溶解,得到无色溶液,可能是AgI与KI溶液中的I-进一步发生了反应,故D说法正确。
考点二 溶度积常数及其应用
1.溶度积和离子积
以AmBn(s)mAn+(aq)+nBm-(aq)为例:
溶度积
离子积
概念
沉淀溶解的平衡常数
溶液中有关离子浓度幂的乘积
符号
Ksp
Qc
表达式
Ksp(AmBn)=__cm(An+)·cn(Bm-)__,式中的浓度都是平衡浓度
Qc(AmBn)=__cm(An+)____·cn(Bm-)__,式中的浓度都是任意浓度
应用
判断在一定条件下沉淀能否生成或溶解
①Qc>Ksp:溶液过饱和,有__沉淀__析出
②Qc=Ksp:溶液饱和,处于__平衡__状态
③Qc<Ksp:溶液__未饱和__,无沉淀析出
2.Ksp的影响因素
(1)内因:难溶物质本身的性质,这是主要决定因素。
(2)外因
①浓度:加水稀释,平衡向__溶解__方向移动,但Ksp__不变__。
②温度:绝大多数难溶盐的溶解是__吸热__过程,升高温度,平衡向__溶解__方向移动,Ksp__增大__。
③其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但Ksp不变。
不同温度下(T1、T2),Ca(OH)2在水中的沉淀溶解平衡曲线如图所示,回答下列问题[注:Ca(OH)2均未完全溶解]。
(1)T1____________T2(填“>”“<”或“=”)。
(2)保持T1不变,怎样使A点变成B点?________________________________________________________________________________________________________________________________________________。
(3)在B点,若温度从T1到T2,则B点变到____________点(填“C”“D”或“E”)。
提示:(1)> (2)保持T1不变,向悬浊液中加入NaOH固体 (3)D
(1)Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度()
(2)沉淀溶解平衡发生移动,Ksp一定发生变化()
(3)Ksp发生变化,沉淀溶解平衡一定发生移动()
(4)溶度积小的沉淀不能转化为溶度积大的沉淀()
(5)温度升高,Ksp一定增大()
(6)利用沉淀反应除杂时,可以把杂质离子浓度转化为0()
(7)不可能使要除去的离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时,沉淀已经完全()
答案:(1)×(2)×(3)√(4)×(5)×(6)×(7)√
1.(新教材RJ选择性必修1 P85T3)现进行下列实验:
(1)将0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液等体积混合,得到悬浊液a,将悬浊液a过滤,得到滤液b和白色沉淀c。
(2)向滤液b中滴加0.1 mol/L KI溶液,滤液出现浑浊。
(3)向沉淀c中滴加0.1 mol/L KI溶液,沉淀变为黄色。
下列关于上述实验的分析错误的是()
A.悬浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.滤液b中不含Ag+
C.实验(3)表明AgCl转化为AgI
D.实验可以证明AgI的Ksp比AgCl的小
答案:B
2.已知lg 2=0.301 0,Ksp[Mn(OH)2]=2.0×10-13。实验室制氯气的废液中含c(Mn2+)=0.1 mol·L-1,向该溶液中滴加稀氢氧化钠溶液至Mn2+完全沉淀的最小pH等于()
A.8.15 B.9.3
C.10.15 D.11.6
解析:选C。Mn2+沉淀较为完全时的浓度为1×10-5 mol·L-1,已知Ksp=c(Mn2+)·c2(OH-),c(OH-)=c(Mn2+)(Ksp)=1×10-5(2×10-13) mol·L-1=×10-4 mol·L-1,c(H+)=c(OH-)(Kw)=×10-4(10-14) mol·L-1=2(2)×10-10 mol·L-1,所以pH=-lg2(2)×10-10=10+2(1)lg 2=10.15。
3.(多选)已知下列物质在20 ℃下的Ksp如下:
化学式
AgCl
AgBr
AgI
Ag2S
Ag2CrO4
颜色
白色
浅黄色
黄色
黑色
红色
Ksp
2.0×10-10
5.4×10-13
8.3×10-17
2.0×10-48
2.0×10-12
下列说法不正确的是()
A.20 ℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl>AgBr>AgI>Ag2S。
B.向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br-) /(Cl-)=2.7×10-2
C.测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是K2CrO4
D.某溶液中含有Cl-、Br-和I-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,Cl-最先沉淀出来
解析:选BD。A.20 ℃时,在AgCl的饱和溶液中,Ksp=c(Ag+)·c(Cl-)=2.0×10-10,c(Ag+)= mol·L-1;Ag2CrO4饱和溶液中,Ksp=c2(Ag+)·c(CrO4(2-))=2.0×10-12,c(Ag+)=2×2×10-12(3) mol·L-1;同理,在AgI的饱和溶液中,c(Ag+)= mol·L-1;在AgBr的饱和溶液中,c(Ag+)= mol/L;在Ag2S的饱和溶液中,c(Ag+)=2×2×10-48(3) mol·L-1;故Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl>AgBr>AgI>Ag2S,故A正确;B.当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=c(Ag+)(Ksp(AgBr)),c(Cl-)=c(Ag+)(Ksp(AgCl)),则c(Cl-)(c(Br-))=2.0×10-10(5.4×10-13)=2.7×10-3,故B错误;C.指示剂的作用是指示出氯离子恰好沉淀完全,即让氯离子先沉淀,沉淀完全后,再滴入硝酸银溶液会生成一种颜色不同的沉淀来指示滴定终点;氯化银、溴化银、碘化银的组成都是1∶1,依据Ksp可以直接比较溶解度大小为氯化银>溴化银>碘化银;Ksp(AgCl)=c(Ag+)·c(Cl-)=2.0×10-10,c(Cl-)= mol·L-1;Ksp(Ag2CrO4)=c2(Ag+)·c(CrO4(2-))=2.0×10-12,c(CrO4(2-))=4(2.0×10-12) mol·L-1,同理硫化银的Ksp=c2(Ag+)·c(S2-)=2.0×10-48,c(S2-)=4(2.0×10-48) mol·L-1,说明铬酸银溶解度大于氯化银,硫化银溶解度小于氯化银,则加入K2CrO4作指示剂,可正确的测定氯化物的含量,故C正确;D.某溶液中含有Cl-、Br-和I-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,氯化银、溴化银、碘化银的组成都是1∶1,Ksp由大到小的顺序为AgCl>AgBr>AgI,因此I-最先沉淀出来,故D错误。
4.已知在25 ℃时,Ksp[Mg(OH)2]=3.2×10-11,
Ksp[Cu(OH)2]=2.2×10-20。
(1)在25 ℃时,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为____________mol·L-1。
(2)25 ℃时,向浓度均为0.02 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成____________沉淀(填化学式);生成该沉淀的离子方程式为________________________;当两种沉淀共存时,c(Cu2+)(c(Mg2+))=____________。
解析:(1)依据Ksp和c(Mg2+)计算c(OH-)。(2)两种沉淀共存时,c(OH-)相等,c(Mg2+)=c(Cu2+),Ksp小的先满足Qc>Ksp,先生成该沉淀,Ksp[Mg(OH)2]>Ksp[Cu(OH)2],故先生成Cu(OH)2沉淀;当两种沉淀共存时,c(Cu2+)(c(Mg2+))=Ksp[Mg(OH)2]/Ksp[Cu(OH)2]=1.45×109。
答案:(1)4×10-5(2)Cu(OH)2Cu2++2OH-===Cu(OH)2↓1.45×109
5.Na2S可用于制造硫化染料、沉淀水体中的重金属等。
(1)Na2S溶液中S2-水解的离子方程式为_________。
(2)室温时,几种重金属离子的硫化物的溶度积常数如下表:
金属硫化物
FeS
PbS
CuS
HgS
Ksp
6.3×10-18
1.0×10-28
6.3×10-36
1.6×10-52
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是________。
②用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×10-6 mol/L],则应满足溶液中c(S2-)≥_________mol/L。
③反应Cu2+(aq)+FeS(s)Fe2+(aq)+CuS(s)的平衡常数K=___________。
解析: (2)①Fe2+、Pb2+、Cu2+、Hg2+都是+2价的金属阳离子,由于它们的浓度相同,因此向该溶液中加入Na2S溶液时,溶度积常数越小,形成沉淀越容易。根据重金属离子的硫化物的溶度积常数表可知HgS的最小,因此首先形成的是HgS沉淀;②用Na2S溶液沉淀废水中Pb2+,使Pb2+沉淀完全,这时溶液中c(Pb2+)≤1×10-6 mol/L,由于当c(Pb2+)·c(S2-)≥Ksp(PbS)时就可以形成PbS沉淀,所以c(S2-)≥1.0×10-28÷1.0×10-6=1.0×10-22mol/L;③反应Cu2+(aq)+FeS(s)Fe2+(aq)+CuS(s)的平衡常数K=c(Cu2+)(c(Fe2+))=c(Cu2+)·c(S2-)(c(Fe2+)·c(S2-))=Ksp(CuS)(Ksp(FeS))=1.0×1018。
答案:(1)S2-+H2OHS-+OH-(2)①Hg2+
②1.0×10-22③1.0×1018





