

2022河南省大联考“顶尖计划”高三上学期第一次考试化学含答案
展开“顶尖计划”2022届高中毕业班第一次考试
理科综合 化学部分
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16
一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.三星堆新一轮考古发掘发现引发了世界考古学界的关注。下列文物主要由合金材料制成的是
8.京尼平是一种优良的天然生物交联剂,其结构如图所示,下列有关该有机物的说法错误的是
A.分子式为C11H14O5
B.能发生氧化反应和水解反应
C.1 mol该有机物与H2反应最多能消耗3 mol H2
D.与互为同分异构体
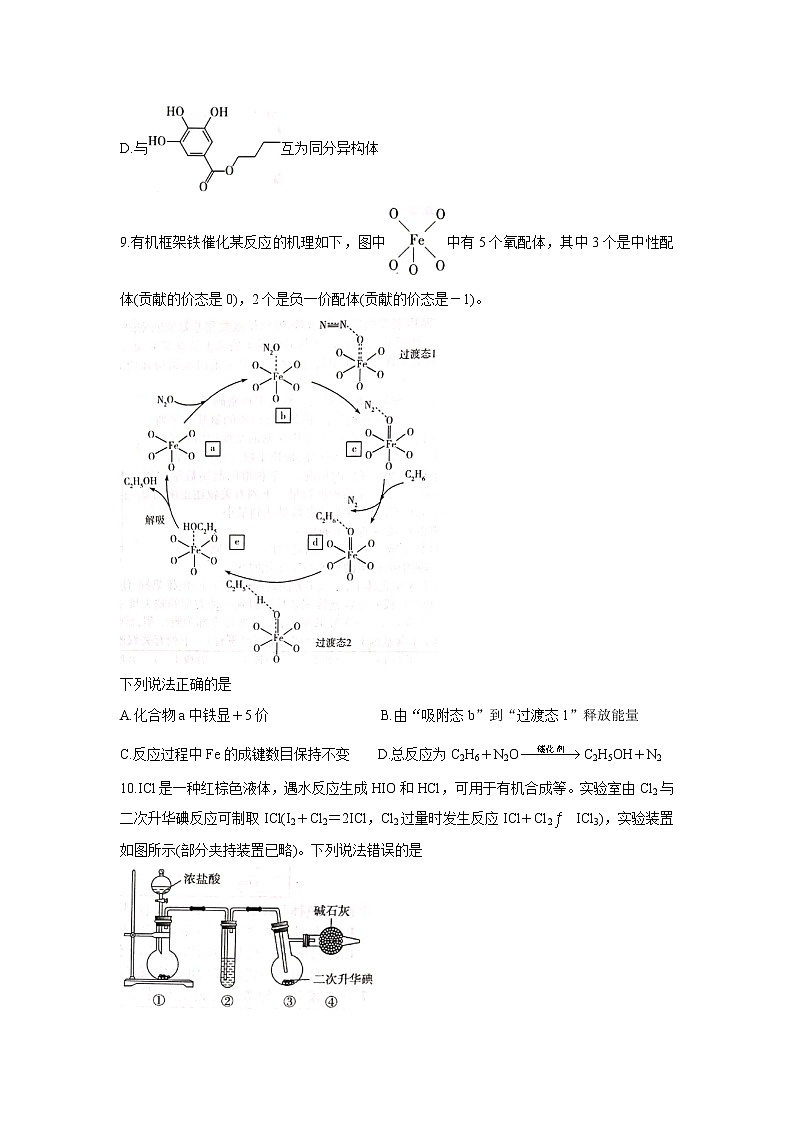
9.有机框架铁催化某反应的机理如下,图中中有5个氧配体,其中3个是中性配体(贡献的价态是0),2个是负一价配体(贡献的价态是-1)。
下列说法正确的是
A.化合物a中铁显+5价 B.由“吸附态b”到“过渡态1”释放能量
C.反应过程中Fe的成键数目保持不变 D.总反应为C2H6+N2OC2H5OH+N2
10.ICl是一种红棕色液体,遇水反应生成HIO和HCl,可用于有机合成等。实验室由Cl2与二次升华碘反应可制取ICl(I2+Cl2=2ICl,Cl2过量时发生反应ICl+Cl2ICl3),实验装置如图所示(部分夹持装置已略)。下列说法错误的是
A.装置①烧瓶中盛放的药品可以是KMnO4
B.装置②试管中盛放的是饱和食盐水
C.当装置③烧瓶中固体全部变为液体时,可用蒸馏的方法提纯产品
D.装置④可吸收尾气中的氯气等气体并防止水蒸气进入装置③
11.主族元素W、X、Y、Z的原子序数均不超过20,X、Y、Z位于同周期,它们形成的一种化合物的结构如下图所示,其中X、Y、Z的电子数之和与W+的电子数相等。下列说法正确的是
A.原子半径:W>X>Y>Z B.简单气态氢化物的热稳定性Y比X的强
C.Z的最高价氧化物对应的水化物是强酸 D.该阴离子中各原子最外层均满足8电子结构
12.一种用离子液体作电解质的硅氧燃料电池的装置如下图所示[RTIL为离子液体电解质,阳离子为EMIm+,阴离子有(HF)2F-和(HF)3F-]。下列说法错误的是
A.电池总反应为Si+O2=SiO2
B.电池工作时,(HF)2F-向Si极移动
C.负极上Si直接被氧化成SiO2后在正极上沉积
D.正极上发生反应O2+4e-+12(HF)3F-=16(HF)2F-+2H2O
13.氨基酸分子中含有-NH2和-COOH两种官能团,氨基酸分子表面不带电荷时的pH称为等电点,等电点时甘氨酸(+H,NCH,COO-)记作HA。已知H2A+HAA-,pK=-lgK。25℃时用NaOH溶液滴定pH=0的甘氨酸,甘氨酸被滴定的百分数[被滴定的百分数=×100%]与溶液pH的关系如图所示,下列说法错误的是
A.X点时,c(HA)=c(A-)
B.Y点的pH=(pK1+pK2)/2
C.从Y点到Z点的过程中发生的反应为HA+OH-=A-+H2O
D.-COO-结合H+的能力比-NH2的弱
三、非选择题:包括必考题和选考题两部分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
(一)必考题:共129分。
26.(14分)从电镀污泥[含Cr(OH)3、Ni(OH)2、Cu(OH)2、FeO及Fe(OH)3]中回收铬并制备中铬黄(PbCrO4)的工艺流程如下:
已知:
I.25℃时,PbCrO4的K为2.8×10-13,Pb(OH)2的Ksp为1.2×10-15,PbCr2O7在水溶液中不稳定,会转化为PbCrO4和H2CrO4。
II.在碱性条件下,三价铬可被H2O2氧化为六价铬;在酸性条件下,六价铬可被H2O2还原为三价铬。
III.2CrO42-+2H+Cr2O72-+H2O(pH<5时主要以Cr2O72-存在,pH≥7时主要以CrO42-存在)。
回答下列问题:
(1)“氨浸”时,铬、镍及铜分别以[Cr(NH3)6]3+、[Ni(NH3)6]2+及[Cu(NH3)4]2+形式被浸出,加与不加催化剂时铬的浸出率与时间的关系如下图所示:
①“氨浸”的适宜温度约为75℃,超过80℃时会使镍、铜的浸出率明显下降,其原因是 ;其中Cu(OH)2被浸取的化学方程式为 。
②“氨浸”时加入催化剂的目的是 。
(2)“氧化”时生成CrO42-的离子方程式为 ;滤渣的成分是 (填化学式)。
(3)“煮沸”的目的是 。
(4)“沉铬”时是采用弱酸性还是碱性条件? ,说明原因: 。
27.(14分)某校同学设计实验利用HCOONa与SO2等物质制备Na2S2O4。回答下列问题:
(1)甲组同学采用下列实验流程在常压下制备HCOONa,并测定产品中HCOO-的质量分数。
①可利用草酸晶体(熔点为101℃)热分解制备CO气体(H2C2O4·2H2OCO↑+CO2↑+3H2O),热分解制备CO的合适装置是 (填标号)。反应器适宜的加热方法是 。
②测定产品中HCOO-质量分数的步骤如下:准确称取产品a g溶于水并加入适量NaOH,再加入V1 mL、c1 mol·L-1 KMnO4溶液(HCOO-+2MnO4-+3OH-=CO32-+2MnO42-+2H2O);充分反应后,加入硫酸酸化后加入稍过量的KI(MnO42-+4I-+8H+=Mn2++2I2+4H2O,2MnO4-+10I-+16H+=2Mn2++5I2+8H2O),用淀粉作指示剂并用c2 mol·L-1 Na2S2O3标准溶液滴定生成的I2(I2+2Na2S2O3=Na2S4O6+2NaI),滴定达到终点时消耗V2 mL Na2S2O3溶液。产品中HCOO-的质量分数为 (列出计算式即可)。
(2)乙组同学利用甲醇、水作溶剂,以及甲组同学制得的HCOONa等,并用下列装置(部分夹持及加热装置已略)在70~83℃制备Na2S2O4。已知:Na2S2O4不溶于甲醇。
①B中盛放的试剂是 。
②C中用甲醇作溶剂的目的是 ;C中生成Na2S2O4,并产生无色气体的化学方程式为 。
③反应结束时,从C中获得粗产品Na2S2O4晶体需经过的操作步骤的名称是 、
,然后经过重结晶等得纯产品。
28.(15分)2021年6月17日神舟天和成功对接,中国宇航员入驻空间站。空间站处理CO2的一种重要方法是CO2的收集与浓缩、CO2的还原。H2还原CO2制CH4的部分反应如下:
I.CO2(g)+H2(g)CO(g)+H2O(g) △H1=+41 kJ·mol-1
II.CO(g)+3H2(g)CH4(g)+H2O(g) △H2=-246 kJ·mol-1
III.CO(g)+H2(g)C(s)+H2O(g) △H3=-131 kJ·mol-1
……
回答下列问题:
(1)反应2C(s)+2H2O(g)CH4(g)+CO2(g)的△H= kJ·mol-1。
(2)循环系统中可利用弱碱性的固态胺离子树脂(R1NHR2)吸收舱内空气中的CO2、H2O生成酸式碳酸盐,该反应的化学方程式为 ;再解吸出CO2的简单方法是 。
(3)H2还原解吸出的CO2生成的H2O可用于补充航天员生活用水或电解再生氧气,电解时阳极产生O2的电极反应式为 。
(4)控制起始时n(H2)/n(CO2)=4,p=1 atm,若只发生反应I、II平衡时各物质的物质的量分数随温度的变化如下图所示:
①图中代表的物质:a (填化学式,下同),b 。
②温度高于500℃时,CO的物质的量分数不断增大的原因是 。
③M点时,平衡分压p(CO2)= atm(保留小数点后3位),反应CO2(g)+4H2(g)CH4(g)+2H2O(g)的平衡常数Kp= atm-2(以分压表示,分压=总压×物质的量分数)。
(二)选考题:共45分。请考生从给出的2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每学科按所做的第一题计分。
35.[化学——选修3:物质结构与性质](15分)
镍的合金及镍的配合物[如Ni(CO)4、[Ni(CN)4]2-、[Ni(en)3]SO4等]在生产和科学研究中有重要应用。回答下列问题:
(1)基态Ni原子的价电子排布式为 。
(2)Ni与Ca同周期且最外层电子构型相同,镍的熔、沸点依次为1453℃、2732℃,钙的熔、沸点依次为842℃、1484℃,镍的熔、沸点均比钙高得多,这是因为 。
(3)CuNi(CN)4是一种二维负热膨胀材料,可通过下列反应(未配平)制备:
CuNi(CN)4中Cu、Ni的配位原子依次为 、 ,其σ键与π键数目之比为 。
(4)Ni(CO)4的中心原子为sp3杂化,Ni(CO)4的空间构型为 ;[Ni(CN)4]2-的中心原子含s、p、d轨道的杂化轨道,其中Ni采取的杂化类型为 (填标号)。
①dsp2 ②sp3d ③sp3d2
(5)乙二胺(en,)的沸点为117.3℃,正丁烷的沸点为-0.5℃,前者沸点比后者高得多的主要原因是 。
(6)某Ni、Nb合金的晶胞结构如图所示,设Ni和Nb的原子半径分别为rNi pm和rNb pm,则金属原子的空间利用率为 %(列出计算表达式)。
36.[化学——选修5:有机化学基础](15分)
伊潘立酮是新一代的抗精神分裂药,化合物H是合成伊潘立酮的一种中间体,H的合成路线如下:
回答下列问题:
(1)反应①的化学方程式为 。
(2)C的结构简式为 。
(3)D的化学名称是 。
(4)反应②③.⑥中属于取代反应的是 。
(5)F中含氧官能团的名称是 。
(6)E的一种芳香异构体的核磁共振氢谱有两组峰,峰面积比为3:2,在酸性条件下的水解产物之一能与FeCl3溶液发生显色反应,写出符合题目要求的同分异构体的结构简式:
(任写一种)。
(7)己内酰胺()可聚合生成尼龙-6,设计以氯苯为起始原料制备己内酰胺的合成路线:
(无机试剂任用,已知贝克曼重排反应为,R、R'为烃基)。
河南省“顶尖计划”2022-2023学年高三上学期第一次考试化学试题: 这是一份河南省“顶尖计划”2022-2023学年高三上学期第一次考试化学试题,共27页。试卷主要包含了单选题,工业流程题,实验题,填空题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。
2021河南省天一大联考“顶尖计划”高三毕业班上学期第一次联考化学试题含答案: 这是一份2021河南省天一大联考“顶尖计划”高三毕业班上学期第一次联考化学试题含答案
2023天一大联考顶尖计划高三上学期第一次联考化学试题含答案: 这是一份2023天一大联考顶尖计划高三上学期第一次联考化学试题含答案,共18页。试卷主要包含了设为阿伏加德罗常数的值,某同学设计下列装置制备少量等内容,欢迎下载使用。












