

2021徐州邳州运河中学高一下学期期中考试化学试卷(普通班)含答案
展开www.ks5u.com高一化学期中考试试卷
可能用到的相对原子质量:H 1 N 14 O 16 Cl 35.5 Fe 56 Cu 64 Ag 108
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.现代社会的发展与进步离不开材料,下列有关材料的说法不正确的是
A.用于制作人造软骨组织的聚乙烯醇是有机高分子化合物
B.“华为麒麟980”手机中芯片的主要成分是二氧化硅
C.中国天眼FAST用到的高性能碳化硅是一种新型的无机非金属材料
D.“蛟龙号”深潜器的外壳是特种钛合金,该钛合金比金属钛硬度高、耐高压、耐腐蚀
2.下列有关化学用语表示正确的是
A.CCl4的电子式:
B.乙醇的结构式: C2H5OH
C.聚氯乙烯的单体为CH2=CHCl
D. 与互为同分异构体
3.下列物质的性质与用途说法均正确,且有因果关系的是
选项 | 性质 | 用途 |
A | Al与浓硫酸不反应 | 用铝槽盛放浓硫酸 |
B | C2H4气体具有可燃性 | 可用作果实的催熟剂 |
C | NH4HCO3受热易分解 | 用NH4HCO3作氮肥 |
D | 常温下,氨气能与氯气反应产生白烟 | 浓氨水检验氯气管道泄漏 |
4. 能正确表示下列反应的离子方程式的是
A.将乙醛与足量银氨溶液共热:
CH3CHO+2[Ag(NH3)2]+ + 2OH- CH3COO- +NH4+ +2Ag↓+3NH3+H2O
B.少量三氧化硫与氨水反应:SO3+NH3•H2O= NH4++HSO4-
C.Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.将过氧化钠加入硫酸亚铁溶液中发生反应:4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+8Na+
5.化合物X的结构简式如图所示。下列有关化合物X的说法正确的是
A.分子中所有碳原子处在同一平面上
B.在一定条件下,X可与HCHO发生缩聚反应
C.1 mol X最多能与1 mol Br2反应
D.1 mol X与NaOH溶液反应时最多消耗5 mol NaOH
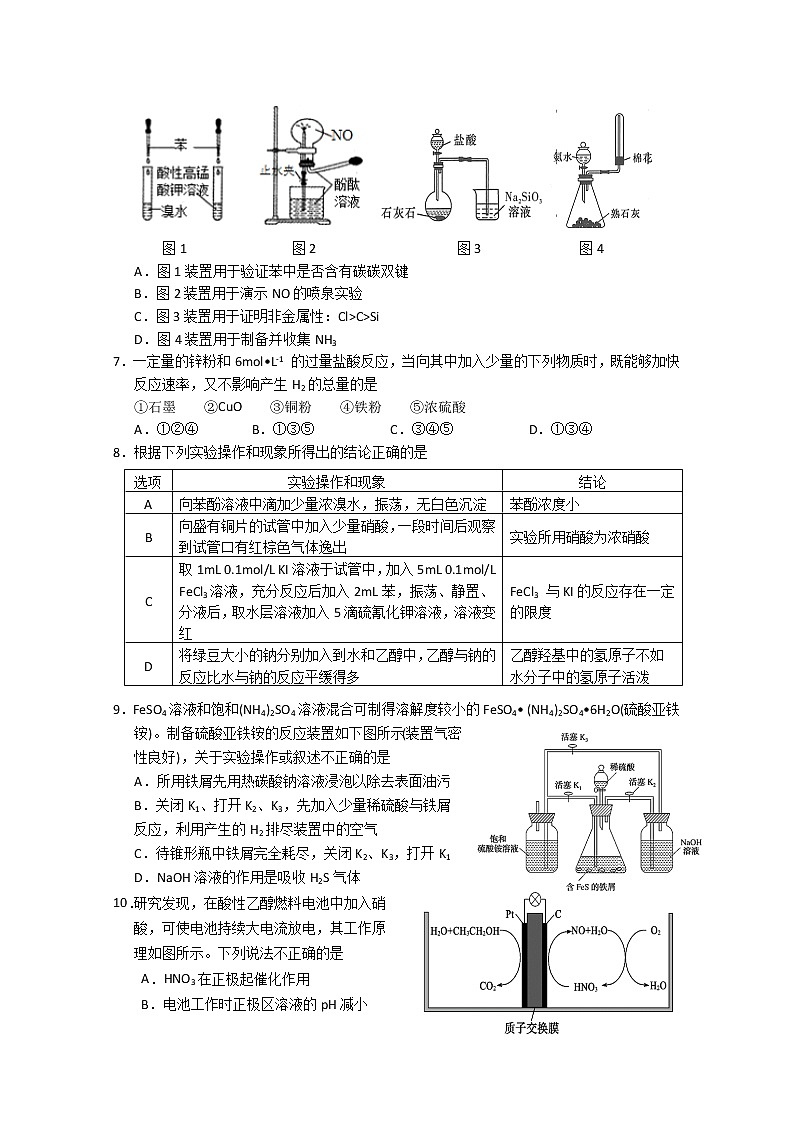
6.用下列装置进行实验,能达到目的的是
图1 图2 图3 图4
A.图1装置用于验证苯中是否含有碳碳双键
B.图2装置用于演示NO的喷泉实验
C.图3装置用于证明非金属性:Cl>C>Si
D.图4装置用于制备并收集NH3
7.一定量的锌粉和6mol•L-1 的过量盐酸反应,当向其中加入少量的下列物质时,既能够加快反应速率,又不影响产生H2的总量的是
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
A.①②④ B.①③⑤ C.③④⑤ D.①③④
8.根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚溶液中滴加少量浓溴水,振荡,无白色沉淀 | 苯酚浓度小 |
B | 向盛有铜片的试管中加入少量硝酸,一段时间后观察到试管口有红棕色气体逸出 | 实验所用硝酸为浓硝酸 |
C | 取1mL 0.1mol/L KI溶液于试管中,加入5mL 0.1mol/L FeCl3溶液,充分反应后加入2mL苯,振荡、静置、分液后,取水层溶液加入5滴硫氰化钾溶液,溶液变红 | FeCl3 与KI的反应存在一定的限度 |
D | 将绿豆大小的钠分别加入到水和乙醇中,乙醇与钠的反应比水与钠的反应平缓得多 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
9.FeSO4溶液和饱和(NH4)2SO4溶液混合可制得溶解度较小的FeSO4• (NH4)2SO4•6H2O(硫酸亚铁铵)。制备硫酸亚铁铵的反应装置如下图所示(装置气密性良好),关于实验操作或叙述不正确的是
A.所用铁屑先用热碳酸钠溶液浸泡以除去表面油污
B.关闭K1、打开K2、K3,先加入少量稀硫酸与铁屑
反应,利用产生的H2排尽装置中的空气
C.待锥形瓶中铁屑完全耗尽,关闭K2、K3,打开K1
D.NaOH溶液的作用是吸收H2S气体
10.研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。下列说法不正确的是
A.HNO3在正极起催化作用
B.电池工作时正极区溶液的pH减小
C.负极反应式为
CH3CH2OH+3H2O-12e- = 2CO2+12H+
D.1mol O2完全消耗时,电池中有4mol电子转移
11.一定温度下,向10mL 0.40mol•L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++H2O2=2Fe2++O2↑+2H+
②H2O2+2Fe2++2H+= 2H2O+2Fe3+
反应过程中的能量变化如上图所示。下列说法不正确的是
A.Fe3+的作用是增大过氧化氢的分解速率
B.反应①是吸热反应,反应②是放热反应
C.0~6min内,平均反应速率:v(H2O2)≈3.33×10-2 mol•L-1•min-1
D.反应2H2O2(aq)= 2H2O(l)+ O2(g)的∆H = E1 - E2 < 0
12.白银(Ag)是高新技术产业的基础材料之一。从一种光盘金属层中回收少量白银(金属层中其它金属含量过低,对实验的影响可忽略)的流程如下:
下列叙述不正确的是
A.“氧化”阶段需在80条件下进行,可用水浴加热
B.“操作1”所用到的玻璃仪器是玻璃棒、烧杯、漏斗
C. 若“还原”过程通过原电池来实现,则N2为正极产物
D.“还原”过程中参加反应的n[Ag(NH3)]:n[N2H4·H2O]=4:1
13.向13.6 g由Cu和Cu2O组成的混合物中加入一定浓度的稀硝酸250 mL,当固体物质完全溶解后生成Cu(NO3)2和NO气体。在所得溶液中加入0.5 mol·L-1的NaOH溶液1.0 L,生成沉淀的质量为19.6 g,此时溶液呈中性且金属离子已完全沉淀。下列有关说法正确的是
A.原固体混合物中Cu和Cu2O的物质的量之比为1∶1
B.原稀硝酸中HNO3的物质的量浓度为1.3 mol·L-1
C.Cu、Cu2O与硝酸反应后剩余的HNO3为0.1 mol
D.产生NO的体积为2.24 L
二、非选择题:共4题,共61分。
14.(14分)CO2是自然界中的重要碳源,CO2综合利用是目前的研究热点。
(1)工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2mol CO2 和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:
①0~10min内,用H2表示的平均反应速率v(H2)= ▲ mol•L-1•min-1。
②能够判断该反应达到平衡状态的是 ▲ (填选项)。
a.CH3OH和H2O的浓度相等
b.混合气体的总物质的量不再改变
c.混合气体的密度不再改变
d.3v逆(H2)= v正(CH3OH)
(2)CH4超干重整CO2的催化转化如图所示:
①请写出上述过程的总化学方程式: ▲ 。
②保持其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用
下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)进行相同时
间后,CH4的转化率随反应温度的变化如图所示。其中
b点CH4的转化率高于c点,原因是 ▲ 。
(3)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na—Fe3O4和HMCM—22的表面将CO2转化为烷烃,其过程如图。
①已知在纳米催化剂Na—Fe3O4表面,1molCO2与H2完全反应生成CO和气态H2O时吸收42 kJ的能量,则该反应的热化学方程式为 ▲ 。
②关于X与Y的说法正确的是 ▲ (填字母)。
a.实验式相同 b.核磁共振氢谱图上均有4组峰
c.X命名为2-甲基丁烷,Y命名为2-甲基戊烷 d.属于同系物
③催化剂中Fe3O4的制备方法如下:将一定比例的FeCl2和FeCl3溶于盐酸,然后在60℃下逐滴加入NaOH溶液,继续搅拌,得Fe3O4。写出该反应的离子方程式 ▲ 。
15.(16分)碱式氯化铜为绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
(1)实验室利用装置A制NH3,发生反应的化学方程式为 ▲ 。
(2)仪器B的名称是 ▲ ,其主要作用有导气、 ▲ 。
(3)若体系NH3浓度过高会导致碱式氯化铜的产量 ▲ (填“偏高”、“偏低”或“无影响”)。
(4)反应结束将三颈烧瓶中的混合物过滤,从滤液中可以获得的副产品是 ▲ (填化学式)。
Ⅱ.碱式氯化铜Cua(OH)bClc·xH2O组成的测定。称取产品4.650g,用适量稀HNO3溶解后配成200mL待测液。
①取20.00mL待测液,向溶液中滴加浓度为0.0800mol·L-1的EDTA(Na2H2Y·2H2O)溶液,发生反应Cu2++ H2Y2-=CuY2-+2H+,消耗EDTA(Na2H2Y·2H2O)溶液50.00 mL时恰好完全反应。
②取20.00mL待测液,加入足量AgNO3溶液,得AgCl 0.287g。
通过计算确定该样品的化学式(写出计算过程)。
16.(16分)化合物F是合成雌酮激素的中间体,其合成路线如图:
已知:(1)
(2) (3)-NH2易被氧化
(1)D中含氧官能团名称为 ▲ 、 ▲ 。
(2)D→E的反应类型为 ▲ 。
(3)A的分子式为C10H10O3,写出A的结构简式: ▲ 。
(4)F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: ▲ 。
①分子中含有四种不同化学环境的氢
②苯环上只有2个取代基,不能发生水解反应
(5)写出以甲苯为原料制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
17.(15分)磷精矿湿法制备磷酸的一种工艺流程如下:
已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH) < CaSO4•0.5H2O
(1)上述流程中采取的加快反应速率的措施有 ▲ 、 ▲ 。
(2)酸浸时,磷精矿粉中Ca5(PO4)3(OH)发生的反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4 10CaSO4•0.5H2O+6H3PO4
该反应体现出酸性关系:H3PO4 ▲ H2SO4(填“>”或“<”)。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式 ▲ 。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如右图所示。80℃后脱除率变化的原因 ▲ 。
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42−残留,原因
是 ▲ 。
高一化学期中考试试卷参考答案
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
答案 | B | C | D | A | B | A | B | D | C | B | D | C | C |
14、(14分,每空2分)
(1)①0.225 ②b (2)① CH4 +3CO2 ===== 4CO+2H2O
②b和c点均未达到平衡,b点反应温度高,速率快,所以转化率高
(3)①CO2(g)+H2(g) ⇌ CO(g)+H2O(g) △H=+42kJ/mol ②b d
③Fe2++2Fe3+8OH- = Fe3O4+4H2O
15、(16分,Ⅰ中(1)~(4)每空2分,Ⅱ计算共6分)
Ⅰ、(1)2NH4Cl+Ca(OH)2 == CaCl2+2NH3+2H2O
(2)球形干燥管,防倒吸 (3)偏低 (4)NH4Cl
Ⅱ、n(Cu2+)=n(EDTA)×=0.08000mol·L-1×50.00 mL×10-3L·mL-1×10=0.04mol(1分)
n(Cl-)=n(AgCl)×==0.02mol (1分)
再由化合物中电荷守恒得:
n(OH-)=2n(Cu2+)-n(Cl-)=2×0.04mol-0.02mol=0.06mol (1分)
分别求出这3种离子的质量,根据质量守恒,求出H2O的质量:
m(Cl-)=0.02mol×35.5 g·mol -1 =0.71 g m(Cu2+)=0.04mol×64 g·mol -1 =2.56g
m(OH-)=0.06mol×17 g·mol -1 =1.02g
n(H2O)==0.02mol (2分)
a∶b∶c∶x = n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1
样品的化学式为Cu2 (OH)3Cl·H2O (1分)
16、(16分,(1)(2)(3)每空2分;(4)3分;(5)5分)
(1)羧基 、醚键 (2)取代反应 (3) (4)
(5)
17、(15分,(1)(2)每空2分;其余每空3分)
(1)研磨、加热 (2)<
(3)2Ca5(PO4)3F+10H2SO4+5H2O10CaSO4·0.5H2O+6H3PO4+2HF↑
(4)80 ℃后,H2O2分解速率大,浓度显著降低 (5)CaSO4微溶
2021徐州运河高级中学高二下学期期中考试化学试题含答案: 这是一份2021徐州运河高级中学高二下学期期中考试化学试题含答案,共9页。试卷主要包含了具有止血功能,下列离子方程式书写正确的是等内容,欢迎下载使用。
2021徐州邳州运河中学高一下学期期中考试化学试卷(实验班)含答案: 这是一份2021徐州邳州运河中学高一下学期期中考试化学试卷(实验班)含答案,共8页。
2021娄底一中高一下学期期中考试化学(非高考班)试卷含答案: 这是一份2021娄底一中高一下学期期中考试化学(非高考班)试卷含答案,共6页。试卷主要包含了5 Cu-64,甲烷属于下列哪类物质,下列气体的主要成分不是甲烷的是, 下列气体呈红棕色的是,下列有机物中,属于烃类的是等内容,欢迎下载使用。












