

2022年江苏省徐州七中高考化学模拟试卷(2月份(含答案解析)
展开2022年江苏省徐州七中高考化学模拟试卷(2月份)
1. 2021年4月29日,中国空间站核心舱“天和号”成功送入预定轨道,它与化学有着密切联系。下列说法错误的是( )
A. 中国空间站推进器的推进剂氙气(Xe)属于稀有气体
B. “天和号”推进器的氮化硼陶瓷基材料属于新型无机非金属材料
C. 宇航服材料中的聚氯乙烯属于有机高分子材料
D. 空间站太阳能电池板的主要材料属于硅酸盐
2. 三元催化器是汽车排气系统中重要的净化装置,可同时将碳氢化合物、一氧化碳和氮氧化物转化为无害物质,其工作原理如图。下列说法错误的是( )
A. N2分子中有1个σ键和2个π键 B. CO2的电子式为
C. H2O是非极性分子 D. 中子数为8的碳原子可表示为 614C
3. 下列物质性质与用途的对应关系不正确的是( )
A. 小苏打能与碱反应,可用作抗酸药
B. Al2O3熔点高,可用作耐高温材料
C. Na2O2能吸收CO2产生O2,可用作呼吸面具供氧剂
D. 漂白粉具有强氧化性,可用于生活用水的消毒
4. 2021年5月15日我国“祝融号”火星车成功着陆火星。研究表明,火星夏普山矿脉中含有原子序数增大的短周期主族元素W、X、Y、Z.已知W、Z同主族,且Z的原子序数是W的2倍,X的氢化物可用于蚀刻玻璃,Y与Z最外层电子数之和等于8。下列说法正确的是( )
A. W与Z有相同的最高正价
B. 原子半径:Z>Y>W>X
C. 化合物YZW4中含离子键和共价键
D. 电负性大小:W>X>Z
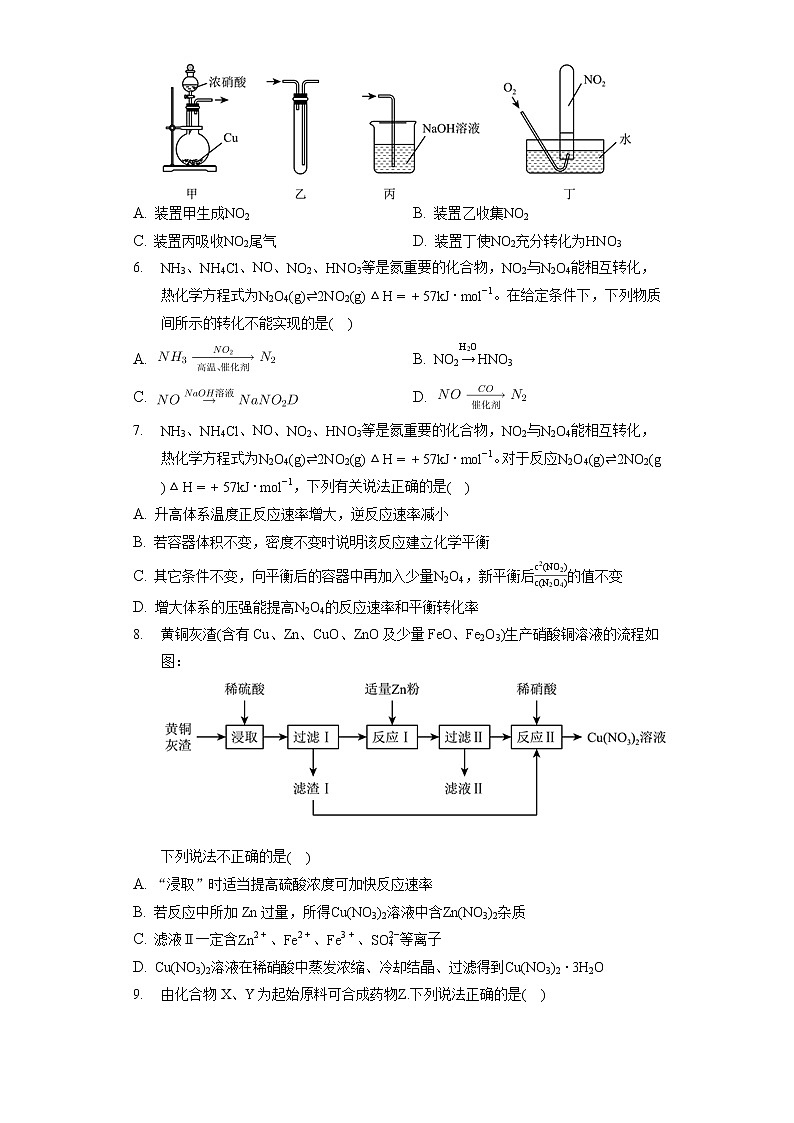
5. NH3、NH4Cl、NO、NO2、HNO3等是氮重要的化合物,NO2与N2O4能相互转化,热化学方程式为N2O4(g)⇌2NO2(g)ΔH=+57kJ⋅mol−1。已知2NO2+2OH−=NO3−+NO2−+H2O。下列装置不能达到相应实验目的的是( )
A. 装置甲生成NO2 B. 装置乙收集NO2
C. 装置丙吸收NO2尾气 D. 装置丁使NO2充分转化为HNO3
6. NH3、NH4Cl、NO、NO2、HNO3等是氮重要的化合物,NO2与N2O4能相互转化,热化学方程式为N2O4(g)⇌2NO2(g)△H=+57kJ⋅mol−1。在给定条件下,下列物质间所示的转化不能实现的是( )
A. B. NO2→H2OHNO3
C. D.
7. NH3、NH4Cl、NO、NO2、HNO3等是氮重要的化合物,NO2与N2O4能相互转化,热化学方程式为N2O4(g)⇌2NO2(g)△H=+57kJ⋅mol−1。对于反应N2O4(g)⇌2NO2(g)△H=+57kJ⋅mol−1,下列有关说法正确的是( )
A. 升高体系温度正反应速率增大,逆反应速率减小
B. 若容器体积不变,密度不变时说明该反应建立化学平衡
C. 其它条件不变,向平衡后的容器中再加入少量N2O4,新平衡后c2(NO2)c(N2O4)的值不变
D. 增大体系的压强能提高N2O4的反应速率和平衡转化率
8. 黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量FeO、Fe2O3)生产硝酸铜溶液的流程如图:
下列说法不正确的是( )
A. “浸取”时适当提高硫酸浓度可加快反应速率
B. 若反应中所加Zn过量,所得Cu(NO3)2溶液中含Zn(NO3)2杂质
C. 滤液Ⅱ一定含Zn2+、Fe2+、Fe3+、SO42−等离子
D. Cu(NO3)2溶液在稀硝酸中蒸发浓缩、冷却结晶、过滤得到Cu(NO3)2⋅3H2O
9. 由化合物X、Y为起始原料可合成药物Z.下列说法正确的是( )
A. X分子中所有碳原子可处于同一平面
B. X、Z分子中均含有2个手性碳原子
C. 1molZ最多只能与2molBr2发生反应
D. X、Y、Z均可与NaOH稀溶液发生反应
10. MFC−电芬顿技术不需要外加能即可发生,通过产生羟基自由基(⋅OH)处理有机污染物,可获得高效的废水净化效果。其耦合系统原理示意图如图,下列说法不正确的是( )
A. 电子移动方向为a→Y,X→b
B. Y电极上得到双氧水的反应为O2+2e−+2H+=H2O2
C. 乙池可在酸性较弱的环境中使用
D. 理论上当乙池中产生1mol羟基自由基时,甲池中有2molH+从M室移动到N室
11. 二甲醚催化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)=CH3COOCH3(g)△H1=akJ⋅mol−1
反应Ⅱ:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g)△H2=bkJ⋅mol−1
反应Ⅰ、Ⅱ的平衡常数的对数lgK1、lgK2与温度的关系如图−1所示;固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图−2所示。下列说法正确的是( )
A. a>0
B. 测得X点CH3CH2OH的物质的量分数是10%,则X点反应Ⅱ有:
C. 由CH3COOCH3的曲线知,600K后升高温度对反应Ⅰ的影响程度大于反应Ⅱ
D. 曲线B表示H2的物质的量分数随温度的变化
12. [Cu(OH)(NH3)]+是汽车尾气脱硝的催化剂,其催化机理如图所示,下列说法错误的是( )
A. [Cu(OH)(NH3)]+中O和N原子是配位原子
B. 该催化循环中Cu的成键数目发生了变化
C. 反应过程中存在非极性键的断裂和形成
D. 总反应的化学方程式为:4NH3+2NO+2O2−[Cu(OH)(NH3)]+3N2+6H2O
13. CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如图:
(1)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为 ______。
②当n(Na2SO3):n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是 ______。
③当1.0
(3)为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液bmL,反应中Cr2O72−被还原为Cr3+,求样品中CuCl的质量分数 ______(写计算过程)。
14. 吉非替尼是一种合成的苯胺喹唑啉类化合物,是肺癌治疗的一线用药,良好的药效和广阔的市场前景引起很多学者兴趣,其中一种合成路线如下图所示:
已知:
(1)化合物Ⅱ的结构简式为 ______,反应①、③的反应类型分别为 ______。
(2)化合物Ⅲ中含氧官能团除酯基之外还有 ______(写名称)。
(3)反应②的化学方程式为 ______。
(4)化合物是比有机物Ⅰ相对分子质量大14的同系物。化合物的芳香族同分异构体中,同时满足如下条件的有 ______种,写出其中任意一种的结构简式:______。
a.能发生银镜反应
b.能发生水解反应
c.1mol该有机物能够与3molNaOH溶液反应
d.核磁共振氢谱图确定分子中氢原子数之比为1:1:2:2:6
(5)根据上述信息,写出以、和CH3OH为原料(无机试剂任选),合成的路线:______。
15. 高纯碳酸锰(MnCO3)是制备Mn2O3、MnO2等锰的氧化物的重要原料。实验室模拟工业用软锰矿(主要成分MnO2,杂质金属元素Fe、Al)的水悬浊液吸收烟气中SO2,制取高纯MnCO3的流程如图:
(1)吸收过程在题图1所示装置中进行,用混有SO2的空气模拟烟气。反应过程中,为使SO2尽可能转化完全,在SO2和空气比例一定、水浴温度一定、不改变固液投料并充分搅拌的情况下,还可采取的合理措施有 ______(任写一种)。烧瓶中发生的主要反应的化学方程式为:______。
(2)实验测得吸收液中Mn2+、SO42−的物质的量浓度随时间变化的关系如图2所示。
①导致吸收液中SO42−的物质的量浓度大于Mn2+的原因是 ______。
②2h后,吸收液中SO42−的物质的量浓度增大速率加快的原因是 ______。验证的实验方法是 ______。
(3)将三颈烧瓶中的混合物过滤测得滤液中c(Mn2+)=1.0mol⋅L−1,还含有Fe3+和Al3+。常温下,由100mL该滤液制取高纯MnCO3的实验方案为:向溶液中边搅拌边滴加1.0mol⋅L−1NaOH溶液,______,干燥,得高纯MnCO3固体。[实验中必须选择的试剂有1.0mol⋅L−1BaCl2溶液、1.0mol⋅L−1NaHCO3溶液、无水乙醇]
已知:难溶于水和乙醇,在潮湿条件下易被氧化;
常温Ksp[Al(OH)3]=10−32.9,Ksp[Fe(OH)3]=10−37.4,Ksp[Mn(OH)2]=10−12.8。当溶液中金属离子的浓度小于1×10−5mol⋅L−1时认为沉淀完全;
加NaOH溶液调节pH过程中溶液总体积变化忽略不计.
与HCO3−反应生成MnCO3和CO2气体
SO2、NOx是空气的主要污染物,有效去除大气中的SO2、NOx可以保护大气环境。含氮废水氨氮(以NH3、NH4+存在)和硝态氮(以NO2−、NO3−存在)引起水体富营养化,需经处理后才能排放。
(1)用天然碱生产小苏打的母液(主要溶质为碳酸钠)吸收烟气中SO2的相关反应的热化学方程式如下:
2Na2CO3(aq)+SO2(g)+H2O(l)=Na2SO3(aq)+2NaHCO3(aq)ΔH=akJ⋅mol−1
2NaHCO3(aq)+SO2(g)=Na2SO3(aq)+2CO2(g)+H2O(l)ΔH=bkJ⋅mol−1
Na2SO3(aq)+SO2(g)+H2O(l)=2NaHSO3(aq)ΔH=ckJ⋅mol−1
反应Na2CO3(aq)+SO2(g)=Na2SO3(aq)+CO2(g)的ΔH=______kJ⋅mol−1。
(2)工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图1所示,写出电解时铁电极发生的电极反应式:①______。随后,铁电极附近有无色气体产生,写出有关反应的离子方程式:②______。
(3)工业上以钛基氧化物涂层材料为阳极、碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使NO3−,变为NH4+。电极(电催化剂)所处的环境对其催化活性起重要作用。其他条件不变,向其中一份电解液中投加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低。可能原因是①______。其他条件不变,只改变溶液的pH,NO3−去除率如图2所示,pH升高时,去除率②______(“升高”或“下降”),可能原因是③______。
(4)厌氧氨化法(Anammox)是一种新型的氨氮去除技术,反应模型如图所示。氨氮去除过程总的离子方程式为:______。答案和解析
1.【答案】D
【解析】解:A.氙气(Xe)属于稀有气体,故A正确;
B.氮化硼陶瓷有耐高温、硬度大、耐磨损、密度小等优点,属于新型无机非金属材料,故B正确;
C.聚氯乙烯属于有机高分子材料,故C正确;
D.空间站太阳能电池板的主要材料是硅,属于单质,不属于硅酸盐,故D错误;
故选:D。
A.氦、氖、氩、氪、氙均为稀有气体;
B.氮化硼陶瓷有N和Si组成,属于非金属组成的材料;
C.聚氯乙烯的单体为氯乙烯,可以人工合成高分子材料;
D.太阳能电池板的主要材料是硅,属于单质。
本题考查物质的应用,难度不大,熟悉常见的物质及其物理性质即可解答,注意日常学习中的积累。
2.【答案】C
【解析】解:A.N2分子中2个N原子通过三个共价键结合,结构式是N≡N,在这三个共价键中,其中有1个是σ键,2个是π键,故A正确;
B.CO2分子中C原子与2个O原子形成4对共用电子对,使分子中各原子都达到最外层8个电子的稳定结构,其电子式为:,故B正确;
C.H2O分子中中心O原子价层电子对数为2+6−1×22=4,O原子采用sp3杂化,O原子上含有2对孤电子对,所以H2O分子是V形分子,由于分子中正负电荷重心不重合,因此H2O是极性分子,故C错误;
D.中子数为8的碳原子的质量数是6+8=14,根据在原子表示中,元素符号左下角为质子数,左上角为质量数,可知该原子可表示为: 614C,故D正确;
故选:C。
A.N2分子中2个N原子通过三个共价键结合,结构式是N≡N,在这三个共价键中,其中有1个是σ键,2个是π键;
B.CO2分子中C原子与2个O原子形成4对共用电子对,使分子中各原子都达到最外层8个电子的稳定结构;
C.H2O分子中中心O原子价层电子对数为2+6−1×22=4,O原子采用sp3杂化,O原子上含有2对孤电子对,所以H2O分子是V形分子;
D.中子数为8的碳原子的质量数是6+8=14。
本题考查物质的结构和转化,题目难度中等,掌握常见物质的结构和相关的氧化还原知识是解题的关键。
3.【答案】A
【解析】解:A.小苏打能够与盐酸反应,消耗盐酸,所以可以用于治疗胃酸过多,故A错误;
B.Al2O3熔点高,所以可用作耐高温材料,故B正确;
C.过氧化钠与二氧化碳反应可生成氧气,可用作呼吸面具供氧剂,故C正确;
D.漂白粉中次氯酸钙具有强的氧化性,能够使蛋白质变性,可用于杀菌消毒,用于生活用水的消毒,故D正确;
故选:A。
A.小苏打能够与盐酸反应,消耗盐酸;
B.耐高温材料一般具有较高的熔点;
C.过氧化钠与二氧化碳反应可生成氧气;
D.漂白粉中次氯酸钙具有强的氧化性,能够使蛋白质变性。
本题综合考查物质的组成和性质,为高频考点,题目侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,题目难度不大。
4.【答案】C
【解析】解:W、X、Y、Z分别是O、F、Mg、S元素;
A.W、Z分别是O、S元素,O没有+6价,S有+6价,故A错误;
B.W、X的原子含有2个电子层,Y、Z的原子含有3个电子层,原子序数:W
C.MgSO4中镁离子和硫酸根离子之间存在离子键、硫酸根离子中O、S原子之间存在共价键,故C正确;
D.元素吸引电子能力越强,其电负性越大,电负性:F>O>S,即X>W>Z,故D错误;
故选:C。
原子序数依次增大的短周期主族元素W、X、Y、Z,W、Z同主族,且Z的原子序数是W的2倍,则W为O,Z为S;X的氢化物可用于蚀刻玻璃,则X为F元素;Y与Z最外层电子数之和等于8,Y的最外层电子数为8−6=2,Z的原子序数大于Y,则Y为Mg元素,则W、X、Y、Z分别是O、F、Mg、S元素;
A.W、Z分别是O、S元素,O没有+6价;
B.电子层数越多,原子半径越大,同一周期元素,原子半径随着原子序数增大而减小
C.MgSO4中阴阳离子之间存在离子键、酸根离子中存在共价键;
D.元素吸引电子能力越强,其电负性越大。
本题考查原子结构与元素周期律的应用,为高频考点,把握有主族序数、物质性质来推断元素为解答关键,注意掌握元素周期律内容及常见元素化合物性质,试题侧重考查学生的分析与应用能力,题目难度不大。
5.【答案】B
【解析】解:A.Cu与浓硝酸反应生成二氧化氮,图中固液不加热装置可制备二氧化氮,故A正确;
B.二氧化氮的密度比空气密度大,应长导管进气收集,故B错误;
C.二氧化氮与NaOH溶液反应,图中装置可吸收尾气,故C正确;
D.二氧化氮与氧气、水反应生成硝酸,可使NO2充分转化为HNO3,故D正确;
故选:B。
A.Cu与浓硝酸反应生成二氧化氮;
B.二氧化氮的密度比空气密度大;
C.二氧化氮与NaOH溶液反应;
D.二氧化氮与氧气、水反应生成硝酸。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备、尾气处理、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
6.【答案】C
【解析】解:A.氨气和二氧化氮发生归中反应生成氮气,故,可以实现转化,故A正确;
B.二氧化氮和水反应生成硝酸和NO,可以实现转化,故B正确;
C.NO是不成盐氧化物,与NaOH不发生反应,故不能实现,故C错误;
D.NO和CO发生归中反应生成氮气,可以实现转化,故D正确;
故选:C。
A.氨气和二氧化氮发生归中反应生成氮气;
B.二氧化氮和水反应生成硝酸和NO;
C.NO是不成盐氧化物;
D.NO和CO发生归中反应生成氮气。
本题考查了氮元素化合物知识,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大。
7.【答案】C
【解析】解:A.升高体系温度,正逆反应速率均加快,故A错误;
B.反应前后气体总质量不变,容器容积不变,容器内气体的密度始终不变,故密度不变不能判断反应是否达到平衡状态,故B错误;
C.其它条件不变,向平衡后的容器中再加入少量N2O4,平衡正向移动,但新平衡后c2(NO2)c(N2O4)=K,温度不变,K值不变,故新平衡后c2(NO2)c(N2O4)的值不变,故C正确;
D.增大体系的压强,N2O4的反应速率加快,平衡逆向移动,N2O4的平衡转化率减小,故D错误;
故选:C。
A.升温,反应速率加快;
B.结合公式ρ=mV判断;
C.温度不变,平衡常数不变;
D.加压,反应速率加快,平衡向气体分子数减小的方向移动。
本题考查化学反应速率和化学平衡,题目难度中等,掌握外界条件改变对化学反应速率和化学平衡的影响是解题的关键。
8.【答案】C
【解析】解:A.“浸取”时适量增加硫酸的浓度,氢离子浓度增大,可加快化学反应速率,故A正确;
B.加Zn过量,会导致过滤所得的滤渣中有Zn,加硝酸溶解后会在硝酸铜中混有Zn(NO3)2杂质,故B正确;
C.铁离子的氧化性大于铜离子的氧化性,则Zn先与三价铁离子反应,再与铜离子反应,若将铜离子转化为铜单质,则三价铁离子一定完全反应,滤液Ⅱ中不存在Fe3+,故C错误;
D.硝酸易挥发,且加热促进铜离子水解,则Cu(NO3)2溶液在稀硝酸中蒸发浓缩、冷却结晶、过滤得到Cu(NO3)2⋅3H2O,故D正确;
故选:C。
由制备流程可知,黄铜灰渣加硫酸浸取,铜不与硫酸反应,Zn、CuO、ZnO及少量FeO、Fe2O3均与硫酸反应,过滤分离出滤渣I为Cu,滤液含硫酸锌、硫酸铜、硫酸亚铁、硫酸铁,滤液中加入适量的Zn将溶液中的铜置换出来,过滤得到铜单质,将两次过滤得到的铜单质溶于硝酸生成硝酸铜,滤液Ⅱ含硫酸锌、硫酸亚铁,以此来解答。
本题考查物质的制备实验,为高频考点,把握物质的性质、发生的反应、混合物的分离提纯为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
9.【答案】B
【解析】解:A.X含有饱和碳原子,具有甲烷的结构特征,则所有的碳原子不可能处于同一平面,故A错误;
B.连接4个不同的原子或原子团的碳原子为手性碳原子,X中六元环中连接支链的C为手性碳原子,Z中连接苯环和双键的碳原子为手性碳原子,则X、Z分子中均含有2个手性碳原子,故B正确;
C.Z中含有碳碳双键和酚羟基,可分别与溴发生加成反应、取代反应,则1molZ最多只能与3molBr2发生反应,故C错误;
D.X含有醇羟基,与氢氧化钠溶液不反应,故D错误。
故选:B。
A.X含有饱和碳原子,具有甲烷的结构特征;
B.X中六元环中连接支链的C为手性碳原子,Z中连接苯环和双键的碳原子为手性碳原子;
C.Z中含有碳碳双键和酚羟基,可分别与溴发生加成反应、取代反应;
D.X与氢氧化钠溶液不反应。
本题考查有机物的结构与性质,为高频考点,侧重考查学生的分析能力,把握有机物官能团与性质的关系为解答的关键,难点不大。
10.【答案】C
【解析】解:A.原电池和电解池工作时,电子由负极(a)经外电路流向阴极(Y),由阳极(X)经外电路回流到正极(b),故A正确;
B.Y极为阴极,电极反应式为O2+2e−+2H+=2H2O2,故B正确;
C.酸性较弱,Fe3+生成氢氧化铁沉淀,故C错误;
D.由反应Fe2++H2O2+H+=Fe3++⋅OH可知,当乙池中产生1mol羟基自由基时,消耗1mol过氧化氢,电路中转移2mol电子,由电荷守恒可知,甲池中有2molH+从M室移动到N室,故D正确;
故选:C。
由图可知,甲为燃料电池,b极氧元素价态降低得电子,电极反应式为O2+4e−+4H+=2H2O,a极为负极,乙为电解池,X极为阳极,Y极为阴极,电极反应式为O2+2e−+2H+=2H2O2,据此作答。
本题考查原电池原理和电解池原理,题目难度中等,能依据图象和题目信息准确判断正负极和阴阳极是解题的关键。
11.【答案】C
【解析】解:A.由图可知,温度升高,lgK1减小,则平衡常数K1减小,说明温度升高,平衡逆向移动,逆向吸热,正向放热,a<0,故A错误;
B.X点对应反应温度为400K,由图可知,X点乙醇物质的量分数小于平衡时乙醇的物质的量分数,说明此时反应未达平衡状态,反应正向进行,,故B错误;
C.由图1可知,反应Ⅰ和Ⅱ均为放热反应,升高温度,平衡均逆向移动,由图2可知,乙酸乙酯的降低速率大于甲醇的降低速率,600K后升高温度对反应Ⅰ的影响程度大于反应Ⅱ,故C正确;
D.B曲线随温度升高,物质的量分数升高,当温度高于600K时,反应Ⅱ几乎不发生,只考虑反应Ⅰ的情况下,温度升高,平衡逆向移动,一氧化碳或甲醚物质的量分数升高,故曲线B表示一氧化碳或甲醚的物质的量分数随温度的变化,故D错误;
故选:C。
A.K只受温度影响,由温度变化对K值影响判断反应吸放热;
B.X点未达平衡,温度不变,最终将达到平衡;
C.温度升高,平衡向吸热反应方向移动,由不同物质量的变化判断温度对反应的影响程度;
D.温度高于600K时,反应Ⅱ几乎不发生,反应Ⅰ平衡发生移动。
本题考查化学平衡,题目难度中等,掌握外界条件改变对平衡的影响是解题的关键。
12.【答案】D
【解析】解:A.[Cu(OH)(NH3)]+中Cu2+有空轨道,OH−和NH3中O和N原子上有孤电子对,O和N是配位原子,故A正确;
B.由图可知,在①、④中铜的成键数目为2,在③、⑤中铜的成键数目为3,在②中铜的成键数目为4,所以该催化循环中Cu的成键数目发生了变化,故B正确;
C.反应过程中有氧气参与反应,有氮气生成,故存在非极性健的断裂和形成,故C正确;
D.由图可知,该反应过程中,有反应物:NH3、NO、O2,有生成物:H2O、N2,且NH3、NO、O2物质的量分别为2mol、2mol、0.5mol,生成H2O、N2的物质的量分别为3mol、2mol,所以方程式为:4NH3+2NO+2O2−[Cu(OH)(NH3)]+4N2+6H2O,故D错误;
故选:D。
A.[Cu(OH)(NH3)]+中Cu2+有空轨道,OH−和NH3中O和N原子上有孤电子对;
B.由图可知,在①、④中铜的成键数目为2,在③、⑤中铜的成键数目为3,在②中铜的成键数目为4;
C.反应过程中有氧气参与反应,有氮气生成;
D.由图可知,该反应过程中,有反应物:NH3、NO、O2,有生成物:H2O、N2,且NH3、NO、O2物质的量分别为2mol、2mol、0.5mol,生成H2O、N2的物质的量分别为3mol、2mol。
本题考查了元素化合物的性质、反应机理的分析、化学键的变化等知识,为高频考点,侧重考查学生的读图获取信息能力、分析能力及灵活运用知识的能力,掌握氧化还原反应的分析方法,把握图中物质之间的转化以及元素化合价的变化是解题的关键,题目难度不大。
13.【答案】2Cu2++SO32−+2Cl−+H2O=2CuCl↓+SO42−+2H+ 随着n(Na2SO3):n(CuSO4)不断增大,溶液的碱性不断增强,Cu2+的水解程度增大 适当增大c(Cl−),有利于平衡Cu+(aq)+Cl−(aq)⇌CuCl(s)向生成CuCl方向移动 4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl59.7abm%
【解析】解:(1)①Na2SO3将Cu2+还原为Cu+,生成的Cu+和Cl−结合生成CuCl沉淀,离子方程式为2Cu2++SO32−+2Cl−+H2O=2CuCl↓+SO42−+2H+,
故答案为:2Cu2++SO32−+2Cl−+H2O=2CuCl↓+SO42−+2H+;
②Na2SO3溶液水解使溶液显碱性,随着n(Na2SO3):n(CuSO4)不断增大,溶液的碱性不断增强,Cu2+的水解程度增大,故当n(Na2SO3):n(CuSO4)>1.33时,比值越大CuCl产率越小,
故答案为:随着n(Na2SO3):n(CuSO4)不断增大,溶液的碱性不断增强,Cu2+的水解程度增大;
③当1.0
(2)根据题意,有水存在时,CuCl被O2氧化为Cu2(OH)3Cl,根据电子守恒可知CuCl和O2的系数比为4:1,再结合元素守恒可得化学方程式为4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl,
故答案为:4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl;
(3)根据电子转移守恒可得关系式:6CuCl∼6Fe2+∼Cr2O72−,则n(CuCl)=6n(K2Cr2O7)=b×10−3L×amol/L×6=6ab×10−3mol,CuCl的质量分数=6ab×10−3mol×99.5g⋅mol−1mg×100%=59.7abm%,
故答案为:59.7abm%。
海绵铜(Cu和少量CuO等)用硫酸、硝酸钠、水浸取,酸性环境中Cu被NO3−氧化,过滤,除去不溶性滤渣,得到含有CuSO4的滤液,加入亚硫酸钠将Cu2+还原为Cu+,加入NaCl得到CuCl沉淀,过滤得到CuCl的粗产品,用pH=2的H2SO4水洗,再用“醇洗”快速去除滤渣表面的水,防止潮湿环境中滤渣被空气氧化,干燥得到纯净的CuCl。
本题考查了物质制备流程和方案的分析判断,涉及氧化还原反应、物质性质,实验设计等,把握试验流程分析是解题关键,需要学生有扎实的基础知识,综合性强,题目难度中等。
14.【答案】 还原反应、取代反应 硝基、醚键 4 或或或
【解析】解:(1)由流程步骤可知,此步发生了硝化反应,对比有机物Ⅰ和Ⅲ的结构,可知第一步是取代反应,结合有机物Ⅱ的分子式确定其结构简式为;反应①硝基转变成氨基,为还原反应;反应③为取代反应,
故答案为:;还原反应、取代反应;
(2)化合物Ⅲ中含氧官能团除酯基之外还有硝基、醚键,
故答案为:硝基、醚键;
(3)分析反应②中的断键情况,其中氨基和中的酯基发生取代反应,同时生成一分子CH3OH,而醛基中的氧原子和酯基邻位氨基中的氢原子形成一分子H2O,故反应为,
故答案为:;
是比有机物Ⅰ相对分子量多14的同系物,由此确定其分子式为C10H12O4,既能发生银镜反应又能发生水解反应,除苯环外只有一个不饱和度,确定其具有甲酸某酯结构,能与3moLNaOH溶液反应,结合核磁共振氢谱图中氢原子数之比为1:1:2:2:6,可以确定甲酸某酯结构不能直接连在苯环上,联系芳香化合物的高对称结构和氢归宿确定同分异构体的结构有4种,分别为、、、,
故答案为:4;或或或;
(5)被酸性高锰酸钾氧化为,和甲醇发生取代反应生成,发生硝化反应生成,和Na2S2O3发生还原反应生成,和反应生成可以确定合成流程为,
故答案为:。
由流程步骤可知,此步发生了硝化反应,对比有机物Ⅰ和Ⅲ的结构,可知第一步是取代反应,结合有机物Ⅱ的分子式确定其结构简式为,有机物Ⅱ和HNO3发生取代反应生成III,有机物III发生反应①使硝基转变成氨基生成,发生反应③生成,再经过一系列反应可以得到目标产物,以此解答;
(5)被酸性高锰酸钾氧化为,和甲醇发生取代反应生成,发生硝化反应生成,和Na2S2O3发生还原反应生成,和反应生成。
本题考查有机物的推断与合成,为高考常见题型,侧重考查学生的分析能力,明确合成路线中各物质的推断是解答本题的关键,注意碳链骨架、官能团的变化、反应条件与反应类型的关系即可解答,题目难度中等。
15.【答案】减慢模拟烟气的通入速率 H2O+SO2=H2SO3、MnO2+H2SO3=H2SO4+H2O部分SO2(或H2SO3)在溶液中被氧气氧化生成SO42− Mn2+对氧气氧化SO2(或H2SO3)具有催化作用 取体积相等的蒸馏水和MnCl2溶液,控制其他条件相同,向两份溶液中同时通入含SO2的空气模拟烟气,相同时间后测定溶液中SO42−的物质的量浓度 同时不断测定溶液pH,当4.7
【解析】解:(1)依据外界条件对反应速率的影响可判断,反应过程中,为使SO2尽可能转化完全,在SO2和空气比例一定、水浴温度一定、不改变固液投料并充分搅拌的情况下,还可采取的合理措施有减慢模拟烟气的通入速率;SO2和水反应,生成亚硫酸,亚硫酸和MnO2发生反应,Mn元素化合价降低,硫元素化合价升高,则烧瓶中发生的主要反应的化学方程式为:H2O+SO2=H2SO3、MnO2+H2SO3=H2SO4+H2O,
故答案为:减慢模拟烟气的通入速率;H2O+SO2=H2SO3、MnO2+H2SO3=H2SO4+H2O;
(2)①由于部分SO2(或H2SO3)在溶液中被氧气氧化生成SO42−,因此导致吸收液中SO42−的物质的量浓度大于Mn2+的,
故答案为:部分SO2(或H2SO3)在溶液中被氧气氧化生成SO42−;
②由于反应中有锰离子生成,Mn2+对氧气氧化SO2(或H2SO3)具有催化作用,因此2h后,吸收液中SO42−的物质的量浓度增大速率加快的原因是Mn2+对氧气氧化SO2(或H2SO3)具有催化作用;验证的实验方法是取体积相等的蒸馏水和MnCl2溶液,控制其他条件相同,向两份溶液中同时通入含SO2的空气模拟烟气,相同时间后测定溶液中SO42−的物质的量浓度,
故答案为:Mn2+对氧气氧化SO2(或H2SO3)具有催化作用;取体积相等的蒸馏水和MnCl2溶液,控制其他条件相同,向两份溶液中同时通入含SO2的空气模拟烟气,相同时间后测定溶液中SO42−的物质的量浓度;
(3)将三颈烧瓶中的混合物过滤,测得滤液中c(Mn2+)=1.0mol⋅L−1,还含有Fe3+和Al3+,根据溶度积常数可知生成氢氧化锰沉淀时氢氧根的浓度是10−6.4mol/L,为防止生成氢氧化锰沉淀,溶液的pH不能超过7.6,又因为还需要除去铁离子和铝离子,根据溶度积常数可知二者完全沉淀时需要的pH分别是4.7、3.2,因此以及已知信息可知常温下,由100mL该滤液制取高纯MnCO3的实验方案为:向溶液中边搅拌边滴加1.0mol⋅L−1 NaOH溶液,同时不断测定溶液pH,当4.7
(2)①部分SO2(或H2SO3)在溶液中被氧气氧化生成SO42−;
②由于反应中有锰离子生成,Mn2+对氧气氧化SO2(或H2SO3)具有催化作用;取体积相等的蒸馏水和MnCl2溶液,控制其他条件相同,向两份溶液中同时通入含SO2的空气模拟烟气;
(3)滤液中c(Mn2+)=1.0mol⋅L−1,还含有Fe3+和Al3+,根据溶度积常数可知生成氢氧化锰沉淀时氢氧根的浓度是10−6.4mol/L,为防止生成氢氧化锰沉淀,溶液的pH不能超过7.6,又因为还需要除去铁离子和铝离子,根据溶度积常数可知二者完全沉淀时需要的pH分别是4.7、3.2,因此以及已知信息可知常温下,由100mL该滤液制取高纯MnCO3的实验方案为:向溶液中边搅拌边滴加1.0mol⋅L−1 NaOH溶液,同时不断测定溶液pH,当4.7
16.【答案】(a+b)2 Fe−2e−=Fe2+ 2NO2−+8H++6Fe2+=N2↑+6Fe3++4H2O水中的氯离子在阳极上被氧化成氯气,氯气与铵离子发生氧化反应生成N2,从而使铵离子从水溶液中得到去除 下降 随着pH的升高,催化剂的催化活性明显下降 NH4++NO2−=N2↑+2H2O
【解析】解:(1)①2Na2CO3(aq)+SO2(g)+H2O(l)=Na2SO3(aq)+2NaHCO3(aq)△H=akJ⋅mol−1
②2NaHCO3(aq)+SO2(g)=Na2SO3(aq)+2CO2(g)+H2O(l)△H=bkJ⋅mol−1
③Na2SO3(aq)+SO2(g)+H2O(l)=2NaHSO3(aq)△H=ckJ⋅mol−1
根据盖斯定律,(①+②)×12可得:Na2CO3(aq)+SO2(g)=Na2SO3(aq)+CO2(g),故△H=(a+b)2mol/L,
故答案为:(a+b)2;
(2)①阳离子由左室移向右室,则左室为阳极室,右室为阴极室,阳极是Fe放电生成Fe2+,电极反应为:Fe−2e−=Fe2+;②铁电极附近有无色气体产生,电解治理亚硝酸盐对水体的污染,应是亚铁离子还原亚硝酸根离子生成氮气的反应,离子方程式为:2NO2−+8H++6Fe2+=N2↑+6Fe3++4H2O,
故答案为:Fe−2e−=Fe2+;2NO2−+8H++6Fe2+=N2↑+6Fe3++4H2O;
(3)①其他条件不变,向其中一份电解液中投加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低,可能原因是:水中的氯离子在阳极上被氧化成氯气,氯气与铵离子发生氧化反应生成N2,从而使铵离子从水溶液中得到去除;②由图象可知,溶液pH越大,硝酸根离子的去除率下降;③可能原因是:随着pH的升高,催化剂的催化活性明显下降,
故答案为:水中的氯离子在阳极上被氧化成氯气,氯气与铵离子发生氧化反应生成N2,从而使铵离子从水溶液中得到去除;下降;随着pH的升高,催化剂的催化活性明显下降;
(4)整个过程是NO2−与NH4+反应生成N2和H2O,总的反应方程式为NH4++NO2−=N2↑+2H2O,
故答案为:NH4++NO2−=N2↑+2H2O。
(1)①2Na2CO3(aq)+SO2(g)+H2O(l)=Na2SO3(aq)+2NaHCO3(aq)△H=akJ⋅mol−1
②2NaHCO3(aq)+SO2(g)=Na2SO3(aq)+2CO2(g)+H2O(l)△H=bkJ⋅mol−1
③Na2SO3(aq)+SO2(g)+H2O(l)=2NaHSO3(aq)△H=ckJ⋅mol−1
根据盖斯定律,(①+②)×12可得:Na2CO3(aq)+SO2(g)=Na2SO3(aq)+CO2(g);
(2)①阳离子由左室移向右室,则左室为阳极室,右室为阴极室,阳极是Fe放电生成Fe2+;②铁电极附近有无色气体产生,电解治理亚硝酸盐对水体的污染,应是亚铁离子还原亚硝酸根离子生成氮气的反应;
(3)①其他条件不变,向其中一份电解液中投加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低,说明氯离子在阳极失电子发生氧化反应生成氯气具有氧化性,氧化铵根离子生成无毒气体氮气;②由图可知,溶液pH越大,硝酸根离子的去除率降低;③酸碱度影响催化剂的活性;
(4)整个过程是NO2−与NH4+反应生成N2和H2O。
本题考查比较综合,涉及运用盖斯定律计算反应热、电解原理应用、陌生方程式的书写、图象分析等,需要学生具备扎实的基础与灵活运用的能力。
15,江苏省徐州市第七中学2023-2024学年高一上学期9月月考化学试卷: 这是一份15,江苏省徐州市第七中学2023-2024学年高一上学期9月月考化学试卷,共8页。
全国高中学生化学竞赛(决赛)理论试题14版: 这是一份全国高中学生化学竞赛(决赛)理论试题14版,共7页。
安徽省宣城市泾县重点中学2022-2023学年高一下学期竞赛选拔化学试题含解析: 这是一份安徽省宣城市泾县重点中学2022-2023学年高一下学期竞赛选拔化学试题含解析,共19页。试卷主要包含了单选题等内容,欢迎下载使用。












