

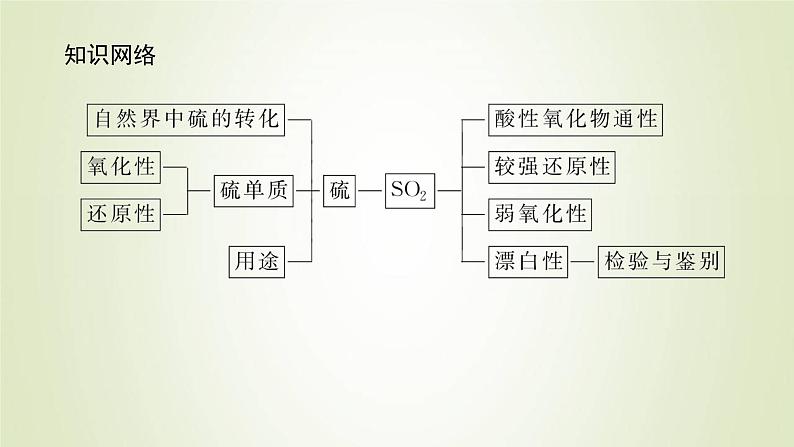



鲁科版 (2019)必修 第一册第2节 硫的转化备课课件ppt
展开这是一份鲁科版 (2019)必修 第一册第2节 硫的转化备课课件ppt,共48页。PPT课件主要包含了知识网络,学业基础,CaSO4·2H2O,单斜硫,正交硫,有刺激性气味,比空气大,易溶于水,化学性质1,恢复为红色等内容,欢迎下载使用。
学业要求1.根据生产、生活中的应用实例或通过实验探究,能从宏观和微观相结合的视角认识硫及其重要化合物的主要性质。2.能根据题给信息,明确探究实验的目的和原理,设计实验方案,进行实验探究,分析解决实验中出现的问题,得出正确的实验结论,逐步提升科学探究与创新意识。3.应用氧化还原反应原理和实验,研究硫及其重要化合物间的转化关系,培养证据推理与模型认知的意识。
一、自然界中的硫1.硫的存在
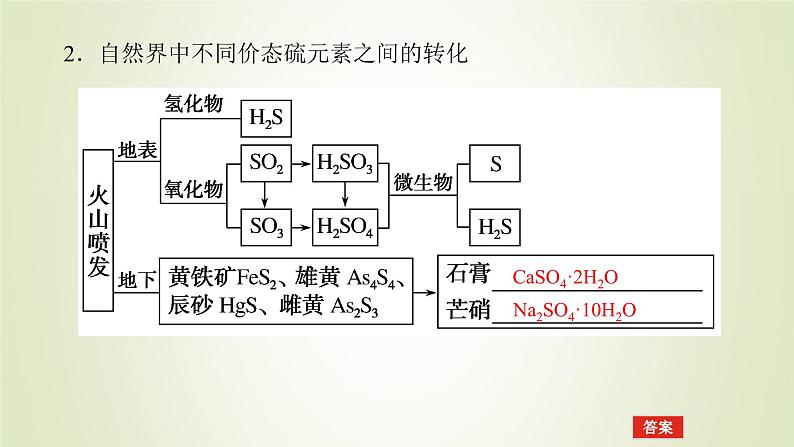
2.自然界中不同价态硫元素之间的转化
Na2SO4·10H2O
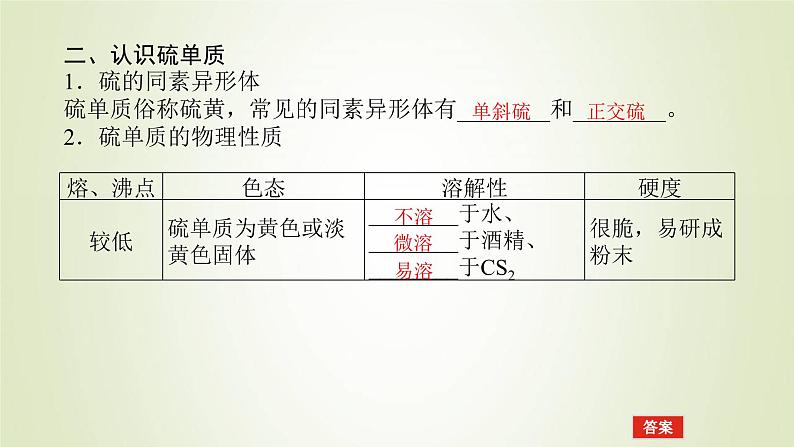
二、认识硫单质1.硫的同素异形体硫单质俗称硫黄,常见的同素异形体有________和________。2.硫单质的物理性质
3.硫单质的化学性质硫元素常见的价态有-2价、0价、+4价、+6价,硫单质由于处于中间价态而既有氧化性,又有还原性。(1)氧化性。与铁发生反应:Fe+S FeS(2)还原性。与氧气发生反应:S+O2 SO24.硫单质的用途硫单质可用于制硫酸、化肥、火柴、杀虫剂等。
三、二氧化硫1.物理性质
SO2+2H2S===3S↓+2H2O
2SO2+O2 2SO3
Cl2+SO2+2H2O===H2SO4+2HCl
(2)可逆反应:在相同条件下能同时向________________进行的反应称为可逆反应。在可逆反应的化学方程式中用“_____”代替“===”。
[即学即练]1.判断下列说法是否正确,正确的打“√”,错误的打“×”。(1)S在足量的纯氧气中充分燃烧生成SO3。( )(2)将SO2通入品红溶液中,溶液褪色,加热后无变化。( )(3)二氧化硫具有较强的还原性,故不能用浓硫酸干燥。( )(4)将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入CO2,产生沉淀。( )(5)SO2能使酸性KMnO4溶液褪色,体现了SO2的还原性。( )(6)潮湿的Cl2和SO2都具有漂白性,那么将二者混合时其漂白能力增强。( )(7)硫是一种淡黄色的能溶于水的晶体。( )(8)硫的化合物常存在于火山喷发的气体中和矿泉水中。( )
2.区别SO2与CO2可用的方法是( )A.品红溶液 B.澄清石灰水C.紫色石蕊溶液 D.BaCl2溶液
解析:SO2与CO2均属于酸性氧化物,可利用二氧化硫的漂白性、还原性来鉴别二者。二氧化硫使品红溶液褪色,而二氧化碳不能,故选项A正确;SO2和CO2均使石灰水变浑浊,不能区别,故选项B错误;SO2和CO2均使紫色石蕊溶液变红,不能区别,故选项C错误;SO2和CO2均不与氯化钡溶液反应,现象相同,不能区别,故选项D错误。
3.如图是研究二氧化硫性质的微型实验装置。现用60%的硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是( )A.紫色石蕊溶液先变红后褪色B.品红溶液褪色C.溴水橙色褪去D.含酚酞的NaOH溶液红色变浅
解析:二氧化硫能与水反应生成亚硫酸,亚硫酸显酸性,紫色石蕊溶液变红色不褪色,选项A错误;因为二氧化硫有漂白性,所以品红溶液褪色,选项B正确;因二氧化硫具有还原性,能与溴水发生反应:Br2+SO2 +2H2O===2HBr+H2SO4,所以溴水褪色,故选项C正确;因二氧化硫能与NaOH反应生成亚硫酸钠和水,溶液碱性减弱,所以溶液红色变浅,故D正确。
4.下列说法中,不正确的是( )A.硫是一种黄色、质脆的晶体B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.硫易燃烧,其燃烧产物是大气污染物之一D.硫与铁粉和铜粉分别反应,都可生成二价金属硫化物
解析:铜和硫反应生成+1价金属硫化物。
5.当我们查看葡萄酒标签上的成分信息时,常发现其成分中含有少量SO2。下列关于SO2说法正确的是( )A.SO2属于非法添加剂,不该添加到葡萄酒中B.SO2具有还原性,少量的SO2可防止葡萄酒氧化变质C.SO2具有还原性,不能用浓硫酸干燥D.SO2可以使酸性KMnO4溶液褪色,体现了它的漂白性
解析:葡萄酒中的少量SO2可以防腐、除杂,并有抗氧化的作用,少量SO2对人体是无害的,故A错误,B正确;SO2与H2SO4中硫元素的化合价分别是+4价和+6价,属于相邻价态,它们之间不会发生氧化还原反应,故C错误;SO2使酸性KMnO4溶液褪色显示的是它的还原性,故D错误。
6.绿矾在高温下易分解,用如图所示装置检验绿矾的分解产物(加热装置已略去)。绿矾分解反应的化学方程式为2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O。已知二氧化硫的沸点为-10 ℃,三氧化硫的沸点为44.8 ℃,b为干燥的试管。下列有关说法不正确的是( )A.SO2是还原产物,Fe2O3是氧化产物B.b中所得到的溶液中硫酸的质量分数理论上为29.5%C.将反应后的气体通入氯化钡溶液中,产生的沉淀为BaSO3、BaSO4D.将反应后的气体通入足量硝酸钡溶液中,产生的沉淀只有BaSO4
一 SO2和CO2性质的比较[例1] 如图是检验某无色气体A是SO2和CO2的混合气体的装置图,按要求回答下列问题:(1)装置B中加入的试剂是________,作用是___________________。(2)装置C中加入的试剂是______________,作用是_________________________。(3)装置D中加入的试剂是__________,作用是________________。(4)实验时,装置C中应观察到的现象是________________________________________。
除去SO2并检验SO2是否除尽
酸性KMnO4溶液的颜色变浅但不褪成无色
解析:检验SO2用品红溶液,吸收SO2用酸性KMnO4溶液,检验CO2用澄清石灰水。在检验CO2之前,必须除尽SO2,因为SO2也能使澄清石灰水变浑浊。装置C的作用是除去SO2并检验SO2是否除尽,所以酸性KMnO4溶液颜色变浅,但不能褪成无色,若褪成无色则不能证明二氧化硫已除尽。
状元随笔 (1)若仅是除去CO2中混有的SO2可用饱和NaHCO3溶液:SO2+NaHCO3===NaHSO3+CO2。(2)CO2的存在不影响SO2的检验,但SO2的存在会影响CO2的检验(使澄清石灰水变浑浊),须先除去(用溴水或酸性KMnO4溶液,品红溶液可用于检验SO2,但一般不用于除SO2)。
[提升1] 某化学兴趣小组为了探究常温下某未知气体的成分,将该气体通入澄清石灰水中,发现澄清石灰水变浑浊,持续通入,发现浑浊又变澄清。由此该小组同学对气体的成分提出猜想。【提出猜想】猜想1:________________;猜想2:________________;猜想3:________________。为了验证猜想,该小组同学设计如下实验进行探究。
气体含有CO2和SO2
【实验探究】该小组同学按如图所示连接装置,将气体从a端通入。
(1)B中盛放的溶液应该是________(填字母)。a.NaCl溶液 b.酸性KMnO4溶液c.盐酸 d.澄清石灰水(2)A中品红溶液的作用是__________________________。(3)D中澄清石灰水的作用是__________________________。通过以上实验,该小组同学观察到以下实验现象:①A中品红溶液褪色;②C中品红溶液不褪色;③D中澄清石灰水变浑浊。【得出结论】(4)由上述现象,该小组同学认为该气体________________。
检验该气体中是否含有SO2
检验该气体中是否含有CO2
解析:首先根据题给信息,分析可能涉及的物质,进行假设,本题中猜想气体可能含有SO2或CO2或二者都有;然后分析题目涉及物质的化学性质,如SO2和CO2性质的异同点;最后根据题意对假设进行一一验证,最终得出正确结论。SO2和CO2在某些方面性质较相似,如都能使澄清石灰水变浑浊,若通入的气体过量,则浑浊又变澄清。但SO2具有还原性,能被强氧化剂氧化,且SO2可使品红溶液褪色,而CO2不具备这些性质,可利用性质差异检验CO2、SO2是否存在。
关键能力二氧化硫与二氧化碳性质比较1.SO2和CO2性质的比较
2.SO2和CO2分别与BaCl2(或CaCl2)溶液、Ba(NO3)2[或Ca(NO3)2]溶液反应的情况
3.SO2和CO2的鉴别与检验方法(1)SO2和CO2的鉴别方法①闻气味,前者有刺激性气味,后者无气味。②将SO2、CO2分别通入品红溶液中,前者能使品红溶液褪色,后者无明显现象。③将SO2、CO2分别通入少量酸性KMnO4溶液或少量新制氯水中,前者能使溶液颜色褪去,后者无明显现象(两种方法原理相同,均利用了SO2的还原性)。
④将SO2、CO2分别通入H2S溶液中,前者能使溶液中出现浑浊,后者无明显现象。(2)SO2、CO2共存时二者的检验方法因为CO2、SO2均可以与澄清石灰水反应生成白色沉淀,所以其混合气体采用下面方法检验:混合气体→品红溶液(溶液红色褪去,检验SO2的存在)→足量酸性KMnO4溶液(除去SO2)→品红溶液(溶液不褪色,确认SO2已被除尽)→澄清石灰水(溶液变浑浊,检验CO2的存在)。
二 常见漂白性物质的漂白原理[例2] 下列说法正确的是( )A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)溶液、石蕊溶液褪色B.能使品红溶液褪色的不一定是SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同D.等物质的量的SO2和Cl2通入溶液中后仍具有漂白能力
解析:SO2能使品红溶液褪色是因为SO2具有漂白性,使溴水、酸性KMnO4溶液褪色是因为SO2具有还原性,SO2不能使指示剂褪色,A错误;能使品红溶液褪色的物质很多,不仅仅是SO2,如一些强氧化性物质,B正确;这些漂白剂的漂白原理不都相同,SO2漂白属于化合型漂白,活性炭漂白属于吸附型漂白,漂白粉、Na2O2漂白属于氧化型漂白,C错误;等物质的量的SO2和Cl2在溶液中恰好反应生成H2SO4和HCl,失去漂白能力,D错误。
状元随笔常见漂白剂的漂白原理主要有三种:氧化型(利用物质的氧化性,发生化学变化)、化合型(与有色物质发生化合反应生成无色物质,发生化学变化)和吸附型(表面吸附,发生物理变化)。
[提升2] 下列有色溶液褪色原理相同的是( )①SO2使品红溶液褪色 ②Cl2使品红溶液褪色 ③将Na2O2加入含酚酞的水溶液中,溶液先变红后褪色 ④SO2使酸性KMnO4溶液褪色A.①② B.②④C.②③ D.①④
解析:①SO2与品红反应生成无色物质,体现其漂白性;②氯气和水反应生成的HClO具有强氧化性,能使品红溶液褪色;③Na2O2和水反应生成的NaOH显碱性,故溶液先变红,Na2O2与水反应的过程中可生成H2O2,H2O2具有强氧化性从而使溶液褪色;④SO2使酸性KMnO4溶液褪色,是因为发生了氧化还原反应5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4,与SO2的还原性有关;所以有色溶液褪色原理相同的是②③。
关键能力常见漂白性物质的比较1.常见漂白性物质的漂白原理分析
2.SO2和氯水的漂白性比较(1)原理比较
1.在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅或消失,则原溶液可能是( )①滴有石蕊的H2SO4溶液 ②滴有酚酞的氨水溶液 ③滴有酚酞的氢氧化钠溶液 ④滴有酚酞的饱和氢氧化钙溶液 ⑤溶有SO2的品红溶液A.②⑤ B.②④C.①③ D.②④⑤
解析:滴有石蕊的H2SO4溶液显示红色,加热以后,溶液颜色不变,故①不符合题意;滴有酚酞的氨水溶液显示红色,因为氨水显碱性,氨水受热容易挥发出氨气,导致碱性减弱,溶液颜色逐渐变浅,故②符合题意;滴有酚酞的氢氧化钠溶液显示红色,氢氧化钠受热不变化,加热后碱性几乎不变,溶液颜色不变,故③不符合题意;滴有酚酞的饱和氢氧化钙溶液显红色,加热后,氢氧化钙的溶解度随着温度的升高而降低,所以溶液碱性减弱,溶液颜色逐渐变浅,故④符合题意;二氧化硫有漂白性,能使品红溶液褪色,但加热后,SO2与品红结合生成的无色物质不稳定,发生分解反应又生成SO2,二氧化硫从溶液中逸出,品红溶液又显红色,故⑤不符合题意。
2.下列溶液中通入SO2一定不会产生沉淀的是( )A.Ba(OH)2 B.Ba(NO3)2C.Na2S D.BaCl2
3.将甲气体通入BaCl2溶液,未见沉淀生成,然后通入乙气体,有沉淀生成,则甲、乙气体不可能是( )A.SO2、H2S B.SO2、NO2C.NH3、CO2 D.CO2、SO2
解析:氯化钡溶液中通入二氧化硫不反应,再通入硫化氢,二氧化硫和硫化氢反应生成单质硫沉淀,A不符合题意;氯化钡溶液中通入二氧化硫不反应,再通入二氧化氮,二氧化氮和水反应生成硝酸,可以氧化二氧化硫生成硫酸根离子,硫酸根再与氯化钡反应生成硫酸钡沉淀,B不符合题意;氯化钡溶液中通入氨气不反应,再通入二氧化碳可以生成碳酸钡沉淀和氯化铵,C不符合题意;氯化钡溶液中通入二氧化碳和二氧化硫都不反应,不会出现沉淀,D项符合题意。
4.由SO2和O2制备SO3(熔点为16.8 ℃,沸点为44.8 ℃)的模拟装置如图所示(加热和夹持装置省略)。下列说法正确的是( )A.装置①中的试剂为饱和NaHSO3溶液B.实验室可用铜与稀硫酸在加热条件下反应制取SO2C.装置③反应管中的铂石棉用作反应的催化剂D.从装置⑤逸出的气体有过量的SO2和O2
解析:A项,进入高温反应管的气体必须干燥,①中的试剂应是浓硫酸,所以错误;B项,铜与稀硫酸不反应,所以错误;C项,SO2和O2反应需用催化剂催化,所以正确;D项,该反应是可逆反应,④中逸出的气体主要是SO2和O2及少量的SO3气体,则⑤中应盛放碱石灰,可除去SO2、SO3,所以错误。
5.(双选)将SO2分别通入下列各溶液中,下列有关说法正确的是( )A.试管a中实验可以证明SO2具有还原性B.试管b中溶液褪色,说明SO2具有强氧化性C.试管c中能产生白色沉淀,说明SO2具有还原性D.试管d中能产生白色沉淀,加入稀硝酸后沉淀完全溶解
6.亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀硫酸、NaOH溶液。(1)要证明Na2SO3具有还原性,应选用的试剂有_________________,看到的现象是__________________,反应的离子方程式为____________________________________。(2)要证明Na2SO3具有氧化性,应选用的试剂有__________________________,看到的现象是____________,反应的离子方程式为_________________________________。
溴水、Na2SO3溶液
稀硫酸、Na2SO3溶液、Na2S溶液
相关课件
这是一份高中化学鲁科版 (2019)必修 第一册第2节 硫的转化教案配套课件ppt,共60页。PPT课件主要包含了知识网络,学业基础,CaSO4·2H2O,②③④⑦⑧⑨⑩,3实验方案及实施,二氧化硫性质探究,核心素养,2应用举例,学考评价等内容,欢迎下载使用。
这是一份化学必修 第一册第3章 物质的性质与转化第2节 硫的转化习题课件ppt,文件包含鲁科版高中化学必修第一册第3章物质的性质与转化第2节硫的转化第2课时硫酸酸雨及其防治课件ppt、鲁科版高中化学必修第一册第3章物质的性质与转化第2节硫的转化第2课时硫酸酸雨及其防治课后习题含答案doc等2份课件配套教学资源,其中PPT共45页, 欢迎下载使用。
这是一份鲁科版 (2019)必修 第一册第2节 硫的转化习题课件ppt,文件包含鲁科版高中化学必修第一册第3章物质的性质与转化第2节硫的转化第1课时自然界中不同价态的硫元素及其之间的转化课件ppt、鲁科版高中化学必修第一册第3章物质的性质与转化第2节硫的转化第1课时自然界中不同价态的硫元素及其之间的转化课后习题含答案doc等2份课件配套教学资源,其中PPT共47页, 欢迎下载使用。













