

2022届高考化学一轮复习课后限时集训练习10金属材料铜与常见过渡金属含答案
展开1.(2020·豫北豫南联考)《天工开物》中记载:凡铜供世用,出山与出炉只有亦铜。以炉甘石或倭铅参合,转色为黄铜,以砒霜等药制炼为白铜,矾、硝等药制炼为青铜。其中涉及的物质中熔点最高的是( )
A.青铜 B.黄铜 C.赤铜 D.白铜
C [青铜(Cu—Sn合金),黄铜(Cu—Zn合金),赤铜为纯铜,白铜(Cu—Ni合金),纯铜比合金铜熔点高。]
2.明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定,毁罐取出……即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是( )
A.倭铅是指金属锌和铅的混合物
B.煤炭中起作用的主要成分是C
C.冶炼Zn的过程中发生氧化还原反应
D.该冶炼锌的方法属于热还原法
A [A项,由题意可知,倭铅是指金属锌,不是混合物;B项,反应中C作还原剂,则煤炭中起作用的主要成分是C;C项,碳酸锌与碳在高温下反应生成锌和一氧化碳,发生氧化还原反应;D项,该反应是利用碳还原碳酸锌生成锌单质,属于热还原法。]
3.(2020·通州区模拟)向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜。其反应过程如图所示。下列说法错误的是( )
A.Fe3+对该反应有催化作用
B.该过程中的Fe3+可由Fe(NO3)3提供
C.可用K3[Fe(CN)6]溶液区分Fe2+与Fe3+
D.制备CuCl2的总反应为2Cu+O2+4HCl===2CuCl2+2H2O
B [依据题图可知,Cu与Fe3+反应生成Fe2+和Cu2+,Fe2+与O2、HCl反应生成Fe3+与H2O,所以Fe3+作催化剂,故A正确;Fe(NO3)3溶液为强酸弱碱盐,NOeq \\al(-,3)酸性环境下能够氧化Cu,本身被还原为NO,NO会引起空气污染,故B错误;K3[Fe(CN)6]溶液遇到Fe2+反应生成蓝色沉淀,所以可以用K3[Fe(CN)6]溶液区分Fe3+与Fe2+,故C正确;依据题图可知,Cu与Fe3+反应生成Fe2+和Cu2+,Fe2+与O2、HCl反应生成Fe3+和H2O,将两步反应联立得2Cu+O2+4HCl===2CuCl2+2H2O,故D正确。]
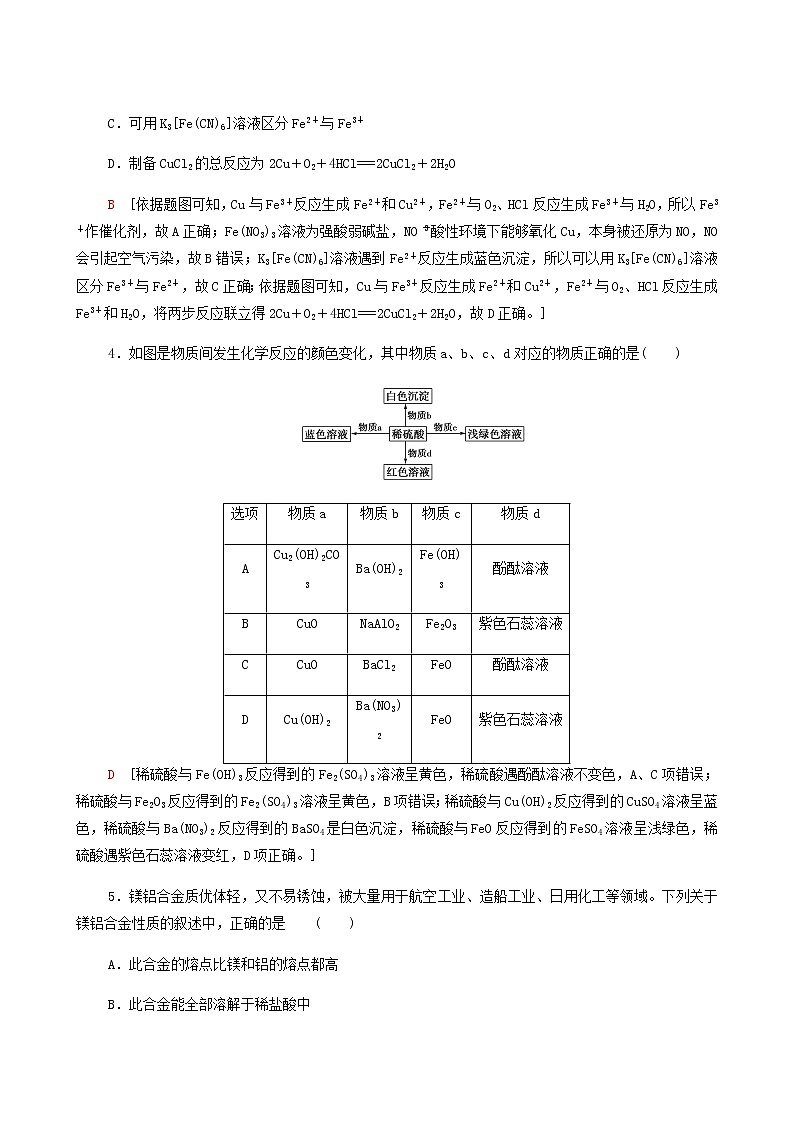
4.如图是物质间发生化学反应的颜色变化,其中物质a、b、c、d对应的物质正确的是( )
D [稀硫酸与Fe(OH)3反应得到的Fe2(SO4)3溶液呈黄色,稀硫酸遇酚酞溶液不变色,A、C项错误;稀硫酸与Fe2O3反应得到的Fe2(SO4)3溶液呈黄色,B项错误;稀硫酸与Cu(OH)2反应得到的CuSO4溶液呈蓝色,稀硫酸与Ba(NO3)2反应得到的BaSO4是白色沉淀,稀硫酸与FeO反应得到的FeSO4溶液呈浅绿色,稀硫酸遇紫色石蕊溶液变红,D项正确。]
5.镁铝合金质优体轻,又不易锈蚀,被大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金性质的叙述中,正确的是 ( )
A.此合金的熔点比镁和铝的熔点都高
B.此合金能全部溶解于稀盐酸中
C.此合金能全部溶解于氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都小
B [镁和铝都可以与盐酸反应,故镁铝合金能全部溶解于稀盐酸中。]
6.某同学利用下列实验探究金属铝与铜盐溶液的反应。下列说法正确的是( )
A.由实验1可以得出结论:金属铝的活泼性弱于金属铜
B.实验2中生成红色物质的离子方程式为Al+Cu2+===Al3++Cu
C.溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
D.由上述实验可推知:用砂纸打磨后的铝片分别与H+浓度均为0.2 ml·L-1的盐酸和硫酸溶液反应,后者更剧烈
C [A项,Al比Cu活泼,错误;B项,离子方程式电荷不守恒,错误;C项,比较实验1、实验2可知二者的不同之处为二者中分别含有SOeq \\al(2-,4)、Cl-,故二者现象不同是由于二者所含阴离子种类不同,正确;D项,由C项可知SOeq \\al(2-,4)能使反应速率变慢,故Al与盐酸反应剧烈,错误。]
7.(2020·长沙长郡中学一模)实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收Cu并制备ZnO的部分实验过程如图所示:
下列叙述错误的是 ( )
A.合理处理废弃旧电池的铜帽既有利于节约资源,又有利于保护环境
B.“溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
C.加入锌粉反应的离子为Cu2+
D.“过滤”操作后直接将溶液蒸发结晶、高温灼烧得到ZnO
D [过滤后所得溶液中含有Na2SO4等溶质,蒸发结晶得到的晶体不是Zn(OH)2,是ZnSO4和Na2SO4的混合物,不能得到纯净的ZnO,D项错误。]
8.(2020·荆州模拟)某同学对Cu的常见化合物的性质进行实验探究,探究的问题和过程如下:
(1)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1 000 ℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+1价Cu比+2价Cu更 (填“稳定”或“不稳定”)。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子方程式为 ,由此可知,在酸性溶液中,+1价Cu比+2价Cu更 (填“稳定”或“不稳定”)。
③向Cu2O中加适量稀硝酸,反应的离子方程式为
。
(2)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→ → → → → → →h。
①实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生反应的化学方程式为
。
②装置C中的球形装置的作用是 。
[答案] (1)①稳定 ②Cu2O+2H+===Cu2++Cu+H2O 不稳定
③3Cu2O+14H++2NOeq \\al(-,3)===6Cu2++2NO↑+7H2O
(2)g f b c d e(bc可互换)
①3CuO+2NH3eq \(=====,\s\up7(△))3Cu+N2+3H2O ②防倒吸
9.某同学通过如下流程制备氧化亚铜:
已知:CuCl难溶于水和稀硫酸;Cu2O+2H+===Cu2++Cu+H2O
下列说法不正确的是 ( )
A.步骤②中的SO2可用Na2SO3替换
B.步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C.步骤④发生反应的离子方程式为2CuCl+2OH-eq \(=====,\s\up7(△))Cu2O+2Cl-+H2O
D.如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度
D [试样用足量稀硫酸溶解后,得到的固体中有CuCl和Cu,无法计算其中Cu的质量,故无法计算试样纯度。]
10.(2019·全国卷Ⅲ)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 ml·L-1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和 ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式:
。
(2)“氧化”中添加适量的MnO2的作用是 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为 ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
。
(6)写出“沉锰”的离子方程式:
。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCyMnzO2,其中Ni、C、Mn的化合价分别为+2、+3、+4。当x=y=eq \f(1,3)时,z= 。
[解析] (1)硫化锰矿及二氧化锰粉末中加入硫酸后,发生氧化还原反应:MnO2+MnS+2H2SO4===2MnSO4+S+2H2O,故滤渣1的主要成分为S和SiO2(不溶性硅酸盐)。
(2)Fe2+沉淀完全时,Mn2+已经开始沉淀,故加入MnO2是为了将溶液中的Fe2+氧化为Fe3+,便于除去。
(3)除去Fe3+及Al3+,应使二者沉淀完全,故pH应大于4.7。
(4)锌和镍的硫化物都难溶于水,故“滤渣3”的主要成分为ZnS、NiS。
(5)“除杂1”步骤结束后,杂质金属阳离子只有Mg2+,加入MnF2形成MgF2沉淀而除去Mg2+,若溶液酸度过高,H+浓度偏大,则F-与H+结合形成HF,使MgF2沉淀溶解平衡正向移动而重新溶解。
(6)“沉锰”时加入NH4HCO3发生反应:Mn2++2HCOeq \\al(-,3)===MnCO3↓+CO2↑+H2O。
(7)根据化合物中各元素化合价代数和为0的原则,求得z=eq \f(1,3)。
[答案] (1)SiO2(不溶性硅酸盐) MnO2+MnS+2H2SO4===2MnSO4+S+2H2O (2)将Fe2+氧化为Fe3+ (3)4.7 (4)NiS和ZnS (5)F-与H+结合形成弱电解质HF,MgF2Mg2++2F-平衡向右移动 (6)Mn2++2HCOeq \\al(-,3)===MnCO3↓+CO2↑+H2O
(7)eq \f(1,3)
11.(2020·开封模拟)钠离子电池由于成本低、资源丰富,成为取代锂离子电池在大规模储能领域应用的理想选择。作为钠离子电池的正极材料之一,束状碳包覆K3V2(PO4)3纳米线电极材料成为关注焦点之一。其制备工艺流程如图:
【资料】
①石煤的主要成分为V2O3,含有Al2O3、CaO、Fe2O3等杂质。
②+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
(1)K3V2(PO4)3中V的化合价为 。
(2)焙烧时,向石煤中加生石灰,将V2O3转化为Ca(VO3)2。焙烧过程中主要反应的化学方程式为
。
(3)加入的草酸晶体是过量的,其中只有eq \f(1,3)的草酸为还原剂,将VOeq \\al(-,3)还原成VO2+,eq \f(2,3)的草酸以C2Oeq \\al(2-,4)的形式存在,此过程中反应的离子方程式为
。
(4)“氩气中煅烧”时,氩气的作用是 。
(5)某工厂利用上述工艺流程,用10 t石煤生产束状碳包覆K3V2(PO4)3纳米线0.8064 t,若整个过程中钒的总回收率为80%,则石煤中钒元素的质量分数为 。
[解析] 石煤的主要成分为V2O3,含有Al2O3、CaO、Fe2O3等杂质,在空气中焙烧,生成Ca(VO3)2,固体进行酸浸,生成Fe3+、Al3+、Ca2+、VOeq \\al(+,2)等,加入萃取剂将含VOeq \\al(+,2)的物质萃取,然后进行反萃取操作将含VOeq \\al(+,2)的物质提纯,向所得溶液中加入沉淀剂生成NH4VO3,NH4VO3与KOH、H3PO4反应后得到棕红色透明含VOeq \\al(-,3)溶液,然后向溶液中加入过量草酸晶体发生氧化还原反应,将VOeq \\al(-,3)还原成VO2+,然后进行干燥,将固体在氩气中煅烧制备束状碳包覆K3V2(PO4)3纳米线。
(3)只有eq \f(1,3)的草酸为还原剂,草酸被氧化为CO2,并将VOeq \\al(-,3)还原成VO2+,eq \f(2,3)的草酸以C2Oeq \\al(2-,4)的形式存在,根据氧化还原转移电子守恒、电荷守恒以及原子守恒可知该离子反应方程式为:2H++2VOeq \\al(-,3)+3H2C2O4·2H2O===2VO2++2C2Oeq \\al(2-,4)+2CO2↑+10H2O。
(5)根据V元素守恒可得
eq \f(10t×ω×80%,51)=eq \f(2×0.806 4 t,504),ω=2.04%。
[答案] (1)+3 (2)CaO+O2+V2O3eq \(=====,\s\up7(△))Ca(VO3)2
(3)2H++2VOeq \\al(-,3)+3H2C2O4·2H2O===2VO2++2C2Oeq \\al(2-,4)+2CO2↑+10H2O
(4)防止K2V2(PO4)3被氧化 (5)2.04%
选项
物质a
物质b
物质c
物质d
A
Cu2(OH)2CO3
Ba(OH)2
Fe(OH)3
酚酞溶液
B
CuO
NaAlO2
Fe2O3
紫色石蕊溶液
C
CuO
BaCl2
FeO
酚酞溶液
D
Cu(OH)2
Ba(NO3)2
FeO
紫色石蕊溶液
金属离子
Mn2+
Fe2+
Fe3+
Al3+
Mg2+
Zn2+
Ni2+
开始沉淀的pH
8.1
6.3
1.5
3.4
8.9
6.2
6.9
沉淀完全的pH
10.1
8.3
2.8
4.7
10.9
8.2
8.9
pH
4~6
6~8
主要离子
VOeq \\al(+,2)
VOeq \\al(-,3)
2023年高考化学一轮复习 考点16 铜及其金属材料 模拟测试: 这是一份2023年高考化学一轮复习 考点16 铜及其金属材料 模拟测试,文件包含2023年高考化学一轮复习考点16铜及其金属材料模拟测试原卷版2023年高考化学一轮复习docx、2023年高考化学一轮复习考点16铜及其金属材料模拟测试解析版2023年高考化学一轮复习docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
高考化学一轮复习课后限时集训29生活中常见的有机物含答案: 这是一份高考化学一轮复习课后限时集训29生活中常见的有机物含答案,共8页。试卷主要包含了下列说法错误的是等内容,欢迎下载使用。
高考化学一轮复习课后限时集训20电解池金属的腐蚀与防护含答案: 这是一份高考化学一轮复习课后限时集训20电解池金属的腐蚀与防护含答案,共9页。












