
2022年湖北省武汉市中考化学模拟试题(三)(word版含答案)
展开一、选择题:本题共8小题,每小题3分,共24分。在每小题给出的四个选项中,只有一项是符合题目要求的。
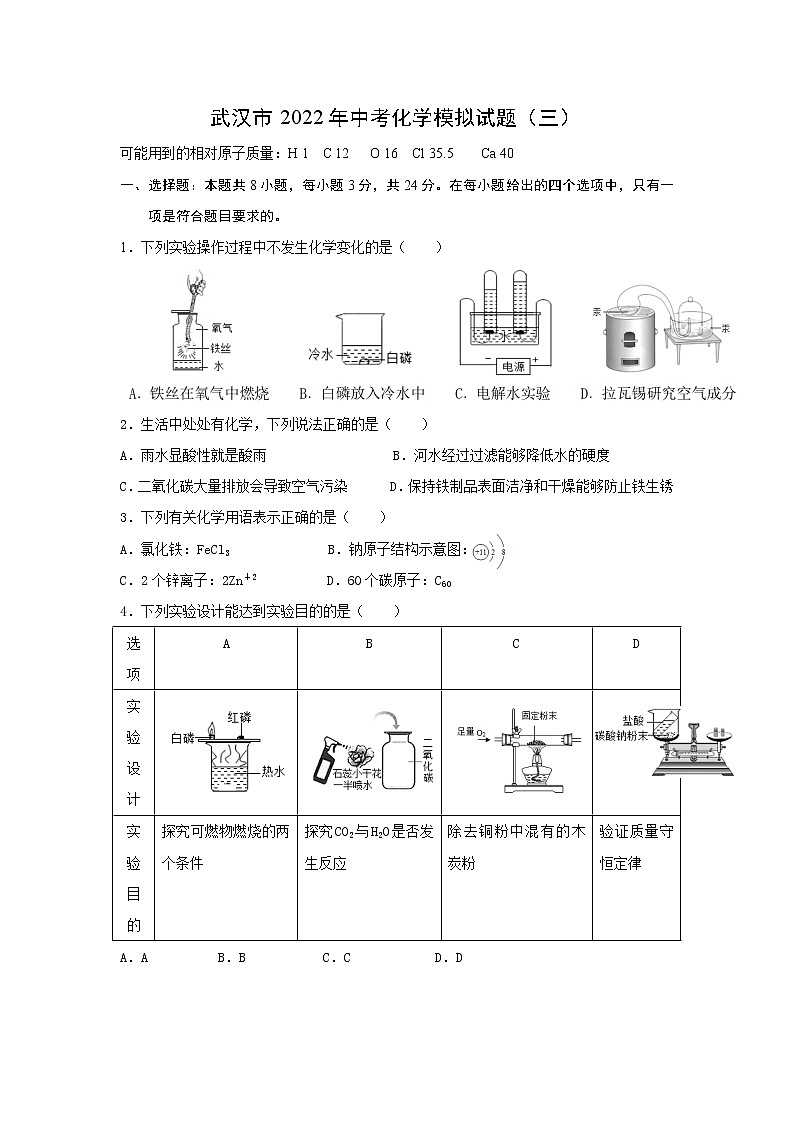
1.下列实验操作过程中不发生化学变化的是( )
2.生活中处处有化学,下列说法正确的是( )
A.雨水显酸性就是酸雨 B.河水经过过滤能够降低水的硬度
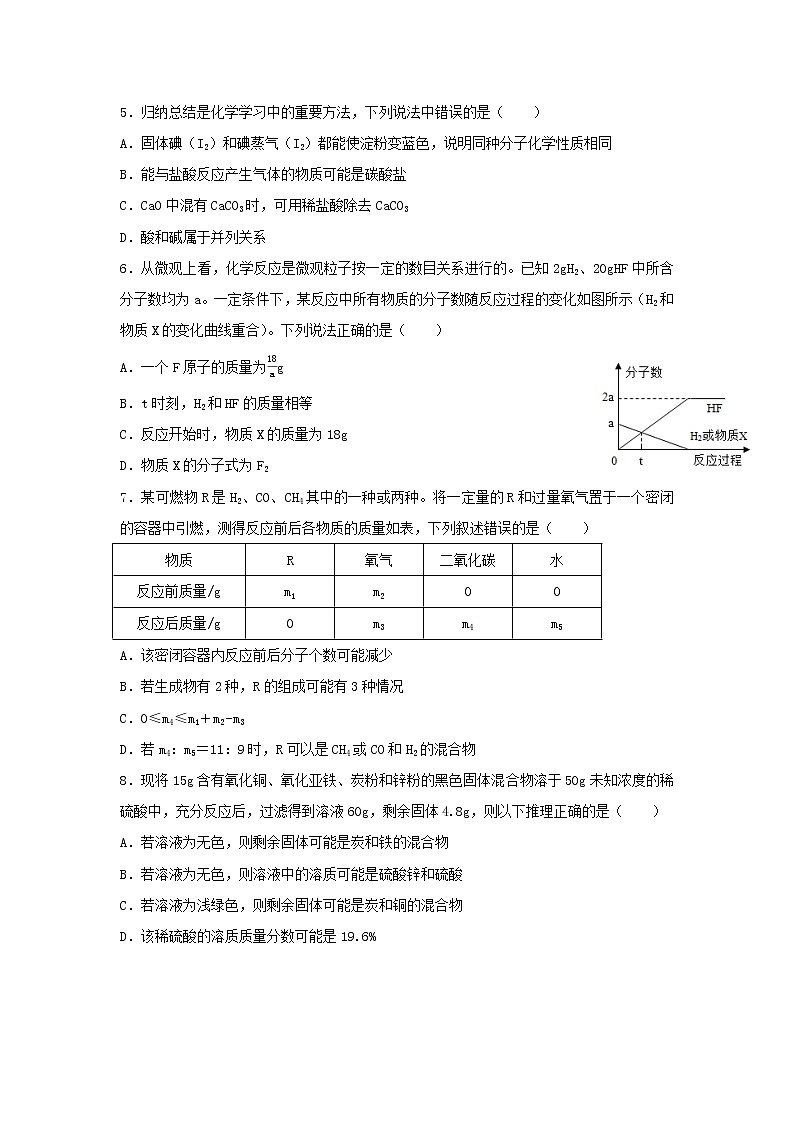
C.二氧化碳大量排放会导致空气污染 D.保持铁制品表面洁净和干燥能够防止铁生锈
3.下列有关化学用语表示正确的是( )
A.氯化铁:FeCl3 B.钠原子结构示意图:
C.2个锌离子:2Zn+2 D.60个碳原子:C60
4.下列实验设计能达到实验目的的是( )
A.A B.B C.C D.D
5.归纳总结是化学学习中的重要方法,下列说法中错误的是( )
A.固体碘(I2)和碘蒸气(I2)都能使淀粉变蓝色,说明同种分子化学性质相同
B.能与盐酸反应产生气体的物质可能是碳酸盐
C.CaO中混有CaCO3时,可用稀盐酸除去CaCO3
D.酸和碱属于并列关系
6.从微观上看,化学反应是微观粒子按一定的数目关系进行的。已知2gH2、20gHF中所含分子数均为a。一定条件下,某反应中所有物质的分子数随反应过程的变化如图所示(H2和物质X的变化曲线重合)。下列说法正确的是( )
A.一个F原子的质量为18ag
B.t时刻,H2和HF的质量相等
C.反应开始时,物质X的质量为18g
D.物质X的分子式为F2
7.某可燃物R是H2、CO、CH4其中的一种或两种。将一定量的R和过量氧气置于一个密闭的容器中引燃,测得反应前后各物质的质量如表,下列叙述错误的是( )
A.该密闭容器内反应前后分子个数可能减少
B.若生成物有2种,R的组成可能有3种情况
C.0≤m4≤m1+m2−m3
D.若m4:m5=11:9时,R可以是CH4或CO和H2的混合物
8.现将15g含有氧化铜、氧化亚铁、炭粉和锌粉的黑色固体混合物溶于50g未知浓度的稀硫酸中,充分反应后,过滤得到溶液60g,剩余固体4.8g,则以下推理正确的是( )
A.若溶液为无色,则剩余固体可能是炭和铁的混合物
B.若溶液为无色,则溶液中的溶质可能是硫酸锌和硫酸
C.若溶液为浅绿色,则剩余固体可能是炭和铜的混合物
D.该稀硫酸的溶质质量分数可能是19.6%
二、解答题:本题共5小题,每小题24分
9.氢气被看作是理想的能源。氢气的制取和储存是氢能源利用领域的研究热点。
(1)科学家正致力于研究在催化剂和光照条件下分解水制氢气:写出该反应的化学方程式: ;
(2)水热分解可得氢气,高温下水分解体系中微粒含量与温度的关系如图所示。图中曲线A、B对应的微粒依次是 (填入相应的化学符号);
(3)一种镁铜合金可用于储氢。350℃时,该镁铜合金与氢气反应,能生成一种化合物MgH2,该化合物中氢元素的化合价是 。
10.在t℃时,分别取甲、乙两种固体的溶液,恒温蒸发水分,得到蒸发水的质量(X)与析出晶体质量(Y)的关系如图所示(析出的晶体不含结晶水)。
(1)t℃时,在0点乙的溶液是 溶液(填“饱和”或“不饱和”)。
(2)t℃时,甲、乙的溶解度大小关系为:甲 乙(填“<”>”或“=”)。
(3)t℃时,甲的溶解度为 (用含m、n的代数式表示)。
(4)下列说法不正确的是 (填序号)。
A.甲、乙两种物质的溶解度都随温度升高而变大
B.根据m、n可计算出:t℃时甲的饱和溶液中溶质的质量分数
C.t℃时在甲、乙的饱和溶液中分别蒸发等量的水,析出晶体的质量:甲>乙
D.t℃时用甲饱和溶液和水配制50g一定浓度的稀溶液时,量取甲溶液时仰视读数,则会使溶液浓度偏大
11.有一包白色粉末,可能含有硫酸铜、硫酸钡、碳酸钾、氯化铵和氢氧化钡中的一种或几种。取少量粉末加氢氧化钠溶液共热,无明显现象;另取一定量该粉末加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色沉淀和无色溶液。
小明同学认为,白色粉末中一定含有硫酸钡;
小意同学认为小明的结论不准确;
针对上述两位同学的观点,小燕同学进一步设计如图实验方案进行探究:
(1)白色固体中一定不含有 (填化学式,下同);
(2)步骤③中,加入酚酞溶液后,若溶液E为无色,则原白色粉末的组成是 ;步骤③中,加入酚酞溶液后,若溶液E为红色,则滤液A中一定含有的溶质是 ,原白色粉末的可能组成是 或 ;
(3)小鹏同学认为,只需取少量滤渣B,加入过量的稀硝酸,若看到的现象是 ,就足以说明原白色粉末中只含有碳酸钾和氢氧化钡。
12.过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用。某化学研究性学习小组设计并完成了如下实验。
【实验目的】测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
【实验原理】2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O。
【交流与讨论】
Ⅰ、甲同学认为测定产物中O2的体积即可测定样品的纯度。
(1)写出装置②内发生的一个化学反应的方程式 ;
(2)实验结束后,装置中会残留部分的氧气,这会使计算结果 (偏大、偏小、不变);
(3)若室温下氧气的密度为1.28g/L,甲同学通过简单计算后,认为所取用过碳酸钠样品的质量最好不超过4.88g,甲同学的理由是 。
Ⅱ、乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定过碳酸钠样品的纯度。但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是 (填编号)。
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.滴加浓盐酸的速度过快,产生的二氧化碳不能被装置②完全吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
D.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
Ⅲ、丙同学提出了一种新方案,得到大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将锥形瓶内所有的液体蒸发、结晶,称得氯化钠固体11.7g,则该样品的质量分数为 。
根据如图所示的实验过程和提供的数据进行计算:
(1)该反应的基本反应类型是 。
(2)AgNO3溶液中溶质质量分数。(精确到0.1%)
一、选择题:本题共8小题,每小题3分,共24分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(2021·武汉外国语学校适应训练四)下列实验操作过程中不发生化学变化的是( )
【答案】B
【解析】A.铁丝在氧气中点燃会燃烧,生成新物质四氧化三铁,发生了化学变化,所以不合题意;
B.白磷入冷水中,既与氧气隔绝,温度也没有达到着火点,不能燃烧,不会发生化学反应,所以选B;
C.水通电会发生分解反应,所以不合题意;
D.拉瓦锡研究空气成分,利用了汞与氧气反应,发生了化学反应,所以不合题意。
2.(2021·武汉六中上智中学4月调考)生活中处处有化学,下列说法正确的是( )
A.雨水显酸性就是酸雨 B.河水经过过滤能够降低水的硬度
C.二氧化碳大量排放会导致空气污染 D.保持铁制品表面洁净和干燥能够防止铁生锈
【答案】D
【解析】A.正常雨水中因溶解有二氧化碳,显酸性,只有pH<5.6的雨水才是酸雨,所以错误;
B.过滤只能除去水中难溶性杂质,而硬水是因为水中含有较多的可溶性钙镁化合物形成的,过滤不能降低水的硬度,所以错误;
C.二氧化碳无毒,不会导致空气污染,所以错误;
D.铁生锈的条件是铁制品同时与氧气和水接触,保持铁制品表面洁净干燥可以避免与水接触,从而防止生锈,所以正确,选D。
3.(2021·武汉武昌区八校3月联考)下列有关化学用语表示正确的是( )
A.氯化铁:FeCl3 B.钠原子结构示意图:
C.2个锌离子:2Zn+2 D.60个碳原子:C60
【答案】A
【解析】A.氯化铁中铁显+3价,氯显-1价,根据化学式书写方法,氯化铁的化学式为FeCl3,所以正确,选A;
B.离子符号书写中电荷数字在前,正负号在后,所以错误;
C.二氧化碳无毒,不会导致空气污染,所以错误;
D.表示分子、原子、离子个数,数字应该是符号前面,所以错误。
4.(2021·武汉东西湖区5月模拟试题)下列实验设计能达到实验目的的是( )
A.A B.B C.C D.D
【答案】A
【解析】A.铜片上的白磷燃烧,红磷不燃烧,说明燃烧需要温度达到着火点,铜片上的白磷燃烧,水中白磷不燃烧,说明燃烧需要与氧气接触,所以能达到实验目的,选A;
B.向干燥的石蕊纸花上喷水再放入二氧化碳中,纸花变红可能是水、二氧化碳或水与二氧化碳反应生成物使纸花变红,所以不能达到实验目的;
C.将铜粉与木炭粉在氧气流中加热,铜和氧气反应生成氧化铜,木炭和氧气反应生成二氧化碳,除掉木炭的同时也消耗了铜,所以不能达到补给目的;
D.碳酸钠与盐酸反应会产生二氧化碳逸出,造成反应前后称得的质量不等,不能验证质量守恒定律,所以不能达到实验目的。
5.(2021·武汉武珞路中学四调训练)归纳总结是化学学习中的重要方法,下列说法中错误的是( )
A.固体碘(I2)和碘蒸气(I2)都能使淀粉变蓝色,说明同种分子化学性质相同
B.能与盐酸反应产生气体的物质可能是碳酸盐
C.CaO中混有CaCO3时,可用稀盐酸除去CaCO3
D.酸和碱属于并列关系
【答案】C
【解析】A.固体碘和碘蒸汽都是由碘分子构成,化学性质相同,所以都能使淀粉变蓝色,所以正确,不合题意;
B.盐酸能与活泼金属反应生成氢气,与碳酸盐反应生成二氧化碳,所以能与盐酸反应产生气体的物质可能是碳酸盐正确,不合题意;
C.氧化钙和碳酸钙都能与盐酸反应,除掉碳酸钙的同时也除掉了氧化钙,所以错误,选C;
D.酸和碱是物质同一分类法中的两类物质,所以是并列关系正确,不合题意。
6.(2021·武汉硚口元月调研考试)从微观上看,化学反应是微观粒子按一定的数目关系进行的。已知2gH2、20gHF中所含分子数均为a。一定条件下,某反应中所有物质的分子数随反应过程的变化如图所示(H2和物质X的变化曲线重合)。下列说法正确的是( )
A.一个F原子的质量为18ag
B.t时刻,H2和HF的质量相等
C.反应开始时,物质X的质量为18g
D.物质X的分子式为F2
【答案】D
【解析】A.根据题意,一个HF分子的质量为20ga,一个氢分子的质量为2ga,所以一个F原子的质量为20ga−2ga×12=19ag,所以错误
B.t时刻,H2和HF的分子数相同,但分子质量不同,因此它们的质量不相等,所以错误;
C.a个HF分子的质量为20g,,2a个HF分子的质量为40g,根据质量守恒定律生成的HF的质量等于反应开始时H2和X质量,所以X的质量=40g-2g=38g,所以错误;
D.根据题意反应的表达式为aX+aH2=2aHF,根据原子守恒得出X的分子式为F2,所以正确,选D。
7.(2021·武汉经开区八校元月调考训练)某可燃物R是H2、CO、CH4其中的一种或两种。将一定量的R和过量氧气置于一个密闭的容器中引燃,测得反应前后各物质的质量如表,下列叙述错误的是( )
A.该密闭容器内反应前后分子个数可能减少
B.若生成物有2种,R的组成可能有3种情况
C.0≤m4≤m1+m2−m3
D.若m4:m5=11:9时,R可以是CH4或CO和H2的混合物
【答案】B
【解析】A.根据H2燃烧的化学方程2H2+O22H2O,分子个数减少,根据CO燃烧的化学方程式2CO+O22CO2,分子个数减少,根据CH4与氧气充分反应的化学方程式CH4+2O2CO2+2H2O,分子数不变,所以密闭容器中分子的数目可能减少或不变,所以正确,不合题意;
B.若生成物2种,即二氧化碳和水,根据元素守恒,反应物中一定含有C、H,反应物中含C、H的可能有CH4或CO、H2或CH4、CO或CH4、H2或CH4、CO、H2四种情况,所以错误,选B;
C.当只有氢气时,m4=0,当只有CO时,m4=m1+m2−m3,当为其它情况时,m4=m1+m2−m3-m5,且m5≠0,故m4
8.(2021·武汉六月模拟)现将15g含有氧化铜、氧化亚铁、炭粉和锌粉的黑色固体混合物溶于50g未知浓度的稀硫酸中,充分反应后,过滤得到溶液60g,剩余固体4.8g,则以下推理正确的是( )
A.若溶液为无色,则剩余固体可能是炭和铁的混合物
B.若溶液为无色,则溶液中的溶质可能是硫酸锌和硫酸
C.若溶液为浅绿色,则剩余固体可能是炭和铜的混合物
D.该稀硫酸的溶质质量分数可能是19.6%
【答案】C
【解析】A.溶液为无色,则溶液中无Cu2+、Fe2+,都变成了Cu、Fe,剩余固体中还有Cu,所以错误;
B.溶液为无色,则溶液中无Cu2+、Fe2+,都变成了Cu、Fe,滤渣中有Fe,溶液中不可能有硫酸,所以错误;
C.若溶液为浅绿色,则溶液中有Fe2+,没有Cu2+,所以剩余固体中可能有炭和铜,溶液中有Fe2+,可能是铁元素全部以Fe2+形式在溶液中,也可能是部分以Fe2+形式在溶液中,部分以Fe的形式存在于剩余固体中,所以当溶液为浅绿色,则剩余固体可能是炭和铜的混合物正确,选C;
D.根据黑色固体的成分以及所给的数据可知,Zn与硫酸反应生成了氢气,且质量为15g+50g-60g-4.8g=0.2g,设此反应中参加反应的Zn的质量为x,硫酸的质量为y
Zn + H2SO4 = ZnSO4 + H2↑
65 98 2
x y 0.2g
列比例式解得x=6.5g, y=9.8g
原固体的质量为15g,而剩余固体质量为4.8g,因此与硫酸反应的除Zn外的固体氧化铜、氧化亚铁中的一种或两种,质量为15g-4.8g-6.5g=3.7g,根据CuO+H2SO4= CuSO4+H2O、FeO+H2SO4= FeSO4+H2O,因CuO相对分子质量大于FeO,故相同质量的CuO、FeO,CuO消耗的硫酸的质量少,设3.7gCuO完全反应消耗硫酸的质量为z,则CuO + H2SO4= CuSO4 + H2O
80 98
3.7g z
列比例式解得z=4.5g
故硫酸溶液中硫酸的质量分数至少为9.8g+4.5g50g×100%=28.6%,所以硫酸溶液的溶质的质量分数至少为28.6%,不可能为19.6%,所以错误。
二、解答题:本题共5小题,每小题24分
9.(2021·武汉七一华源中4月联考)氢气被看作是理想的能源。氢气的制取和储存是氢能源利用领域的研究热点。
(1)科学家正致力于研究在催化剂和光照条件下分解水制氢气:写出该反应的化学方程式: ;
(2)水热分解可得氢气,高温下水分解体系中微粒含量与温度的关系如图所示。图中曲线A、B对应的微粒依次是 (填入相应的化学符号);
(3)一种镁铜合金可用于储氢。350℃时,该镁铜合金与氢气反应,能生成一种化合物MgH2,该化合物中氢元素的化合价是 。
【答案】(1)2H2O2H2+O2↑;(2)H、O;(3)-1
【解析】(1)反应物为水,生成物为、,反应条件为光照、催化剂,根据书写化学方程式的方法写出化学方程式为2H2O2H2+O2↑;
(2)高温条件下氢分子、氧原子分别分解成氢原子、氧原子,所以图中曲线A、B对应的微粒依次是H、O;
(3)Mg的化合价为+2,设H的化合价为x,根据化合物中元素正负化合价的代数和为0,则有+2×1+x×2=0,x=-1。
10.(2021·武汉硚口3月)在t℃时,分别取甲、乙两种固体的溶液,恒温蒸发水分,得到蒸发水的质量(X)与析出晶体质量(Y)的关系如图所示(析出的晶体不含结晶水)。
(1)t℃时,在0点乙的溶液是 溶液(填“饱和”或“不饱和”)。
(2)t℃时,甲、乙的溶解度大小关系为:甲 乙(填“<”>”或“=”)。
(3)t℃时,甲的溶解度为 (用含m、n的代数式表示)。
(4)下列说法不正确的是 (填序号)。
A.甲、乙两种物质的溶解度都随温度升高而变大
B.根据m、n可计算出:t℃时甲的饱和溶液中溶质的质量分数
C.t℃时在甲、乙的饱和溶液中分别蒸发等量的水,析出晶体的质量:甲>乙
D.t℃时用甲饱和溶液和水配制50g一定浓度的稀溶液时,量取甲溶液时仰视读数,则会使溶液浓度偏大
【答案】(1)不饱和;(2)<;(3)100nmg;(4)AC
【解析】(1)根据图示可知在0点时蒸发一段时间,乙才析出晶体,所以在0点时乙的溶液是不饱和溶液;
(2)图中甲的倾斜度比乙小,说明它们的饱和溶液蒸发相同质量的水,甲析出的晶体质量比乙小,所以该温度下溶解度甲<乙;
(3)由图中看出t℃时甲的饱和溶液蒸发mg水,析出ng晶体,设t℃时甲的溶解度为x,则x:100=n:m,x=100nmg;
(4)A.图中显示的是甲、乙溶液在同一温度下的变化,因此无法判断甲、乙溶解度随温度的变化情况,所以错误,选A;
B.由图中看出t℃时甲的饱和溶液蒸发mg水,析出ng晶体,即在t℃时ng甲溶解在mg水中形成饱和溶液,所以t℃时甲的饱和溶液的溶质的质量分数为nn+m×100%,所以正确;
C.由于t℃甲的溶解度小于乙的溶解度,因此它们的饱和溶液蒸发相同质量的水析出晶体的质量甲<乙,所以错误,选C;
D.量取甲溶液时仰视读数,则量取的甲溶液的质量偏大,造成稀释后溶液中溶质的质量偏大,所以使溶液浓度偏大,正确。
11.(2021·武汉外国语学校适应性)有一包白色粉末,可能含有硫酸铜、硫酸钡、碳酸钾、氯化铵和氢氧化钡中的一种或几种。取少量粉末加氢氧化钠溶液共热,无明显现象;另取一定量该粉末加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色沉淀和无色溶液。
小明同学认为,白色粉末中一定含有硫酸钡;
小意同学认为小明的结论不准确;
针对上述两位同学的观点,小燕同学进一步设计如图实验方案进行探究:
(1)白色固体中一定不含有 (填化学式,下同);
(2)步骤③中,加入酚酞溶液后,若溶液E为无色,则原白色粉末的组成是 ;步骤③中,加入酚酞溶液后,若溶液E为红色,则滤液A中一定含有的溶质是 ,原白色粉末的可能组成是 或 ;
(3)小鹏同学认为,只需取少量滤渣B,加入过量的稀硝酸,若看到的现象是 ,就足以说明原白色粉末中只含有碳酸钾和氢氧化钡。
【答案】(1)NH4Cl、CuSO4;(2)BaSO4、K2CO3 K2CO3、KOH BaSO4、K2CO3、Ba(OH)2 K2CO3、Ba(OH)2;(3)沉淀溶解,有气泡冒出
【解析】(1)NH4Cl与氢氧化钠反应会产生有刺激性气味的气体,白色粉末与氢氧化钠溶液共热,无明显现象,说明没有NH4Cl;)白色粉末中若有CuSO4,加入足量水溶液会出现蓝色沉淀或蓝色溶液,而溶解后有白色沉淀和无色溶液,所以固体中无CuSO4,所以原固体中一定不含NH4Cl、CuSO4;
(2)白色粉末中可能含有的成分有BaSO4、K2CO3、Ba(OH)2,经步骤①后有滤液A和渣B,则白色粉末可能有的组合有:①BaSO4、K2CO3,②BaSO4、Ba(OH)2,③K2CO3、Ba(OH)2,④BaSO4、K2CO3、Ba(OH)2;经步骤②后,有滤液C和滤渣D,则滤液A中一定含有K2CO3,则白色粉末中一定有K2CO3,所以组合②不可能;若为组合①,则滤液C呈中性,若为组合③或④,则K2CO3、Ba(OH)2反应生成BaCO3与KOH,且K2CO3过量,滤液C呈碱性,经步骤③后,溶液E显无色,则为组合①BaSO4、K2CO3,若溶液E显红色,则为组合③K2CO3、Ba(OH)2或④BaSO4、K2CO3、Ba(OH)2,滤液A中一定有K2CO3、KOH;
(3)若白色粉末中只含K2CO3、Ba(OH)2,加水溶解后产生的沉淀只有,BaCO3加过量的稀硝酸,沉淀会全部溶解,且有气泡冒出。
12.(2021·武昌区八校3月联考)过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用。某化学研究性学习小组设计并完成了如下实验。
【实验目的】测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
【实验原理】2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O。
【交流与讨论】
Ⅰ、甲同学认为测定产物中O2的体积即可测定样品的纯度。
(1)写出装置②内发生的一个化学反应的方程式 ;
(2)实验结束后,装置中会残留部分的氧气,这会使计算结果 (偏大、偏小、不变);
(3)若室温下氧气的密度为1.28g/L,甲同学通过简单计算后,认为所取用过碳酸钠样品的质量最好不超过4.88g,甲同学的理由是 。
Ⅱ、乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定过碳酸钠样品的纯度。但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是 (填编号)。
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.滴加浓盐酸的速度过快,产生的二氧化碳不能被装置②完全吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
D.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
Ⅲ、丙同学提出了一种新方案,得到大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将锥形瓶内所有的液体蒸发、结晶,称得氯化钠固体11.7g,则该样品的质量分数为 。
【答案】(1)CO2+2NaOH=Na2CO3+H2O或HCl+NaOH=NaCl+H2O;(2)偏小;(3)过碳酸样品质量超过4.88g,产生氧气的体积会超过量筒的量程;(4)ACD;(5)97.6%。
【解析】(1)氢氧化钠能与非金属氧化物和酸反应,因此装置②中的氢氧化钠能与装置①中的产生的CO2和挥发出来的HCl反应,所以化学方程式为CO2+2NaOH=Na2CO3+H2O或HCl+NaOH=NaCl+H2O;
(2)实验结束后,装置中会残留部分的氧气会造成收集到的O2体积偏小,从而计算出来的过碳酸钠质量偏小,则过碳酸钠的质量分数偏小;
(3)设4.88g过碳酸钠完全反应产生O2的质量为x
2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
244 32
4.88g x
列比例式解得x=0.64g
则室温下0.64gO2的体积=0.64g÷1.28g/L=0.5L=500mL
由此可知,当样品的质量超过4.88g,产生O2的体积会超过量筒的量程;
(4)A.装置②吸收HCl当作CO2,使装置②增加的质量偏多,CO2的质量偏大,造成计算出的过碳酸钠的纯度偏大;
B.滴加浓盐酸的速度过快,产生的二氧化碳不能被装置②完全吸收,使装置②增加的质量偏多,CO2的质量偏小,造成计算出的过碳酸钠的纯度偏小;
C.装置①、②内空气中的二氧化碳被装置②吸收,使装置②增加的质量偏多,CO2的质量偏大,造成计算出的过碳酸钠的纯度偏大;
D.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收,使装置②增加的质量偏多,CO2的质量偏大,造成计算出的过碳酸钠的纯度偏大;
故答案选ACD。
(5)设4.88g过碳酸钠样品的纯度为y%
2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
244 234
12.5g×y% 11.7
列比例式解得y%=97.6%
13.(2021·武汉二中广雅三模)根据如图所示的实验过程和提供的数据进行计算:
(1)该反应的基本反应类型是 。
(2)AgNO3溶液中溶质质量分数。(精确到0.1%)
【答案】(1)复分解反应;
(2)解:根据质量守恒定律可知加入硝酸银溶液的质量=170g+28.7g-28.7g-100g=70g
设AgNO3溶液中溶质质量分数为x%
AgNO3+NaCl=AgCl↓+NaNO3
170 143.5
70g×x% 28.7g
17070g×x%= x%≈48.6%
答:AgNO3溶液中溶质质量分数为48.6%
选项
A
B
C
D
实验
设计
实验
目的
探究可燃物燃烧的两个条件
探究CO2与H2O是否发生反应
除去铜粉中混有的木炭粉
验证质量守恒定律
物质
R
氧气
二氧化碳
水
反应前质量/g
m1
m2
0
0
反应后质量/g
0
m3
m4
m5
选项
A
B
C
D
实验
设计
实验
目的
探究可燃物燃烧的两个条件
探究CO2与H2O是否发生反应
除去铜粉中混有的木炭粉
验证质量守恒定律
物质
R
氧气
二氧化碳
水
反应前质量/g
m1
m2
0
0
反应后质量/g
0
m3
m4
m5
2022年湖北省武汉市武昌区中考化学模拟试题(二)(word版无答案): 这是一份2022年湖北省武汉市武昌区中考化学模拟试题(二)(word版无答案),共5页。试卷主要包含了选择题等内容,欢迎下载使用。
2022年湖北省武汉市中考化学模拟试题(四)(word版含答案): 这是一份2022年湖北省武汉市中考化学模拟试题(四)(word版含答案),共19页。试卷主要包含了5 K 39 Ca 40, 12,01,67,0g-16,9g等内容,欢迎下载使用。
2022年湖北省武汉市中考化学模拟试题(五)(word版含答案): 这是一份2022年湖北省武汉市中考化学模拟试题(五)(word版含答案),共17页。试卷主要包含了5 Ca 40, 20 ,25%,5g=5,5g,125g等内容,欢迎下载使用。












