

2022西藏林芝市二中高三下学期第四次月考化学试题含答案
展开林芝二高2021~2022学年高三第四次月考考试
理综化学试卷
注意事项:
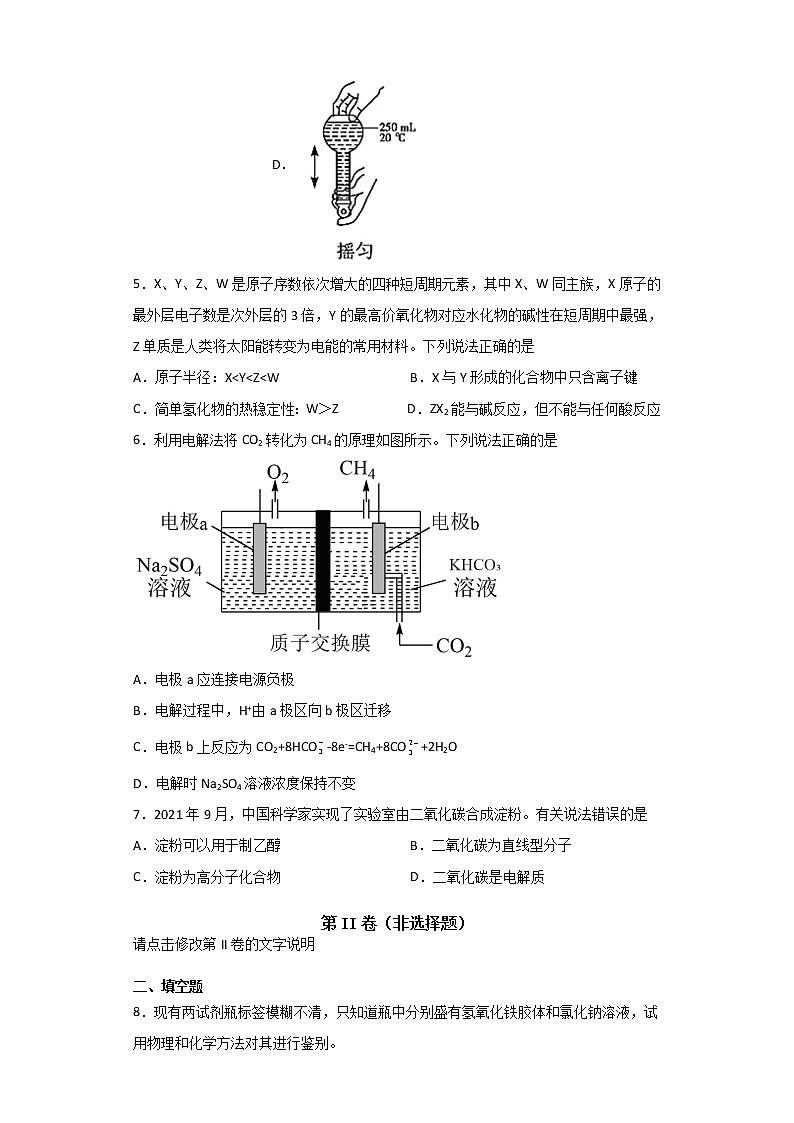
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
请点击修改第I卷的文字说明
一、单选题
1.化学与生活、生产息息相关。下列有关物质用途的叙述不正确的是
A.油脂可用于生产肥皂 B.氯气可用于生产漂白粉
C.铁制容器可用于盛装稀硫酸 D.75%(体积分数)的酒精溶液可用于杀菌消毒
2.NA表示阿伏加德罗常数的值,下列说法正确的是
A.22.4LCO2中含有NA个CO2分子
B.1.0L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA
C.0.1mol/L的NaCl溶液中,Na+与Cl-离子总数为0.2NA
D.O2和O3的混合气体48g共含有氧原子数为3NA
3.下列离子方程式书写正确的是
A.铁和硫酸溶液反应:
B.氧化铜和稀盐酸反应:
C.钠与水反应:
D.碳酸钙与盐酸反应:
4.用固体样品配制一定物质的量浓度的溶液,需经过溶解、转移、定容、摇匀等操作。下列图示对应的操作不规范的是
A. B. C. D.
5.X、Y、Z、W是原子序数依次增大的四种短周期元素,其中X、W同主族,X原子的最外层电子数是次外层的3倍,Y的最高价氧化物对应水化物的碱性在短周期中最强,Z单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
A.原子半径:X<Y<Z<W B.X与Y形成的化合物中只含离子键
C.简单氢化物的热稳定性:W>Z D.ZX2能与碱反应,但不能与任何酸反应
6.利用电解法将CO2转化为CH4的原理如图所示。下列说法正确的是
A.电极a应连接电源负极
B.电解过程中,H+由a极区向b极区迁移
C.电极b上反应为CO2+8HCO-8e-=CH4+8CO+2H2O
D.电解时Na2SO4溶液浓度保持不变
7.2021年9月,中国科学家实现了实验室由二氧化碳合成淀粉。有关说法错误的是
A.淀粉可以用于制乙醇 B.二氧化碳为直线型分子
C.淀粉为高分子化合物 D.二氧化碳是电解质
第II卷(非选择题)
请点击修改第II卷的文字说明
二、填空题
8.现有两试剂瓶标签模糊不清,只知道瓶中分别盛有氢氧化铁胶体和氯化钠溶液,试用物理和化学方法对其进行鉴别。
(物理方法)(写出对应现象)
(1)观察颜色:呈___色的是氢氧化铁胶体,___色的是氯化钠溶液。
(2)胶体特性:在水平方向上用激光笔照射两个试剂瓶,若从侧面看到___,则为氢氧化铁胶体,无此现象的为氯化钠溶液。
(化学方法)(写出对应化学方程式)
(3)加盐酸能够反应的是Fe(OH)3:___。
(4)加入HNO3酸化的AgNO3溶液,生成白色沉淀的是NaCl溶液,无白色沉淀生成的是Fe(OH)3胶体:___。
9.地壳中的某种元素在现代高科技产品中占有重要位置,足见化学对现代文明的重要作用。例如:
(1)计算机芯片的主要成分是:_______;
(2)光导纤维的主要成分是:_______,其遇到强碱易被腐蚀,请写出该物质与氢氧化钠溶液反应的化学方程式:_______。
10.在载人航天器中,可以利用与的反应,将航天员呼出的转化为等,然后通过电解得到,从而实现的再生。已知:
①
②
请写出甲烷与氧气反应生成二氧化碳和液态水的热化学方程式___________。
11.工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0 MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)CH3OH(g)ΔH1=-90.7 kJ·mol-1①
2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1②
CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1③
反应器中的总反应可表示为3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算该反应的ΔH=__________。
12.采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。已知:
2N2O5(g)=2N2O4(g)+O2(g) ΔH1=−4.4 kJ·mol−1
2NO2(g)=N2O4(g) ΔH 2=−55.3 kJ·mol−1
则反应N2O5(g)=2NO2(g)+O2(g)的ΔH=_______ kJ·mol−1。
13.为了研究反应能量变化情况,某同学设计了如图所示装置。当向盛有的试管中滴加试剂时,看到形管中甲处液面下降乙处液面上升。试回答下列问题:
(1)该反应为___________反应(填“放热”或“吸热”)。
(2)物质中的化学能通过化学反应转化成___________释放出来。
(3)若甲烷的燃烧热为,写出表示甲烷燃烧热的热化学方程式___________。
(4)已知
。
则高温下___________。
14.观察下列实验装置图,按要求作答:
(1)写出图中实验操作的名称:①_______,③中仪器A的名称_______
(2)装置④中所有玻璃仪器的名称:_______,_______
(3)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
①从 KCl溶液中获取KCl晶体_______;
②从海水中提取淡水_______;
③分离CaCO3和水_______;
④分离植物油和水_______。
15.下表列出了①~⑤五种元素在周期表中的位置:
族 周期 | ⅠA |
| 0 | |||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 |
|
|
| ② |
| ③ |
|
|
3 | ④ |
| ⑤ |
|
|
| ⑥ |
|
按要求回答下列问题:
(1)元素⑥的最高正化合价是___________。
(2)元素⑤在周期表中的位置是___________。
(3)元素②和元素③的非金属性强弱关系是②___________③(选填“>”或“<”);表中所列六种元素的单质,常温下为有色气体的是___________(填化学式)。
(4)①~⑥六种元素中原子半径最大的是___________(填元素符号)。②③两种元素的最简单氢化物中最稳定的是___________(填化学式)
(5)元素③与元素④能形成原子个数比为1:1的化合物 Y,Y 在常温下为固态,焰色反应为黄色,常用与呼吸面具中做供氧剂。写出Y与水反应的化学方程式:___________。
16.某烃A是有机化学工业的基本原料,还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:
(1)写出A、B、C、D的结构简式:A___,B___,C__,D__。
(2)写出②④两步反应的化学方程式,并注明反应类型:
②___,反应类型:___。
④___,反应类型:___。
参考答案
1.C
【详解】
A.油脂碱性条件下水解生成高级脂肪酸钠(肥皂的主要成分),故可制肥皂,A正确;
B.漂白粉的主要成分为氯化钙和次氯酸钙,所以工业上用氯气与石灰乳反应生产漂白粉,B正确;
C.铁可以和稀硫酸反应,故不能用铁制容器可用于盛装稀硫酸,C错误;
D.75%的酒精可以使蛋白质变性,从而杀死细菌,D正确;
故选C。
2.D
【详解】
A.未指明标准状况,故难以确定22.4LCO2的物质的量、难以确定含有的CO2分子数目,A错误;
B. 1.0L1.0mol•L-1的NaAlO2水溶液中溶质、溶剂中均含有氧原子数目,故含有的氧原子数远大于2NA,B错误;
C. 0.1mol/L的NaCl溶液的体积未知,难以确定Na+与Cl-离子总数,C错误;
D.O2和O3均是氧元素的单质,混合气体的质量48g即氧原子总质量,则共含有氧原子数为3NA,D正确;
答案选D。
3.B
【详解】
A.铁和硫酸溶液反应生成,正确的离子方程式为:,A错误;
B.氧化铜和稀盐酸反应生成氯化铜和水,氧化铜难溶于水,不能拆,离子方程式,B正确;
C.电荷不守恒,钠与水反应应为,C错误;
D.碳酸钙难溶不能拆,正确的离子方程式为:,D错误;
故选:B。
4.C
【详解】
A.固体的溶解在烧杯中进行、用玻璃棒搅拌可加速溶解,A正确;
B.向容量瓶中转移溶液时应该用玻璃棒引流,玻璃棒末端在刻度线以下,B正确;
C.定容时胶头滴管不能插入容量瓶中,C错误;
D.定容后盖好瓶塞用食指顶住瓶塞,用另一只手手指托住瓶底,把容量瓶颠倒摇匀多次,摇匀操作正确,D正确;
答案选C。
5.C
【分析】
X、Y、Z、W是原子序数依次增大的四种短周期元素,其中X、W同主族,X原子的最外层电子数是次外层的3倍,则X为O,W为S,Y的最高价氧化物对应水化物的碱性在短周期中最强,则Y为Na,Z单质是人类将太阳能转变为电能的常用材料,则Z为Si。
【详解】
A.根据层多径大,同电子层结构核多径小原则,原子半径:X(O)<W(S)<Z(Si)<Y(Na),故A错误;
B.X与Y形成的化合物过氧化钠含离子键和共价键,故B错误;
C.同周期非金属性越强,其简单氢化物稳定性越强,因此简单氢化物的热稳定性:W(H2S) >Z(SiH4),故C正确;
D.ZX2(SiO2)能与碱反应,能与HF反应,不能与其它酸反应,故D错误;
综上所述,答案为C。
6.B
【分析】
根据题意可知该装置为电解池,由a极生成O2可以判断出a极为阳极,则b为阴极。
【详解】
A.a为阳极,应连接电源正极,A错误;
B.电解池中阳离子向阴极迁移,a为阳极,b为阴极,所以H+由a极区向b极区迁移,B正确;
C.根据装置图可知电解过程中在KHCO3溶液中CO2在阴极得电子被还原为CH4,电极反应式应为CO2+8HCO+8e-=CH4+8CO+2H2O,C错误;
D.电解时a电极上反应为2H2O-4e-=O2↑+4H+,实质是电解水,溶液中的水消耗,所以Na2SO4溶液的浓度是增大的,D错误;
综上所述答案为B。
7.D
【详解】
A.淀粉水解得到葡萄糖,葡萄糖在乙醇酶作用下可以制乙醇,A正确;
B.二氧化碳中心原子碳原子是sp杂化,分子结构为直线型,B正确;
C.淀粉是多糖类,是聚合物,属于高分子化合物,C正确;
D.二氧化碳在水溶液中或熔融状态下均不能发生电离,属于非电解质,D错误;
故选D。
8.
(1) 红褐色无色
(2)光的通路
(3)Fe(OH)3+3HCl=FeCl3+3H2O
(4)AgNO3+NaCl=AgCl↓+NaNO3
【解析】
(1)
可利用观察法鉴别:氢氧化铁胶体呈红褐色,而氯化钠溶液为无色;
(2)
胶体特性:胶体具有丁达尔效应,可在水平方向上用红色激光笔照射两个试剂瓶,在与光线垂直的方向上能看到一条光亮通路的是氢氧化铁胶体,无此现象的为氯化钠溶液;
(3)
盐酸和氢氧化铁反应生成氯化铁和水,反应的化学方程式为:Fe(OH)3+3HCl=FeCl3+3H2O;
(4)
氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,反应的化学方程式为:AgNO3+NaCl=AgCl↓+NaNO3。
9.
(1)Si
(2) SiO2SiO2+2NaOH=Na2SiO3+H2O
【解析】
(1)
计算机芯片的主要成分是Si;
(2)
光导纤维的主要成分是SiO2;SiO2和NaOH溶液反应生成Na2SiO3和H2O,化学方程式为SiO2+2NaOH=Na2SiO3+H2O。
10.CH4(g)+2O2(g)= CO2(g)+2H2O(l) =-890.3 kJ/mol
【详解】
根据盖斯定律:①+②×2得到:CO2(g)+2H2O(l)=CH4(g)+2O2(g)=-252.9kJ/mol+2×571.6 kJ/mol=+890.3 kJ/mol;所以甲烷与氧气反应生成二氧化碳和液态水的热化学方程式:CH4(g)+2O2(g)= CO2(g)+2H2O(l) =-890.3 kJ/mol。
11.-246.1kJ·mol-1
【详解】
已知:CO(g)+2H2(g)CH3OH(g)ΔH1=-90.7 kJ·mol-1①
2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1②
CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1③
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)CH3OCH3(g)+CO2(g) ΔH =-246.1kJ/mol。
12.53.1
【详解】
第一个方程式×-第二个方程式得到第三个方程式,故ΔH=ΔH1-ΔH2=53.1 kJ·mol−1,故答案为:53.1。
13.
(1)放热
(2)热能
(3)
(4)+74.6kJ/mol
【分析】
(1)
由于发生反应A+B=C+D,U型管中甲处液面下降乙处液面上升,根据气体具有热胀冷缩的性质可以判断该反应为放热反应,故答案为∶放热;
(2)
化学变化伴随着物质变化和能量变化,物质中的化学能可以通过化学反应转化成热能释放出来,故答案为∶热能;
(3)
CH4(g)的燃烧热为△H=-890kJ/mol ,则甲烷的燃烧热的热化学方程式为∶CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol,故答案为∶
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol;
(4)
①C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ⋅mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ⋅mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol
根据盖斯定律计算:③-(①+②),得:CH4(g)=C(s)+2H2(g) ΔH4=△H-(ΔH2+ ΔH3)=+74.6 kJ⋅mol-1,故答案为:+74.6 kJ⋅mol-1。
14.过滤蒸馏烧瓶分液漏斗烧杯②③①④
【详解】
(1)由图中装置知,①为分离不溶性固体和液体的装置,操作为过滤,③中仪器A的名称蒸馏烧瓶;
(2) 装置④为分液装置,其玻璃仪器有分液漏斗、烧杯;
(3) ①KCl溶于水、溶解度不随温度而急剧增大,采用蒸发结晶,利用蒸发装置即②;
②从海水中提取淡水:沸点不同,可用蒸馏获得淡水,利用蒸馏装置即③;
③碳酸钙不溶于水,则过过滤分离CaCO3和水,利用过滤装置即①;
④植物油和水是互不相溶的液体,利用分液分离植物油和水,利用分液装置即④。
15.
(1)+7
(2)第三周期ⅢA族
(3) <Cl2
(4) NaH2O
(5)2Na2O2+2H2O=4NaOH+O2↑
【分析】
根据各元素在元素周期表中的位置可知,①~⑥号元素分别为H、C、O、Na、Al、Cl。
(1)
元素⑥为Cl元素,最外层有7个电子,最高正化合价为+7价;
(2)
元素⑤为Al元素,位于第三周期ⅢA族;
(3)
同周期自左至右非金属性增强,所以非金属性②<③;六种元素的单质,常温下为有色气体的是Cl2;
(4)
电子层数越多,原子半径越大,电子层数相同,核电荷数越小,半径越大,所以原子半径最大的是Na;非金属性越强,最简单氢化物越稳定,所以②③两种元素的最简单氢化物中最稳定的是H2O;
(5)
Na与O元素形成原子个数比为1:1的化合物 为Na2O2,过氧化钠与水反应生成NaOH和氧气,方程式为2Na2O2+2H2O=4NaOH+O2↑;
16.CH2=CH2CH3CH3CH3CH2ClCH3CH2OHCH2=CH2+HClCH3CH2Cl加成反应CH3CH3+Cl2CH3CH2Cl+HCl取代反应
【分析】
某烃A是有机化学工业的基本原料,还是一种植物生长调节剂,则A为乙烯,乙烯与H2发生加成生成乙烷,乙烯和HCl发生加成生成氯乙烷,乙烯和H2O发生加成生成乙醇,则A、B、C、D的结构简式分别是CH2=CH2、CH3CH3、CH3CH2Cl、CH3CH2OH。
【详解】
(1)根据上述分析,A为乙烯,结构简式为CH2=CH2,B为乙烷,结构简式为CH3CH3,C为氯乙烷,结构简式为CH3CH2Cl,D为乙醇,结构简式为CH3CH2OH;
(2) ②为乙烯与HCl发生加成反应,化学方程式为CH2=CH2+HClCH3CH2Cl;
④乙烷和Cl2在光照条件下发生取代反应,化学方程式为CH3CH3+Cl2CH3CH2Cl+HCl。
2020西藏自治区林芝市二中高一下学期第一学段考试化学试题含答案: 这是一份2020西藏自治区林芝市二中高一下学期第一学段考试化学试题含答案,共8页。试卷主要包含了请将答案正确填写在答题卡上,下列关于N2的叙述错误的是等内容,欢迎下载使用。
2020西藏自治区林芝市二中高三上学期第一次月考化学试题含答案: 这是一份2020西藏自治区林芝市二中高三上学期第一次月考化学试题含答案
西藏林芝市第二高级中学2022-2023学年高三上学期第一次月考化学试题(含答案): 这是一份西藏林芝市第二高级中学2022-2023学年高三上学期第一次月考化学试题(含答案),共4页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












