




2022年中考化学第一轮系统复习---第九讲海水中的化学(第1课时海洋化学资源)课件PPT
展开
这是一份2022年中考化学第一轮系统复习---第九讲海水中的化学(第1课时海洋化学资源)课件PPT,共60页。PPT课件主要包含了氯化钠,钠元素,氧元素,复分解反应,分解反应,富集氯化镁,天然气,粒子直径大小,蒸发结晶,饱和溶液等内容,欢迎下载使用。
海洋化学资源(烟台5考,东营:2021.17,济宁:2020.14)
1.海水中的物质(1)海水中含量最多的物质是___,溶解的主要物质是_______。 (2)海水中含量最多的金属元素是_______,含量最多的非金属元素是_______。
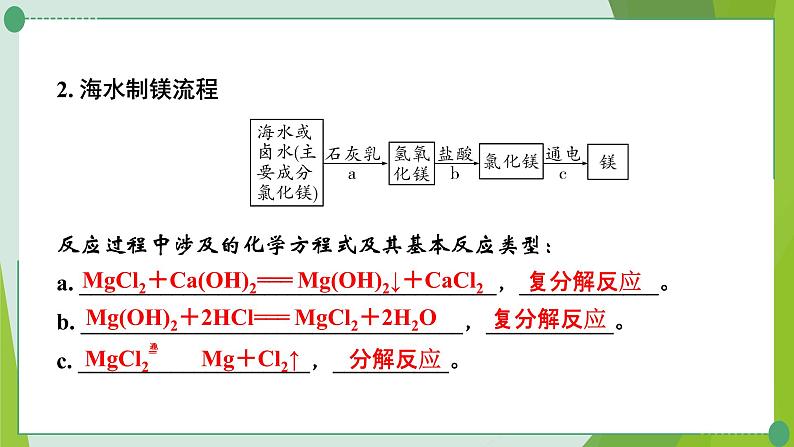
2. 海水制镁流程反应过程中涉及的化学方程式及其基本反应类型:a. ____________________________________,____________。b. _________________________________,___________。c. ____________________,__________。
MgCl2+Ca(OH)2=== Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl=== MgCl2+2H2O
【特别提醒】①海水或卤水中本身就含有氯化镁,步骤a、b的作用是___________;②利用苦卤制镁比直接向海水中加入石灰乳的优势:苦卤中氯化镁的浓度高、杂质少。③海水制镁过程中,一般不用氢氧化钠代替石灰乳,原因是__________________________。
3.海底矿物(1)人类开发利用的海洋资源:化学资源、矿产资源、动力资源和生物资源等。(2)海底矿物①常规化石燃料:____、______、________。②新型矿产资源——天然气水合物(又称“可燃冰”):热值高、燃烧后几乎不产生残渣或废气,被誉为“未来能源”“21世纪能源”。③含有多种金属的矿物,如多金属结核(又称锰结核)。(3)保护海洋资源的措施①海洋环境立法;②建立海洋自然保护区;③加强海洋环境监测;④提高消除污染的技术水平等。
4.海水淡化(1)规模化和产业化淡化海水①膜法(反渗透法)→利用_____________不同分离;②热法(多级闪急蒸馏法)→利用_____不同分离。(2)蒸馏法淡化海水①装置(如图1)②方法:a.蒸干大试管中的海水,观察到有晶体析出。b.向小试管里的冷凝水中加入几滴硝酸银溶液,未观察到明显现象。
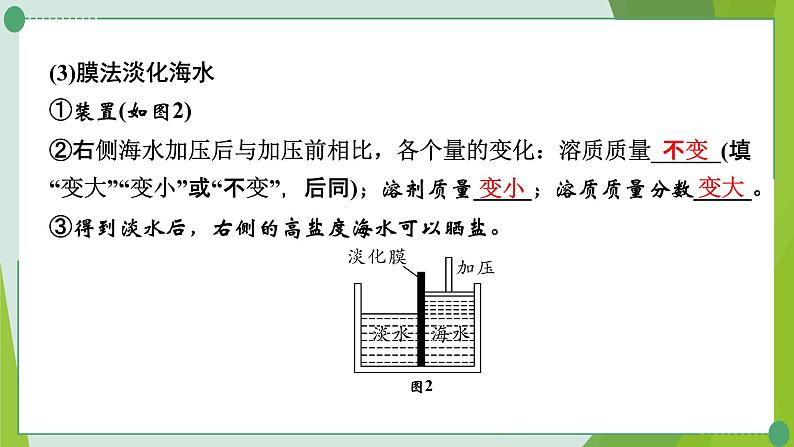
(3)膜法淡化海水①装置(如图2)②右侧海水加压后与加压前相比,各个量的变化:溶质质量______(填“变大”“变小”或“不变”,后同);溶剂质量_____;溶质质量分数_____。③得到淡水后,右侧的高盐度海水可以晒盐。
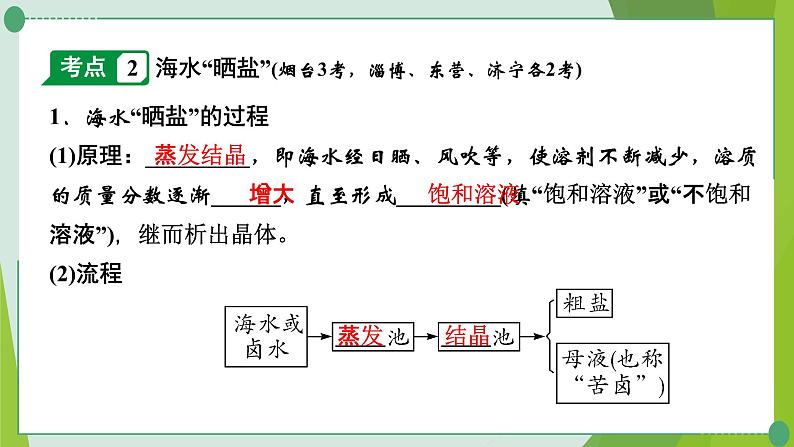
海水“晒盐”(烟台3考,淄博、东营、济宁各2考)
1.海水“晒盐”的过程(1)原理:_________,即海水经日晒、风吹等,使溶剂不断减少,溶质的质量分数逐渐______,直至形成_________(填“饱和溶液”或“不饱和溶液”),继而析出晶体。(2)流程
2.粗盐的提纯(1)粗盐中难溶性杂质的去除(详见实验突破栏目)(2)食盐中可溶性杂质的去除(详见实验突破栏目)
海水“制碱”(烟台3考,淄博:2019.9①,东营2考,济宁:2019.14)
1.氨碱法制纯碱(1)流程图(2)流程分析①氨碱法生产纯碱的过程中,先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳的原因是__________________________________________________。
②氨盐水吸收二氧化碳生成的碳酸氢钠和氯化铵两种物质,更易析出的是_________,原因是________________________________________________。
同温度下碳酸氢钠的溶解度比氯化铵小,先结晶析出
(3)原理:___________________________________________;__________________________________。(4)优点:原料经济易得,CO2和NH3可回收使用,能连续生产。(5)缺点:回收氨时产生大量的氯化钙用处不大,且污染环境。
NaCl+NH3+CO2+H2O=== NaHCO3+NH4Cl
2.侯氏制碱法(1)化学史:1926年,我国化学家_______在氨碱法的基础上,创立了更为先进的联合制碱法——侯氏制碱法。(2)与氨碱法制纯碱相比的改进:向滤出NaHCO3晶体后的NH4Cl溶液中加入食盐,使其中的NH4Cl结晶单独析出。(3)优点:侯氏制碱法中单独析出的NH4Cl可用作氮肥,NaCl溶液可循环使用。
海水化学中各物质间的关系(1)写出下列物质的化学式甲________ 乙________ 丙________(2)写出下列序号对应的化学方程式:①__________________________________②____________________________________③__________________________________________④____________________________
Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
NaCl+NH3+CO2+H2O=== NaHCO3+NH4Cl
NaOH+HCl=== NaCl+H2O
⑤______________________________________⑥______________________________________⑦________________________________⑧______________________________________
Na2CO3+Ba(OH)2=== BaCO3↓+2NaOH
Na2CO3+CaCl2=== CaCO3↓+2NaCl
Ca(OH)2+2HCl=== CaCl2+2H2O
⑨________________________________⑩____________________⑪____________________________________
MgCl2+2NaOH=== Mg(OH)2↓+2NaCl
粗盐中难溶性杂质的去除(烟台:2020.18(2),淄博2020.17)
1. 实验用品(1)仪器:托盘天平、烧杯、玻璃棒、蒸发皿、坩埚钳、酒精灯、漏斗、药匙、量筒、胶头滴管、铁架台(带铁圈)、滤纸、剪刀。(2)药品:蒸馏水、粗盐。
2. 实验步骤[烟台:2020.18(2),淄博:2020.17]
(1)称量:称量粗盐应用托盘天平,按“左物右码”的原则。粗盐和砝码下应垫质量相同的称量纸。(2)溶解:称取一定量粗盐于烧杯中,再用量筒量取一定量的水,倒入烧杯中,用________不断搅拌,直到粗盐不再溶解为止。
(3)过滤:将烧杯中的液体沿玻璃棒倒入过滤器,进行过滤。若滤液浑浊,应____________。(4)蒸发:将蒸发皿放到铁架台的铁圈上,将滤液倒入蒸发皿中,用酒精灯加热,并用玻璃棒不断搅拌;待蒸发皿中出现_________时,停止加热,利用余热将其蒸干。
(5)计算产率:用_______将蒸发皿中的晶体转移到纸上称量,并计算精盐的产率。计算公式:产率= ×100%
4. 实验反思(1)过滤后滤液仍然浑浊的原因是:①__________;②____________________;③______________________。(2)溶解、过滤、蒸发过程中都用到玻璃棒,但不同操作中玻璃棒的作用不同;①溶解:_________________;②过滤:_______;③蒸发:________________________________________。
搅拌,防止因局部温度过高造成液滴飞溅
例 如图是某实验小组进行粗盐中难溶性杂质去除的实验的操作,回答下列问题:(1)除去粗盐中泥沙的原理是__________________________。(2)该实验的正确操作顺序是___________。
氯化钠和泥沙的溶解性不同
(3)操作④中,应先将上层清液倒入过滤器,然后倒入混有沉淀的液体,以免__________________,使过滤速度过慢;在此过程中,若倾倒液体时液面高于滤纸边缘(其他操作均正确),则得到的精盐质量会_____(选填“偏大”“不变”或“偏小”)。
(4)操作⑤中,需不断用玻璃棒进行搅拌的目的是_______________________________,当观察到蒸发皿内出现_________时,停止加热,利用余热将其蒸干。
(5)上述操作的过程中都使用了同一种玻璃仪器的是操作_______(填序号),该仪器名称是________。
(6)若同学们用提纯得到的精盐配制了100 g 10%的氯化钠溶液。经检测溶质质量分数偏小,其原因可能是________(填序号)。①氯化钠固体仍然不纯②称量精盐时砝码端忘垫质量相同的纸片③量取水配制溶液时,仰视读数④装瓶时,有少量溶液洒出
(7)[创新设问]如下是氯化钠的溶解度数据:①从NaCl的溶解度与温度的关系看,在结晶过程中,不采用冷却热饱和溶液的方法获得晶体,理由是_________________________________。
氯化钠的溶解度受温度变化影响较小
②20 ℃时,提纯10 g 粗盐,溶解时加入水的合适的量约为____(选填“15”“30”或“60”)mL,理由是____________________________________________________________________________________________________________________________________________________。
20 ℃时,氯化钠的溶解度为36.0 g,实验中称取的粗盐质量为10 g,加入约30 mL水既可使粗盐中的氯化钠充分溶解,又不会因加水过多而影响后续蒸发操作的效率
食盐中可溶性杂质的去除
1. 实验原理除去难溶性杂质后的食盐水中还需除去Na2SO4、CaCl2和MgCl2等杂质后才得到精盐水,最后经蒸发结晶即得到较为纯净的氯化钠晶体。
(2)加入不同试剂后,除去的杂质及相应的化学方程式
Na2SO4+BaCl2 === BaSO4↓+2NaCl
2NaOH+MgCl2===Mg(OH)2↓+2NaCl
Na2CO3+BaCl2 ===BaCO3↓+2NaCl
HCl+NaOH === NaCl+H2O
Na2CO3+2HCl === 2NaCl+H2O+CO2 ↑
(1)能否用K2CO3代替Na2CO3除去杂质,并说明原因______________________________。(2)可以用_________溶液代替NaOH溶液和BaCl2溶液除去粗盐中的可溶性杂质。(3)除杂时加入试剂的顺序除了上述顺序还可以是:①________________________________;②________________________________。
BaCl2 → Na2CO3 → NaOH → HCl
NaOH → BaCl2 → Na2CO3 → HCl
例 现有一包除去不溶性泥沙的粗盐,其中含有少量氯化镁、硫酸钠。为获得纯净的氯化钠,设计如下实验方案,回答下列问题。
(1)沉淀A是_________,沉淀B的成分有___种。
(2)步骤②中加入过量NaOH溶液发生反应的化学方程式是____________________________________;步骤④中加入过量BaCl2溶液的目的是____________;步骤②和步骤④中的试剂可以用一种试剂代替,该试剂的名称是_____________。
2NaOH+MgCl2 === Mg(OH)2 ↓+2NaCl
(3)步骤⑤中加入Na2CO3溶液除去的离子是_____(填离子符号);(4)上述实验方案中所发生的复分解反应共有___个。
(5)步骤⑥和⑧的操作中均用到的玻璃仪器是________,其作用分别是_____、_____________________________________,若该实验不进行步骤⑥,直接加入稀盐酸,对实验是否有影响,并说明理由___________________________________________________。
有影响,加入的稀盐酸溶解了碳酸钡沉淀,又引入了Ba2+
(6)若该实验中调换“NaOH溶液”与“BaCl2溶液”的加入顺序,对除杂结果也不产生影响。你_____(填“同意”或“不同意”)此观点。(7)若步骤⑦中加入的稀盐酸不慎过量,对氯化钠的纯度____(填“有”或“无”)影响,理由是_______________________________________。(8)实验所得氯化钠的质量大于粗盐中NaCl的质量,原因是________________________。
氯化氢具有挥发性在蒸发过程中会受热挥发
1. (2021泰安16题1分)海水是一种重要资源,利用海水可制取金属镁等物质。某化学兴趣小组的同学设计了如下实验流程进行实验:
海水“制镁”(烟台3考,济宁:2019.22)
分析该流程图,下列说法错误的是( )A. 操作Ⅰ、操作Ⅲ都需用到的玻璃仪器是玻璃棒B. 固体B是Mg(OH)2,试剂X是稀盐酸C. 加入的NaOH溶液应过量,其目的是使MgCl2完全反应D. 处理等量海水,若将NaOH溶液换成石灰乳,既能节约成本又能提高镁的产量
(1)加入NaOH溶液后,操作Ⅰ是______。(2)无水MgCl2在通电的条件下分解生成Mg和Cl2,其反应的化学方程式为____________________。
2. (2020青岛30题8分)2020年6月8日是第12个“世界海洋日”,海洋是巨大的资源宝库。某课题小组模拟工业海水提镁的流程,在实验室制取生产镁的原料——氯化镁, 设计方案如下:【信息】 1.海水和苦卤中都含有NaCl、Na2SO4、MgCl2、CaCl2、 KCl等。2.苦卤是海水晒盐后剩余的溶液。3.下表是某品牌不同碱的价格。
请分析与计算。(1)海水和苦卤都可以作为制取氯化镁的原料,甲同学提出选择苦卤更好,小组同学一致同意他的观点,理由是__________________________。(2)在工业生产中为了降低成本,试剂X最好选择表格中的__________。(3)该方案制取氯化镁时,要经历步骤Ⅰ和步骤Ⅱ两步转化,其主要目的是____________。
镁离子富集浓度高,成本低
(4)小组同学按上述方案进行了实验,并制得19.0 g干燥纯净的氯化镁固体。若步骤Ⅱ中溶质质量分数为10%的稀盐酸与氢氧化镁恰好完全反应,且步骤Ⅲ中氯化镁没有损失,求步骤Ⅱ中消耗稀盐酸的质量(写出计算步骤)。
3. (2019滨州23题4分)结合下图仪器,完成粗盐提纯实验中的有关问题。(1)仪器①的名称是________。(2)在过滤粗盐水时,除用到⑤⑥⑧,还需用到图中的一种玻璃仪器是_____(填名称)。(3)蒸发结晶食盐,除用到①②⑧⑨,还需用到图中的仪器有___(填序号)。
(4)下列有关蒸发结晶操作描述正确的是____。A. 当加热至有晶体析出时,即停止加热B. 当蒸发皿中出现较多固体时,即停止加热C. 当水分完全蒸干时,即停止加热D. 蒸发皿应放在石棉网上加热,防止破损
4. (2020淄博17题4分)小明同学要除去粗盐样品中的少量泥沙(已知:20 ℃时氯化钠的溶解度是36.0 g),实验过程如图所示:请回答:20 ℃时,小明要溶解10.0 g粗盐样品,需量取____mL的水较为恰当(选填15、30或45),充分溶解后形成_______溶液(填“饱和”或“不饱和”),操作Ⅱ的名称是______。下列说法正确的是___(填字母)。a. 蒸发需要的仪器是酒精灯、蒸发皿、温度计b. 溶解和蒸发需要搅拌的目的是防止食盐飞溅c. 蒸发过程就是通过加热的方法将水汽化除去
5. (2019淄博18题4分)实验室有一瓶除去难溶性杂质的粗盐样品,其中还含有少量的氯化镁和氯化钙。为了得到较纯净的食盐晶体,同学们设计如下实验方案,请你参与他们的实验探究。
(1)实验过程中,向粗盐水中先加入过量的氢氧化钙溶液,再加入过量的碳酸钠溶液,依次加入的目的是__________________________________
_________,写出两种盐之间发生反应的化学方程式__________________________________。(2)实验过程中,用到的操作有_____________________,得到食盐晶体时,应在_______中进行。
先除去氯化镁,再除去氯化钙和过量的氢氧化钙
Na2CO3+CaCl2=== 2NaCl+CaCO3↓
(3)实验中加入盐酸发生反应的化学方程式为___________________________(任写一个)。(4)实验中①和②加入的顺序是否可以调换,并说明理由:__________________________________________________________。
不可以,①和②调换顺序会引入钙离子,且后续操作无法除去
6. (2018济宁13题3分)海水晒制粗盐的主要成分为NaCl,还含有少量的MgCl2、CaCl2、MgSO4、泥沙等杂质。如图是由粗盐获取较纯净精盐的一种方法:
请分析流程图示,回答:(1)为除去MgCl2、CaCl2、MgSO4可溶性杂质,操作Ⅰ中依次加入的物质(过量)和顺序,合理的是_____。A. NaOH、BaCl2、Na2CO3 B. Ba(NO3)2、Na2CO3、NaOHC. Na2CO3、BaCl2、NaOH D. BaCl2、NaOH、Na2CO3
(2)操作Ⅰ过量加入各物质的目的是_______________________________。(3)为获取较纯净精盐,操作Ⅱ的具体方法是________________。
7. (山东真题组合)我国科学家侯德榜在氨碱法的基础上创立了更为先进的联合制碱法(侯氏制碱法),其生产流程简明如下:
海水“盐”(烟台3考,淄博:2019.9①,东营2考,济宁:2019.14)
请读识流程图并回答下面问题:(1)写出沉淀池中发生反应的化学方程式____________________________________________。[济宁:2019.14(1)](2)上述流程中气体X的化学式是_____。[济宁:2019.14(2)](3)如何取出从沉淀池中不断结晶析出的碳酸氢钠:______(填操作名称);碳酸氢钠在生产生活中的用途:_________(写出一种即可)。[枣庄:2018.35(2)]
(4)试写出焙烧炉中发生反应的化学方程式____________________________________。
8. (2021东营17题9分)海洋是人类宝贵的自然资源,海水“晒盐”和海水“制碱”体现了人类利用和改造自然的智慧。请根据粗盐“制碱”的流程图(如下图)回答问题:
(1)步骤Ⅰ除杂中,常见的方法有两种:一是物理方法,即用NaCl溶液浸洗粗盐,溶解除去其中的可溶性杂质,则浸洗溶液应选用NaCl的______、(填“饱和”或“不饱和”)溶液;二是化学方法,操作步骤依次为:加水溶解→加过量试剂①→加过量试剂②→过滤→加适量盐酸,以下试剂①②组合选用合理的是_____。A. ①Ca(OH)2②Na2CO3B. ①Na2CO3 ②Ca(OH)2C. ①KOH ②Na2CO3D. ①NaOH ②Na2CO3
(2)步骤Ⅲ先向饱和食盐水中通入氨气,再通入二氧化碳,这样做的目的是____________________,写出步骤Ⅲ反应的化学方程式_________________________________________。
NH3+H2O+CO2+NaCl=== NaHCO3+NH4Cl
(3)步骤Ⅳ发生的反应属于_____反应(填基本反应类型)。(4)我国化学家侯德榜创立的联合制碱法的优点有_____。A. 无“索尔维氨碱法”中的废弃物CaCl2生成,有利于保护环境B. 大大提高了食盐的利用率,节约了成本C. 将“制碱”与制氨生产联合起来,同时析出的NH4Cl晶体可用作复合肥
9. (2018泰安19题1分)从海水中制备纯碱和金属镁的流程如图所示:
海水化学的综合考查(烟台4考,东营:2021.17,济宁:2020.14)
下列说法错误的是( )A. 流程Ⅰ中依次向粗盐水中加入过量Ca(OH)2溶液、Na2CO3溶液和适量稀盐酸去除杂质B. 流程Ⅱ吸氨是使溶液呈碱性,有利于吸收二氧化碳C. 上述流程涉及到三种基本反应类型D. 流程Ⅳ、Ⅴ是通过化学方法富集氯化镁
10. (2020烟台18题10分)烟台海洋资源丰富,是国家海水综合利用示范城市。近年来烟台坚持新发展理念,科学经略海洋,高质量发展海洋综合产业。(1)海水淡化。蒸馏法是常用的海水淡化方法,该方法是利用混合体系中各物质的______不同,将物质进行分离。
(2)海水晒盐。①利用盐田法晒盐,盐田通常分为蒸发池和结晶池两部分。下列说法正确的是_____(填字母序号)。A. 在蒸发池中水蒸发所需能量主要为太阳能和风能B. 在结晶池中主要通过降温结晶使氯化钠析出C. 当氯化钠晶体析出时,结晶池中的溶液为氯化钠的饱和溶液②粗盐中常含有泥沙等难溶性杂质。在实验室中除去粗盐中的难溶性杂质,可依次通过溶解、_____、蒸发结晶等操作。蒸发结晶操作中要用到玻璃棒,其作用是___________________________________。
搅拌,防止局部温度过高造成液滴飞溅
(3)海水制镁。为了使海水中含量较低的镁元素富集,工业生产中通常向海水或卤水中加入________(写化学式)使海水中的氯化镁转化为沉淀,该反应的基本反应类型是________反应,此过程富集镁元素的同时也达到了_____的目的。(4)海水制碱。氨碱法制纯碱是将饱和氨盐水在加压并不断通入二氧化碳的条件下使碳酸氢钠结晶析出,此过程发生反应的化学方程式是___________________________________________。将碳酸氢钠固体加热分解即得到纯碱。向滤出碳酸氢钠晶体后的NH4Cl溶液中加入熟石灰,可以回收______以循环使用。
NaCl+NH3+CO2+H2O=== NaHCO3+ NH4Cl
11. (2021烟台18题11分)2021年6月8日是第13个“世界海洋日”。烟台有漫长的海岸线,蕴藏着丰富的海洋资源。某兴趣小组设计的综合利用海水的部分流程图如下。据图回答:
(1)海水制镁。步骤①②③是利用母液制镁的流程,该流程中发生中和反应的化学方程式是_________________________________。步骤①中制取氢氧化镁选择向母液中加入石灰乳,而不是向海水中直接加入石灰乳,原因是___________________。
(2)海水晒盐。 通常采用______(填“降温”或“蒸发”)结晶的方法使海水中的氯化钠析出。通过步骤④除去粗盐溶液中含有的MgCl2、Na2SO4、CaCl2等可溶性杂质,需要依次加入过量的BaCl2溶液、过量的Na2CO3溶液、过量的NaOH溶液,然后过滤,在滤液中加入适量的稀盐酸。其中加入过量的Na2CO3溶液的目的是______________________________________。
除去粗盐溶液中的钙离子和过量的钡离子
(3)海水制碱。步骤⑧⑨是氨碱法制纯碱的流程,步骤⑧中需要向NaCl饱和溶液中先后加入的两种物质是___________(写化学式)。步骤⑨中发生反应的化学方程式是_________________________________。
(4)步骤⑥是电解NaCl饱和溶液制取烧碱,该反应中的反应物是__________。(5)步骤⑦用烧碱低温制取次氯酸钠的反应原理为:Cl2+2NaOH=== X+NaClO+H2O,则X的化学式是______。
12. (2017烟台18题7分)十三五期间,烟台将建设大型海水淡化厂。绿色生态、综合利用海洋资源将是设计的重点。如图是某设计院设计的综合利用海水的流程图。据图回答问题。(1)反渗透膜法与滤纸过滤法在原理上都是利用混合体系中各物质的_________不同进行分离的方法。(2)过程③是氨碱法制纯碱的一个流程,需要向饱和的食盐水中先后加入的两种物质是___________(写化学式)。
(3)过程④采用蒸发结晶的方法,而不采用冷却热饱和溶液的方法,原因是_________________________________。(4)如果要充分利用海边贝壳资源,过程⑤生成氢氧化镁的化学方程式是_____________________________________。
氯化钠的溶解度随温度升高变化不大
Ca(OH)2+MgCl2=== Mg(OH)2↓+CaCl2
相关课件
这是一份2022年中考化学第一轮系统复习第七讲溶液课时1溶液的形成及定量表示课件PPT,共53页。PPT课件主要包含了一定温度,不能继续,还能继续,饱和溶液,增加溶剂,增加溶质,混合物,均一性,稳定性,无明显变化等内容,欢迎下载使用。
这是一份2022年中考化学第一轮系统复习---第十讲金属(第2课时金属的化学性质)课件PPT,共50页。PPT课件主要包含了浅绿色,金属活动性顺序,CuSO4,Fe2O3,CuO,CuOH2,酸的种类不同,答案B,Fe>R>Cu,不能燃烧等内容,欢迎下载使用。
这是一份2022年中考化学一轮复习第九讲海水中的化学课时2常见的盐课件PPT,共20页。PPT课件主要包含了小苏打,纯碱的化学性质,产生气泡,有白色沉淀生成,金属离子,酸根离子,调味品,二氧化碳,FeSO4+Cu,有蓝色沉淀生成等内容,欢迎下载使用。









