



还剩21页未读,
继续阅读
2022年中考化学一轮专题复习专题7 溶解度曲线及溶解度表课件PPT
展开这是一份2022年中考化学一轮专题复习专题7 溶解度曲线及溶解度表课件PPT,共29页。PPT课件主要包含了答案B,增加溶质乙,不饱和,乙>甲,降温结晶,蒸发结晶,升温结晶,降低温度,升高温度,增加溶剂等内容,欢迎下载使用。
考向1 溶解度曲线1. (2021河南改编)如图是KNO3和 NaCl的溶解度曲线。下列说法正确的是( )A. KNO3的溶解度大于NaCl的溶解度B. t ℃时,两种物质的饱和溶液中溶质的质量分数相等C. 30 ℃时,30 g NaCl加入到100 g水中可得到饱和溶液D. 将t ℃等质量NaCl、KNO3的饱和溶液升温到50 ℃,溶液中KNO3的质量大于NaCl
2. M、N两种固体的饱和溶液溶质的质量分数(w/%)与温度(T/℃)的关系如图所示。下列说法正确的是( )A. t ℃时,100 g水最多溶解40 g固体NB. M、N两种物质的溶解度均随温度的升高而增大C. P点溶液处于饱和状态D. M中混有少量N,提纯M可采用蒸发结晶的方法
现分别向50 g M、80 g N固体中各加入150 g水,并加热至完全溶解,同时各蒸发掉50 g水,冷却至t ℃,下列分析正确的是___(填序号)。a. 只有N析出晶体b. M、N两种溶液的溶质质量分数相等c. 只有M析出晶体d. M、N均有晶体析出e. t ℃时,M、N两种物质的溶解度相同
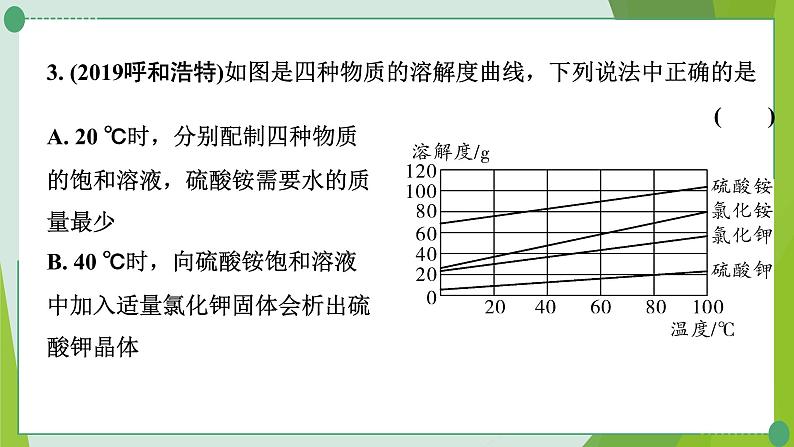
3. (2019呼和浩特)如图是四种物质的溶解度曲线,下列说法中正确的是( )
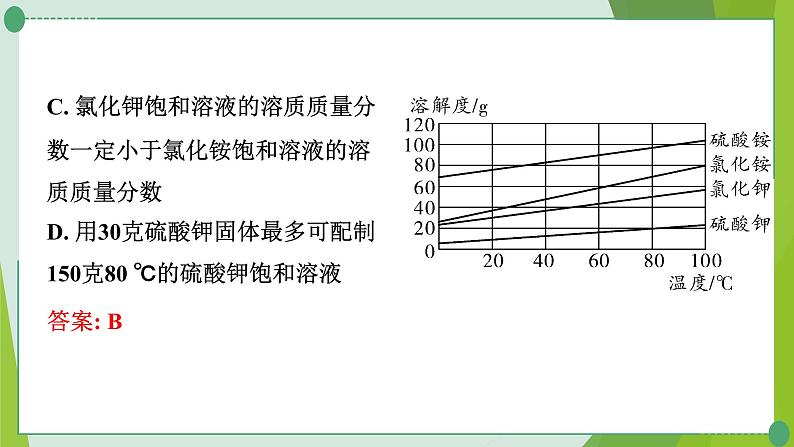
A. 20 ℃时,分别配制四种物质的饱和溶液,硫酸铵需要水的质量最少B. 40 ℃时,向硫酸铵饱和溶液中加入适量氯化钾固体会析出硫酸钾晶体
C. 氯化钾饱和溶液的溶质质量分数一定小于氯化铵饱和溶液的溶质质量分数D. 用30克硫酸钾固体最多可配制150克80 ℃的硫酸钾饱和溶液
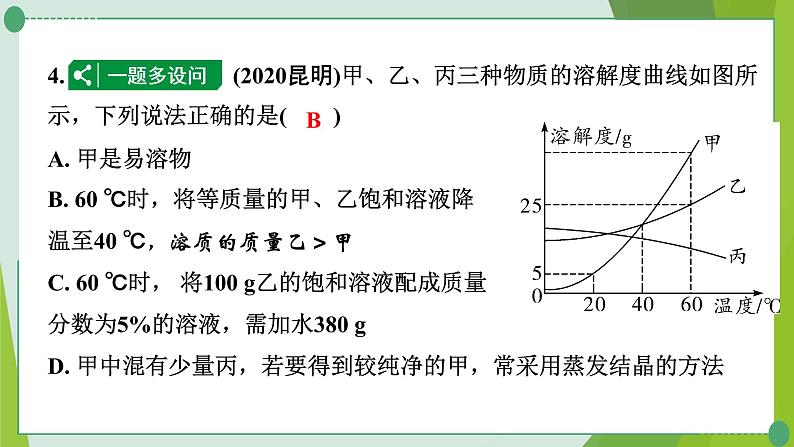
4. (2020昆明)甲、乙、丙三种物质的溶解度曲线如图所示,下列说法正确的是( )A. 甲是易溶物B. 60 ℃时,将等质量的甲、乙饱和溶液降温至40 ℃,溶质的质量乙>甲C. 60 ℃时, 将100 g乙的饱和溶液配成质量分数为5%的溶液,需加水380 gD. 甲中混有少量丙,若要得到较纯净的甲,常采用蒸发结晶的方法
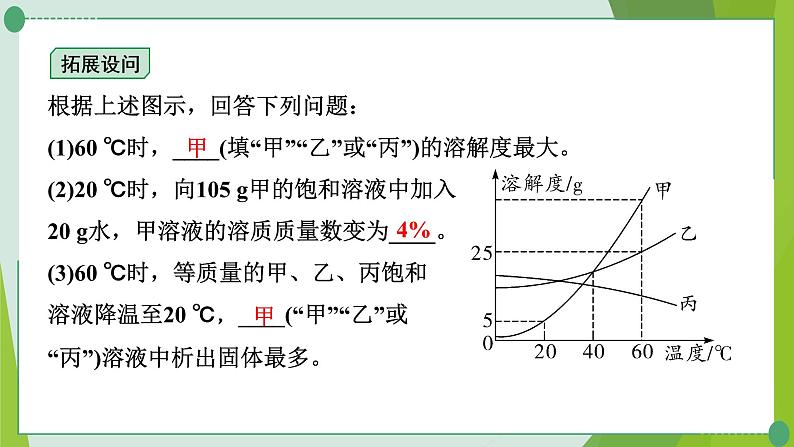
根据上述图示,回答下列问题:(1)60 ℃时,____(填“甲”“乙”或“丙”)的溶解度最大。(2)20 ℃时,向105 g甲的饱和溶液中加入20 g水,甲溶液的溶质质量数变为____。(3)60 ℃时,等质量的甲、乙、丙饱和溶液降温至20 ℃,____(“甲”“乙”或“丙”)溶液中析出固体最多。
(4)下列说法正确的是___(填序号)。a.40 ℃时,甲、乙、丙三种溶液的溶质质量分数的大小关系为甲<乙<丙b.60 ℃时,将等质量的甲、乙、丙三种物质分别加水溶解配成饱和溶液,所得溶液质量大小关系为甲<乙<丙c.将60 ℃时100 g溶质质量分数为3%的甲溶液降温至20 ℃,有晶体析出
5. (2021长沙改编)甲、乙两种固体物质的溶解度曲线如图所示。(1)t1 ℃时,甲、乙两种物质的溶解度_____(填“相等”或“不相等”)。(2)两种物质中,____的溶解度受温度的影响较大。(3)要使接近饱和的乙溶液变成饱和溶液,可采用的方法有___________(写一种即可)。
考向2 溶解度表6. 不同温度时,NaCl固体的溶解度如下表所示:20 ℃时,将50 g NaCl固体加入盛有100 g水的烧杯中,充分溶解得到溶液。下列说法错误的是( )A. 烧杯中溶液的质量为150 g B. 所得溶液为饱和溶液C. 烧杯中剩余固体的质量为14 g D. 所得溶液中溶质质量分数约为26.5%
7. KCl和KNO3在不同温度下的溶解度数据如表所示,下列说法中正确的是( )A. 60 ℃时,100 g水中最多溶解45.5 g KClB. 随着温度的升高,某饱和KCl溶液中会有固体析出C. KNO3的溶解度始终大于KClD. 60 ℃时,KNO3溶液中溶质的质量分数一定为 ×100%
考向3 实物流程图8. 一定温度下,对固体甲的溶液进行恒温蒸发,实验记录如下:根据上述实验,不能得到的结论是( )A. ①②溶液为不饱和溶液B. 固体甲在该温度下的溶解度为15 gC. 固体甲的溶解度随温度的升高而增大D. ①~④溶液的溶质质量分数:①<②<③=④
一、溶解度曲线命题点1 物质溶解性的判断甲物质____(填“易”“可”“微”或“难”)溶于水。
命题点2 点的含义、溶解度大小的判断及比较(6考)(1)A点表示15 ℃时甲物质的_______(填“饱和”或“不饱和”)溶液,表示乙物质的饱和溶液的点是____(填字母)。(2)B点表示的含义为______________________________________。(3)30 ℃时,甲物质的溶解度为_____。(4)15 ℃时,甲、乙两种物质的溶解度大小关系为_______。
20 ℃时,甲、乙的溶解度相等,均为0.6 g
命题点3 物质溶解度随温度变化的情况(3考)(1)甲、乙两物质的溶解度随温度的升高而_____(填“增大”或“减小”,下同),丙物质的溶解度随温度的升高而_____。(2)甲、乙两物质中溶解度受温度变化影响较大的为____。
命题点4 物质结晶或提纯方法的判断(5考)(1)若甲中混有少量乙(或丙)时,提纯甲所用的方法为_________。(2)若乙中混有少量甲时,提纯乙的方法为_________。(3)若丙中混有少量甲(或乙)时,提纯丙的方法为_________。
(1)t1 ℃时将10 g甲加入到100 g水中,充分溶解后得到的溶液是_____(填“饱和”或“不饱和”,下同)溶液。(2)t3 ℃时将5 g乙加入50 g水中,充分溶解后得到的溶液是_______溶液。
命题点5 饱和溶液与不饱和溶液的判断及转化(3考)
(3)将t2 ℃时丙的饱和溶液升温到t3 ℃,得到的溶液是______溶液。(4)t2 ℃时,将甲、乙各15 g分别加入100 g水中,充分溶解后升高温度,还会继续溶解的是_____物质。(5)t1 ℃时,将甲的不饱和溶液转化为饱和溶液的方法是________________________。(6)将接近饱和的乙溶液转化为饱和溶液的方法是__________。
增加溶质(或恒温蒸发溶剂)
(7)将丙的不饱和溶液转化为饱和溶液的方法是_________。(8)甲溶液由点P→N的过程中,溶液由______溶液变为________溶液,可采用的方法是__________;由点N→M的过程中可采用的方法是__________。
命题点6 溶液、溶剂、溶质质量及溶质质量分数的计算及比较(4考)(1)t2 ℃时,50 g水中溶解______g甲恰好形成饱和溶液。(2)t1 ℃时,将60 g丙加入100 g水中,充分溶解所得溶液的质量为____g,溶质质量分数为______(精确至0.1%)。(3)t2 ℃时,甲的饱和溶液的溶质质量分数为______,将100 g甲的饱和溶液配制成10%的溶液,需加水____g。
(4)t3 ℃时,甲、乙、丙的饱和溶液的溶质质量分数由大到小的顺序为____________。(5)t1 ℃时,配制等质量的甲、乙的饱和溶液,所需溶剂的质量关系为_______。(6)t3 ℃时,将等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液的质量由大到小的顺序为__________。
命题点7 改变温度时溶液中相关量的变化(5考)(1)将t3 ℃等质量的甲、乙、丙的饱和溶液同时降温到t1 ℃,下列说法一定正确的是____(填字母)。A. 溶质质量分数:丙>乙>甲 B. 溶剂质量:丙>甲=乙C. 溶液质量:丙>乙>甲 D. 溶质质量:甲>乙>丙E. 析出晶体质量:甲=乙=丙
(2)t2 ℃时将等质量的甲、丙两种物质的饱和溶液升温到t3 ℃,两种物质的溶质质量分数的大小关系为______,有固体析出的是____。
二、溶解度表K2CO3和KNO3在不同温度时的溶解度如下表。下列说法不正确的是( )
A. 两种物质的溶解度均随温度的升高而增大B. 30 ℃时,KNO3饱和溶液的溶质质量分数为45.8%
C. 80 ℃时,239 g K2CO3的饱和溶液中溶质的质量为139 gD. 在60~80 ℃之间的某一温度下,K2CO3和KNO3的溶解度相等
三、实物流程图已知20 ℃时,硝酸钾的溶解度为31.6 g,40 ℃时,硝酸钾的溶解度为63.9 g。按如图所示操作后得到相应的溶液①~③。下列说法不正确的是( )A. 只有①是饱和溶液B. ②中溶液的质量为160 gC. 溶质质量分数②<③D. ③中溶质与溶剂的质量比为63.9∶100
列表法:(1)当溶剂为100 g水时








