





2022版中考化学大一轮培优训练及课件微专题2 溶解度曲线及其应用课件
展开
这是一份2022版中考化学大一轮培优训练及课件微专题2 溶解度曲线及其应用课件,共26页。PPT课件主要包含了乙>甲,不饱和溶液,加热结晶,~30,蒸发结晶,饱和溶液,降温结晶,氯化钡溶液,氯化钠或NaCl,氯化钠等内容,欢迎下载使用。
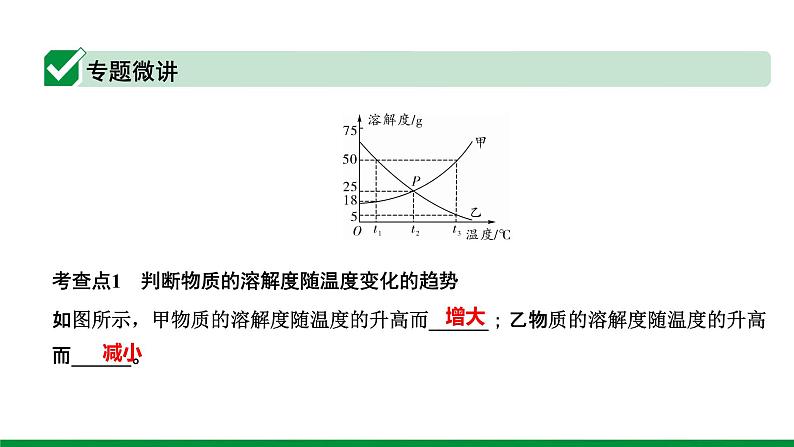
考查点1 判断物质的溶解度随温度变化的趋势
如图所示,甲物质的溶解度随温度的升高而______;乙物质的溶解度随温度的升高而______。
考查点2 某温度下物质的溶解度及溶解度大小的判断与比较
如图所示,t1 ℃时,乙的溶解度是____g,甲、乙两种物质的溶解度由大到小的顺序为_________,t2 ℃时,甲、乙的溶解度相等,均为____g。
考查点3 饱和溶液与不饱和溶液的判断
如图所示,(1)t3 ℃时将60 g甲物质加入到150 g水中,得到的是___________(填“饱和溶液”或“不饱和溶液”,下同)。(2)将t1 ℃时甲的饱和溶液升温至t3 ℃,得到的是___________。
考查点4 饱和溶液与不饱和溶液的转化
如图所示,(1)将t3 ℃时甲的不饱和溶液转化为饱和溶液,可采用的方法是________________________________。
降低温度(或增加溶质或蒸发溶剂)
(2)将t1 ℃时乙的饱和溶液转化为不饱和溶液,可采取的方法是____________________。(3)将甲的饱和溶液转化为不饱和溶液的方法是_______________________。(4)将乙的不饱和溶液转化为饱和溶液的方法是_______________________________。
考查点5 某温度下溶液中溶质质量分数的计算
如图所示,(1)t2 ℃时在150 g水中加入100 g乙物质,所得溶液的溶质质量分数为______。(2)t2 ℃时甲的饱和溶液的溶质质量分数为_____。(3)t1 ℃时甲、乙的饱和溶液溶质质量分数的大小关系为_________。(4)t3 ℃时将甲、乙的饱和溶液降温至t2 ℃,所得溶液中溶质质量分数大小关系为________。
增加溶剂(或降低温度)
增加溶剂(或升高温度)
增加溶质(或升高温度或蒸发溶剂)
考查点6 判断物质结晶或提纯的方法
如图所示,(1)当甲中混有少量的乙时,提纯甲所用的方法为_______________________________。(2)当乙中混有少量的甲时,提纯乙所用的方法为___________。
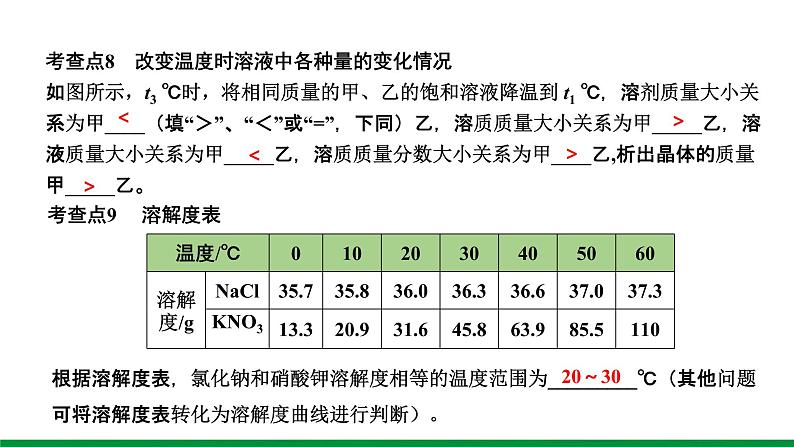
考查点7 一定温度下配制饱和溶液时,溶剂质量与溶质质量的大小比较t3 ℃时,相同质量的甲、乙两种物质配制成各自的饱和溶液时,所需溶剂的质量大小关系为甲____乙(填“>”、“=”或“乙
6.(2019深圳)现有t2 ℃时的溶液Ⅰ、Ⅱ各100 g,溶液Ⅰ中含物质甲50 g,溶液Ⅱ是物质乙的饱和溶液。物质甲、乙(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是( )A. t2 ℃时,溶液Ⅰ是甲的饱和溶液B. t2 ℃时,溶液Ⅰ中甲的质量分数为50%C. t2 ℃时,溶液Ⅱ中含乙 37 gD. 从t2 ℃降温至t1 ℃时,乙不会从溶液Ⅱ中析出
7.(2015厦门)甲、乙两种物质的溶解度曲线如图所示。下列说法中正确的是( )A. t1 ℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液B. t2 ℃时,甲、乙饱和溶液的溶质质量分数都为30%C. t3 ℃时,甲、乙的饱和溶液分别降温至 t1℃,甲溶液 饱和,乙溶液不饱和D. t2 ℃时,质量相同的甲、乙饱和溶液分别升温至 t3 ℃, 为达饱和状态,需加入甲的质量大于乙
8.(2019厦门5月质检)t1 ℃时,取a、b两种固体物质各25 g于两个烧杯中,分别加入100 g水,充分溶解后,两种固体均有剩余。升温到t2 ℃时,a完全溶解,b固体增多。a、b两种物质的溶解度曲线如图。下列判断正确的是( )A. 图中曲线M表示物质b的溶解度曲线B. t1 ℃时,两个烧杯中剩余固体的质量不相等C. t2 ℃时,两个烧杯中的溶液都是饱和溶液D. t2 ℃时,两个烧杯中溶液的溶质质量分数相同
9.(2019福州5月质检)在t ℃时,分别取甲、乙两固体物质的等质量溶液,恒温蒸发水分,得到蒸发水的质量(X)与析出晶体质量(Y)的关系如图所示(析出晶体不含结晶水)。下列说法正确的是( )A. t ℃时,甲的溶解度大于乙B. 点a为t ℃时甲的不饱和溶液C. t ℃时,甲的溶解度为 ×100 gD. t ℃时,乙的溶解度是 ×100 g
10.(2019河南)如图是甲、乙固体的溶解度曲线。甲、乙溶解度相等时的温度为____℃;将a1℃时等质量甲、乙饱和溶液升温到a2℃,溶质的质量为甲_____乙(填“大于”“小于”或“等于”);a2℃时,65 g甲饱和溶液稀释到20%,需加水____g。
11.(2019南平5月质检)硝酸钾、氯化钠两种物质的溶解度曲线如图所示。(1)20 ℃时,将35 g的硝酸钾加入100 g的水中充分溶解后所得溶液____(填“是”或“否”)达到饱和。
(1)40 ℃时,氯化钠的溶解度为______g。(2)碳酸钠的溶解度随温度的升高而______(填“增大”或“减小”)。在20 ℃时,将100 g的水加入30 g碳酸钠中,充分搅拌后得到的是_________(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30 ℃,该溶液的溶质质量分数为_______(计算结果精确到0.1%)。(3)10 ℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是__________________。
碳酸钠(或Na2CO3)
12.(2015福州节选)分析处理图表中的信息是学习化学的一种重要方法。下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
(1) t ℃时该重碳酸盐的溶解度为____g。(2) b、c两点所表示的溶液的溶质质量分数的大小关系为b____c(填“>”“=”或“Na2CO3>NaHCO3
相关课件
这是一份中考化学复习重难突破2溶解度曲线及其应用练习课件,共32页。PPT课件主要包含了不饱和,丙乙甲,增加溶剂,蒸发溶剂或降低温度,甲乙丙,蒸发结晶等内容,欢迎下载使用。
这是一份中考化学复习难点加强练一溶解度曲线及其应用课件,共22页。PPT课件主要包含了答案A,答案C,答案D,答案B等内容,欢迎下载使用。
这是一份2022年中考化学一轮复习---专题6溶解度曲线及其应用课件PPT,共27页。PPT课件主要包含了蒸发结晶,丙>乙>甲,KCl,冷却结晶,~20℃,不饱和,ABD,溶解度曲线,X>Y,甲和乙等内容,欢迎下载使用。








