



(全国通用)高考化学二轮热点题型归纳与变式演练 专题25 关于化学平衡的计算(解析+原卷)学案
展开【题型一】 化学平衡常数…………………………………………………………………………………1
【题型二】 反应物的转化率或产率………………………………………………………………………3
【题型三】 平衡时混合物中某一组分的质量分数(或体积分数)……………………………………8
二、最新模考题组练……………………………………………………………………………………………13
【题型一】 化学平衡常数
【典例分析】
1.加热N2O5,依次发生分解反应:①,②。在容积为2 L的密闭容器中充入8 ml N2O5,加热到t℃,达到平衡状态后O2为9 ml,N2O3为3.4 ml,则t℃时反应①的平衡常数为
A.4.25B.8.5C.17D.22.5
【答案】B
【解析】
假设发生反应①的N2O5的物质的量为x ml,反应产生N2O3为x ml,反应产生O2为x ml,反应产生的N2O3中有y ml发生反应②。则根据题目已知数据可知:x-y=3.4 ml,x+y=9 ml,解得x=6.2 ml,则平衡时c(N2O5)=;c(N2O3)=;c(O2)=,则反应 的化学平衡常数K=,故合理选项是B。
【提分秘籍】
(1)一个模式——“三段式”。
如反应mA(g)+nB(g)pC(g)+qD(g),令A、B起始物质的量浓度分别为aml·L-1、bml·L-1,达到平衡后消耗A的物质的量浓度为mxml·L-1。
mA(g)+nB(g)pC(g)+qD(g)
起始/(ml·L-1) a b 0 0
变化/(ml·L-1) mx nx px qx
平衡/(ml·L-1) a-mx b-nx px qx
K=(px)p·(qx)q(a-mx)m·(b-nx)n。
【变式演练】
1.某温度下,反应的平衡常数为,则相同温度下,反应的平衡常数为
A.B.C.D.
2.二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·ml-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
(1)该条件下反应平衡常数表达式K=___________。在T1 ℃时,反应的平衡常数为___________。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 ml·L-1、c(H2O)=0.6 ml·L-1、c(CH3OCH3)=1.2 ml·L-1,此时正、逆反应速率的大小:v正___________v逆(填“>”、“<”或“=”)。
【题型二】 反应物的转化率或产率
【典例分析】
1.在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+(g)(g)+(g)。在500℃时,平衡常数K=9,若反应开始时,一氧化碳和水蒸气的浓度都是0.02ml/L,则在此条件下CO的转化率为
A.25%B.50%C.75%D.80%
【答案】C
【解析】
由题意可以得到三段式:
已知,则x=0.015ml/L,CO的转化率,故答案为:C。
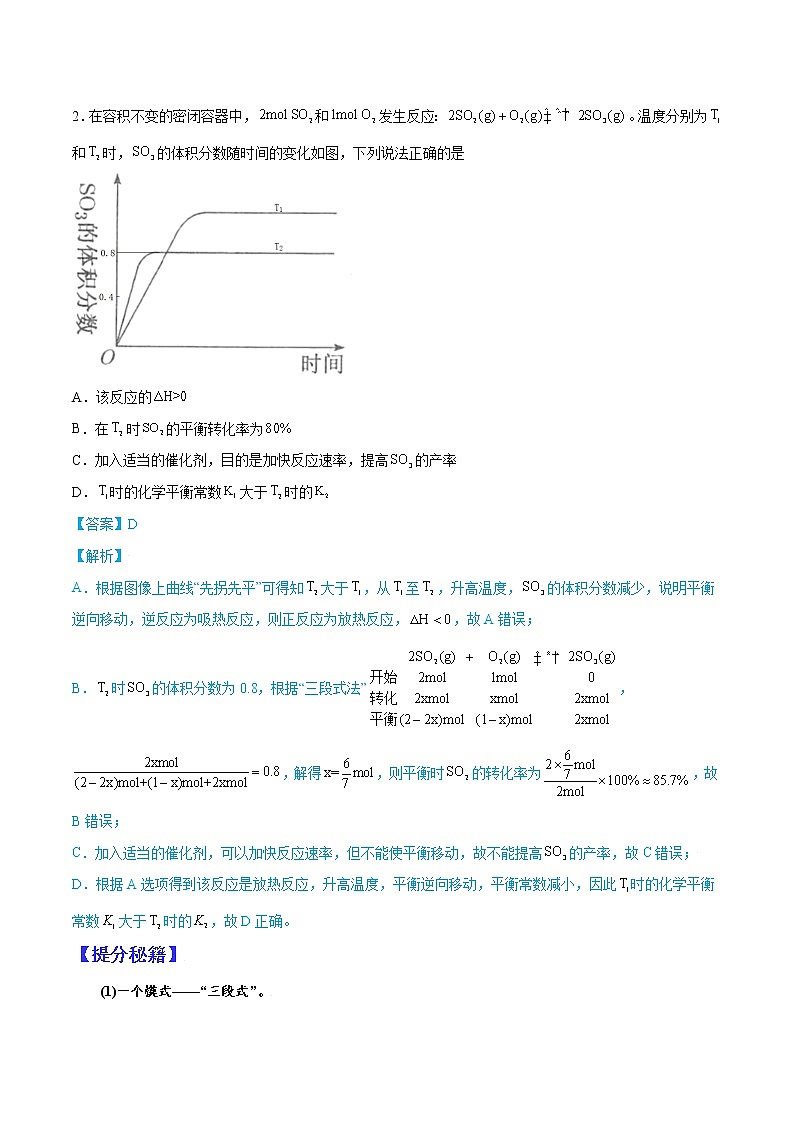
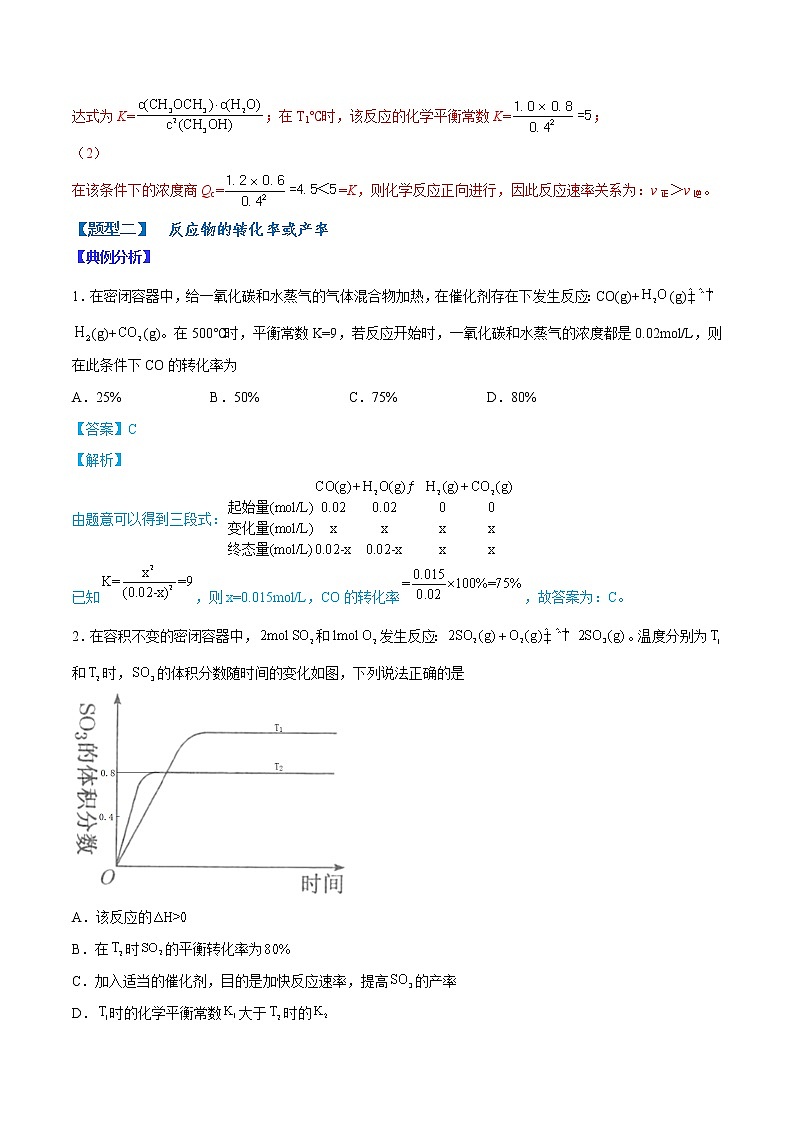
2.在容积不变的密闭容器中,和发生反应:。温度分别为和时,的体积分数随时间的变化如图,下列说法正确的是
A.该反应的
B.在时的平衡转化率为
C.加入适当的催化剂,目的是加快反应速率,提高的产率
D.时的化学平衡常数大于时的
【答案】D
【解析】
A.根据图像上曲线“先拐先平”可得知大于,从至,升高温度,的体积分数减少,说明平衡逆向移动,逆反应为吸热反应,则正反应为放热反应,,故A错误;
B.时的体积分数为0.8,根据“三段式法”,,解得,则平衡时的转化率为,故B错误;
C.加入适当的催化剂,可以加快反应速率,但不能使平衡移动,故不能提高的产率,故C错误;
D.根据A选项得到该反应是放热反应,升高温度,平衡逆向移动,平衡常数减小,因此时的化学平衡常数大于时的,故D正确。
【提分秘籍】
(1)一个模式——“三段式”。
如反应mA(g)+nB(g)pC(g)+qD(g),令A、B起始物质的量浓度分别为aml·L-1、bml·L-1,达到平衡后消耗A的物质的量浓度为mxml·L-1。
mA(g)+nB(g)pC(g)+qD(g)
起始/(ml·L-1) a b 0 0
变化/(ml·L-1) mx nx px qx
平衡/(ml·L-1) a-mx b-nx px qx
K=(px)p·(qx)q(a-mx)m·(b-nx)n。
(2)明确三个量的关系。
①三个量:即起始量、变化量、平衡量。
②关系。
a.对于同一反应物,起始量-变化量=平衡量。
b.对于同一生成物,起始量+变化量=平衡量。
c.各反应物转化量之比等于各反应物的化学计量数之比。
①反应物的转化率=n(转化)n(起始)×100%=c(转化)c(起始)×100%。
②生成物的产率:实际产量(指生成物)占理论产量的百分数。一般来讲,转化率越大,原料利用率越高,产率越大。
产率=实际产量理论产量×100%。
【变式演练】
1.某温度下,在密闭容器中发生如下反应:,若开始时充入2ml C气体,达到平衡时,混合气体的压强比起始时增大了10%;若开始时只充入2ml A和1ml B的混合气体,达到平衡时A的转化率为
A.20%B.40%C.60%D.80%
2.在某密闭容器中把CO和H2O的混合物加热到800℃,存在平衡,且平衡常数K=4。若在2L的密闭容器中充入1mlCO和1mlH2O的混合物并加热到800℃,则平衡时CO的转化率为
A.40%B.50%C.66.7%D.83.3%
3.Burns和Daintn研究发现Cl2与CO合成COCl2的反应机理如下:
①Cl2(g)2Cl·(g)快
②CO(g)+Cl·(g)COCl·(g)快
③COCl·(g)+Cl2(g)COCl2(g)+Cl·(g)慢
其中反应②存在v正=k正c(CO)c(Cl·);v逆=k逆c(COCl·),下列说法正确的是
A.反应②的平衡常数K=
B.反应①、②的活化能均大于反应③
C.要提高合成COCl2的速率,关键是提高反应①的速率
D.选择合适的催化剂能加快该反应的速率,并提高COCl2的平衡产率
【题型三】 平衡时混合物中某一组分的质量分数(或体积分数)
【典例分析】
1.在容积可变的密闭容器中,2mlN2和8mlH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于
A.5%B.10%C.15%D.20%
【答案】C
【解析】
根据题意可知,发生反应的氢气的物质的量为8ml×25%=2ml,因此可得下列“三段式”:
在同温同压下,气体的体积之比等于物质的量之比,因此平衡时氮气的体积分数等于其物质的量分数,即为≈15%。
答案选C。
【提分秘籍】
(1)一个模式——“三段式”。
如反应mA(g)+nB(g)pC(g)+qD(g),令A、B起始物质的量浓度分别为aml·L-1、bml·L-1,达到平衡后消耗A的物质的量浓度为mxml·L-1。
mA(g)+nB(g)pC(g)+qD(g)
起始/(ml·L-1) a b 0 0
变化/(ml·L-1) mx nx px qx
平衡/(ml·L-1) a-mx b-nx px qx
K=(px)p·(qx)q(a-mx)m·(b-nx)n。
(2)明确三个量的关系。
①三个量:即起始量、变化量、平衡量。
②关系。
a.对于同一反应物,起始量-变化量=平衡量。
b.对于同一生成物,起始量+变化量=平衡量。
c.各反应物转化量之比等于各反应物的化学计量数之比。
①某组分的体积分数=某一组分的物质的量混合气体总的物质的量×100%。
②平衡时混合物中某一组分的质量分数=某一组分平衡时的质量平衡时各物质的总质量×100%。
【变式演练】
1.亚硝酰氯(NOCl)常用于合成清洁剂、触媒剂及有机合成中间体等。可通过以下反应制得。按投料比把NO和Cl2加入一恒压的密闭容器中发生。上述反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图所示,实验测得,,(、分别为正、逆速率常数,只与温度有关)。下列说法错误的是
A.该反应的
B.压强为p时,M点时容器内NO的体积分数为40%
C.达平衡后,升高温度,k正增大的倍数大于k逆增大的倍数
D.若反应一直保持,M点的压强平衡常数
2.T0时,向容积为5L的恒容密闭容器中充入一定量的A(g)和B(g),发生反应:。测得反应过程中的部分数据如表所示,下列说法错误的是
A.其他条件不变,温度变为T1时,平衡时测得C的浓度为0.8ml/L,则T1>T0
B.8min时,该反应的v(正)=v(逆)
C.5min时,该反应达到平衡状态,且A、B的转化率相等
D.平衡时,C的体积分数约为42.9%
1.温度时,向容积为2L的密闭容器中加入活性炭(足量)和A,发生反应,第15min时,温度调整到,测得下列各时刻A的物质的量如下表所示。反应中没有使用催化剂,下列说法不正确的是
A.0~5min,生成B的平均速率为
B.由表中数据可知,且该反应的
C.其他条件不变,30min时加入B、C各,达到新平衡后,A的体积分数不变
D.、温度下,该反应对应的平衡常数为、,其大小顺序为
2.温度为T时,将(s)置于抽成真空的容器中,当达到平衡时,测得体系总压强为6kpa,则此条件下该反应的平衡常数Kp为
A.6B.9C.12D.36
3.在容积不变的密闭容器中发生反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,830℃时反应的平衡常数是1.0,下列说法正确的是
A.容器内的压强不变时,说明反应达到平衡状态
B.若平衡时移走CO2,则平衡向正反应方向移动,化学反应速率加快
C.830℃时,充入0.1mlCO和0.3mlH2O保持温度不变,CO平衡转化率为75%
D.1000℃时,某时刻CO2、H2、CO和H2O的浓度均为0.05ml/L,此时平衡向正反应方向移动
4.某温度下,将2 ml E和3 ml F充入一密闭容器中,发生反应:,平衡常数K等于1,在温度不变的情况下将容器的体积扩大为原来的2倍,F百分含量不发生变化,则E的平衡转化率为
A.60%B.50%C.40%D.30%
5.X、Y、Z为三种气体,把amlX和bmlY充入一密闭容器中,发生反应X+2Y2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
A.B.C.D.
6. 和的混合气体俗称合成气。利用制备合成气反应历程分两步,步骤Ⅰ:(慢反应);步骤Ⅱ:(快反应)。上述反应中为吸附性活性炭,反应历程的能量变化如图所示,下列说法错误的是
A.制备合成气总反应的
B.
C.该反应在高温下能自发进行
D.使用催化剂后,和平衡产率不改变
7.在绝热恒容的密闭容器中,通入和,发生反应:,下列说法不正确的是
A.当容器中和物质的量浓度之比保持不变时,可判断反应已达到平衡
B.当容器内的温度不再变化时,可判断反应已达到平衡
C.保持其他条件不变,在反应过程中不断将氨液化并移去液氨,可提高合成氨的产率
D.该反应可通过加入铁触媒做催化剂,降低反应所需的活化能,增加活化分子百分数,从而加快反应速率
8.下列事实不能用勒夏特列原理解释的是
A.二氧化氮转化为四氧化二氮的平衡体系,缩小容器体积后混合气体颜色加深
B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C.用钠与氯化钾共融的方法制备气态钾:
D.反应,达到化学平衡后,升高温度体系的颜色加深
9.一定条件下,将N2与H2物质的量各1ml置于1L恒容的密闭容器中发生反应,到平衡时容器内的总压强变成了原来的4/5,下列说法不正确的是
A.氮气的转化率是80%
B.氮气剩余体积占总体积的50%
C.该反应的平衡常数是3.125
D.该反应随温度升高平衡会向逆反应方向移动
10.H2S分解的热化学方程式为2H2S(g)2H2(g)+S2(g) ΔH=akJ·ml-1。向体积为1L恒容密闭容器中加入n(H2S)+n(Ar)=0.1ml的混合气体(Ar不参与反应),测得不同温度(T1>T2)时H2S的平衡转化率随比值的变化如图所示。下列说法正确的是
A.该反应的a<0
B.平衡常数K(X)>K(Y)
C.当=1,到达平衡时,H2的体积分数为
D.维持Y点时n(H2S)不变,向容器中充入Ar,H2S的平衡转化率减小
11.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将10mlCO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g)⇌COS(g)+H2(g) K=0.1,平衡后CO物质的量为8ml。下列说法正确的是
A.CO、H2S的转化率之比为1:1
B.达平衡后H2S的体积分数为29.4%
C.降低温度,COS浓度减小,表明该反应是放热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1ml,平衡不移动
12.碳单质可应用于脱硝。向容积为1L的密闭容器中加入炭(足量)和NO,模拟发生脱硝反应:C(s)+2NO(g) N2(g)+CO2(g),测得不同温度下,NO的物质的量随时间的变化如下图所示,下列有关说法不正确的是
A.该反应ΔH<0
B.正反应速率:M>N
C.T1时,若起始向容器中充入N2(g)和CO2(g)各2ml,平衡时,NO的体积分数为40%
D.T1时,0~15min时的反应速率v(CO2)=0.08ml·L-1·min-1
13.在一定温度条件下,将1 ml A和2 ml B放入容积为5 L的密闭容器中发生如下反应:A(s)+2B(g)⇌C(g)+2D(g),反应经4 min后达到平衡状态,测得容器内B物质的浓度减少了0.2 ml·L-1。下列叙述不正确的是
A.在4 min内,该反应用C的浓度变化表示的反应速率为0.025 ml·L-1·min-1
B.平衡时混合气体中B的物质的量分数为33.3%
C.平衡时A、B的转化率均为50%
D.初始压强和平衡时压强比为5:4
14.下列两组实验,将CO(g)和H2O(g)通入体积为2L的恒容密闭容器中:发生反应CO(g)+H2O(g)CO2(g)+H2(g),结合表中数据,下列说法错误的是
A.混合气体的平均相对分子质量不再变化,则反应达到平衡
B.实验1中,反应达到平衡后,CO的体积分数为40%
C.升高温度有利于提高实验1和实验2中CO的转化率
D.实验2的反应平衡常数K=
t/min
n(A)/ml
n(B)/ml
0
4.0
2.0
5
2.0
1.0
10
2.0
1.0
/℃
/℃
0
5min
10min
15min
20min
25min
30min
2.00
1.50
1.20
1.20
0.60
0.40
0.40
实验组
温度/℃
起始量/ml
平衡量/ml
达到平衡所需时间/min
H2O
CO
H2
CO
1
650
2
4
1.6
2.4
5
2
900
1
2
0.4
1.6
3
(全国通用)高考化学二轮热点题型归纳与变式演练 专题29 电化学计算的三种常用方法(解析+原卷)学案: 这是一份(全国通用)高考化学二轮热点题型归纳与变式演练 专题29 电化学计算的三种常用方法(解析+原卷)学案,文件包含全国通用高考化学二轮热点题型归纳与变式演练专题29电化学计算的三种常用方法解析版docx、全国通用高考化学二轮热点题型归纳与变式演练专题29电化学计算的三种常用方法原卷版docx等2份学案配套教学资源,其中学案共33页, 欢迎下载使用。
(全国通用)高考化学二轮热点题型归纳与变式演练 专题28 新型化学电源(解析+原卷)学案: 这是一份(全国通用)高考化学二轮热点题型归纳与变式演练 专题28 新型化学电源(解析+原卷)学案,文件包含全国通用高考化学二轮热点题型归纳与变式演练专题28新型化学电源解析版docx、全国通用高考化学二轮热点题型归纳与变式演练专题28新型化学电源原卷版docx等2份学案配套教学资源,其中学案共31页, 欢迎下载使用。
(全国通用)高考化学二轮热点题型归纳与变式演练 专题26 “等效平衡”及其应用(解析+原卷)学案: 这是一份(全国通用)高考化学二轮热点题型归纳与变式演练 专题26 “等效平衡”及其应用(解析+原卷)学案,文件包含全国通用高考化学二轮热点题型归纳与变式演练专题26“等效平衡”及其应用解析版docx、全国通用高考化学二轮热点题型归纳与变式演练专题26“等效平衡”及其应用原卷版docx等2份学案配套教学资源,其中学案共37页, 欢迎下载使用。












