

所属成套资源:中考化学二轮复习题型突破练习题(含答案)
中考化学二轮复习题型突破04《生产实际分析》练习题(含答案)
展开这是一份中考化学二轮复习题型突破04《生产实际分析》练习题(含答案),共7页。试卷主要包含了化学式要勤标记,正推逆赶出答案,遇到过量要注意,题中资料都用到,未知物质勿害怕等内容,欢迎下载使用。
题型突破(四) 生产实际分析
生产实际分析题实质是把工业上的一些生产原理结合初中化学知识进行考查。一般此类题考查的是学生对流程图的信息提取以及对题中陌生流程的综合分析能力。考查的问题多样,有生产方程式书写、元素化合价计算、反应流程中物质的作用、操作目的、可循环利用的物质等。此专题题目一般有金属类生产流程、教材原型生产流程或变形以及新生产流程。
做好生产实际分析题的关键
1.读懂实验目的是前提,带着目的做题,思路更清晰。
2.化学式要勤标记,正推逆赶出答案。
3.遇到过量要注意。
4.设备周围箭头要注意,反应物和生成物要分清。
5.题中资料都用到,未知物质勿害怕。
1.[西城一模] 氨气(NH3)是一种重要的化工原料。
(1)氨气属于________(填序号)。
A.混合物 B.纯净物 C.化合物 D.氧化物
(2)在高温和催化剂的条件下,可由氨气获得氢气,其反应类型与水电解制氢气相同。该反应的化学方程式为______________________。
(3)尿素[CO(NH2)2]可以制氨气,反应的微观示意图如下:
图T4-1
该反应的化学方程式为___________________________________。
2.[东城一模] 半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和水蒸气。半水煤气经过下列步骤转化为合成氨的原料。
图T4-2
(1)在铜作催化剂的条件下,半水煤气实现CO的转化,其反应的微观示意图如下:
图T4-3
①该反应的化学方程式为_________________________________。
②关于铜作为催化剂,下列说法正确的是______(填序号)。
A.不加入铜,该反应就不能进行
B.铜可以作为任何化学反应的催化剂
C.加入铜的目的是为了提高该反应的速率
(2)合成的氨气可以用来制造化肥硝酸铵(NH4NO3),该肥料属于化学肥料中的________肥。
3.[朝阳二模] 二氧化氯(ClO2)在生产、生活中具有广泛应用。
(1)ClO2可用于工业制备高效氧化剂、漂白剂亚氯酸钠(NaClO2)。
①ClO2中氯元素的化合价为_____________。
②工业生产NaClO2的主要反应的化学方程式为2ClO2+2X Cl2+2NaClO2 ,其中X的化学式为__________。
(2)ClO2是国际上公认的安全、无毒的消毒剂,可以快速将剧毒的氰化物氧化。ClO2与氰化氢(HCN)在气态下反应的微观示意图如下:
图T4-4
该反应生成的N2与CO2的质量比为__________。
4.[朝阳一模] 高纯度的氧化铜可用作颜料、有机合成催化剂等,图T4-5是工业用粗铜粉氧化法获取高纯度氧化铜的流程图。
图T4-5
(1)②中反应的化学方程式为_______________________________________________。
(2)洗涤固体B所用的试剂为_____________。
5.[北京] 超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意图如下:
图T4-6
(1)石灰石主要成分的化学式为__________。
(2)乳化池中,生石灰与水发生反应,其化学方程式为________________________。
(3)过筛的目的是拦截______(填“大于”或“小于”)筛孔直径的颗粒。
(4)碳化塔中反应的化学方程式为__________________________________。
6.[东城二模] 金属锰可以增强合金材料的硬度、耐磨性等。工业上通常用菱锰矿(主要成分为MnCO3)冶炼金属锰。其工艺流程如下:
图T4-7
(1)浸出是将菱锰矿与稀硫酸混合制得硫酸锰(MnSO4),反应的化学方程式是____________________________________。
(2)除去浸出液中的Fe2+,获得金属锰。这个过程中发生的主要反应有(其中NH3·H2O中各元素的化合价与NH3、H2O中各元素化合价相等):
Ⅰ.2FeSO4+MnO2+2H2SO4===MnSO4+Fe2(SO4)3+2H2O;
Ⅱ.Fe2(SO4)3+6NH3·H2O===2Fe(OH)3↓+3(NH4)2SO4;
Ⅲ.2MnSO4+2H2O2Mn+2H2SO4+O2↑。
上述三个反应中,反应前后有化合价变化的元素有______________。
(3)浸出过程中产生的气体可以用氨水吸收得到化肥碳酸氢铵,碳酸氢铵属于________肥。
(4)现代化工生产必须考虑节能减排,在上述生产①~⑤过程中,符合“减排”做法的是________。
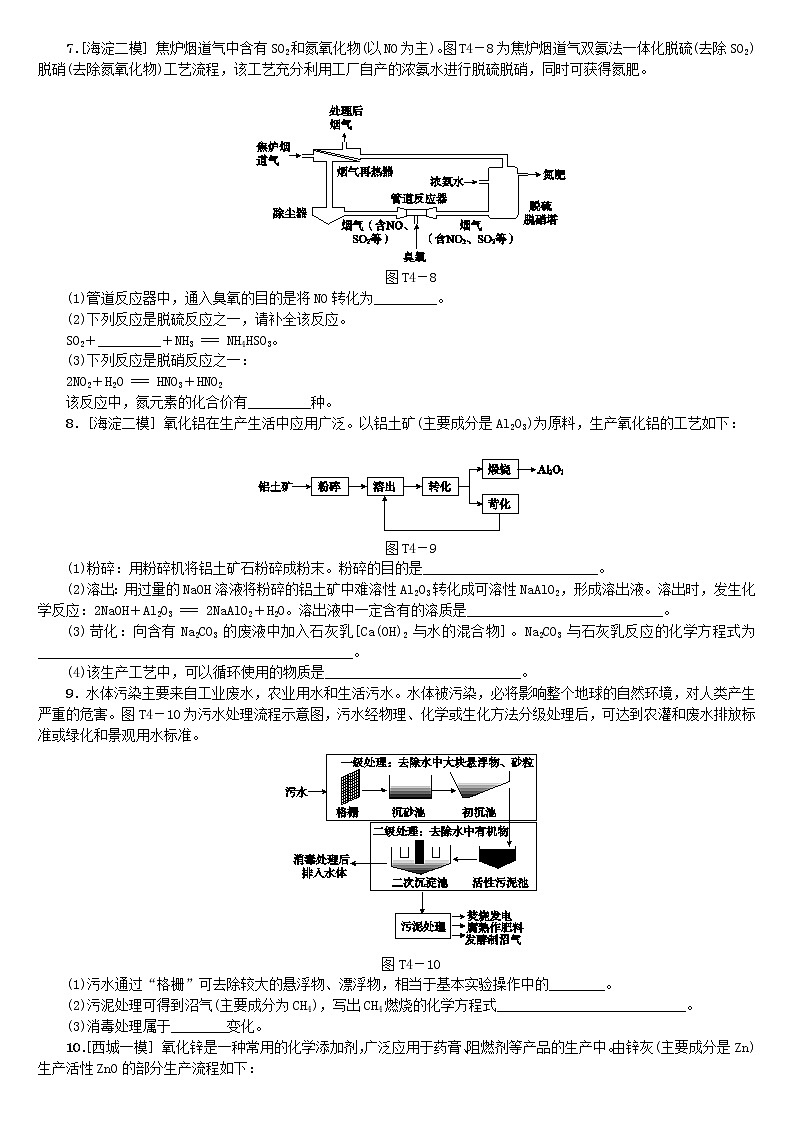
7.[海淀二模] 焦炉烟道气中含有SO2和氮氧化物(以NO为主)。图T4-8为焦炉烟道气双氨法一体化脱硫(去除SO2)脱硝(去除氮氧化物)工艺流程,该工艺充分利用工厂自产的浓氨水进行脱硫脱硝,同时可获得氮肥。
图T4-8
(1)管道反应器中,通入臭氧的目的是将NO转化为_________。
(2)下列反应是脱硫反应之一,请补全该反应。
SO2+_________+NH3 === NH4HSO3。
(3)下列反应是脱硝反应之一:
2NO2+H2O === HNO3+HNO2
该反应中,氮元素的化合价有_________种。
8.[海淀二模] 氧化铝在生产生活中应用广泛。以铝土矿(主要成分是Al2O3)为原料,生产氧化铝的工艺如下:
图T4-9
(1)粉碎:用粉碎机将铝土矿石粉碎成粉末。粉碎的目的是_________________________。
(2)溶出:用过量的NaOH溶液将粉碎的铝土矿中难溶性Al2O3转化成可溶性NaAlO2,形成溶出液。溶出时,发生化学反应:2NaOH+Al2O3 === 2NaAlO2+H2O。溶出液中一定含有的溶质是____________________________。
(3)苛化:向含有Na2CO3的废液中加入石灰乳[Ca(OH)2与水的混合物]。Na2CO3与石灰乳反应的化学方程式为_____________________________________________。
(4)该生产工艺中,可以循环使用的物质是____________________________。
9.水体污染主要来自工业废水,农业用水和生活污水。水体被污染,必将影响整个地球的自然环境,对人类产生严重的危害。图T4-10为污水处理流程示意图,污水经物理、化学或生化方法分级处理后,可达到农灌和废水排放标准或绿化和景观用水标准。
图T4-10
(1)污水通过“格栅”可去除较大的悬浮物、漂浮物,相当于基本实验操作中的________。
(2)污泥处理可得到沼气(主要成分为CH4),写出CH4燃烧的化学方程式___________________________。
(3)消毒处理属于________变化。
10.[西城一模] 氧化锌是一种常用的化学添加剂,广泛应用于药膏、阻燃剂等产品的生产中。由锌灰(主要成分是Zn)生产活性ZnO的部分生产流程如下:
图T4-11
(1)酸浸槽中,Zn与稀硫酸反应的化学方程式为_________________________________。
(2)混合溶液A中一定含有的溶质是______________________。
(3)固体B的成分可能是___________________。
11.[朝阳一模] 工业烟气脱硫就是将烟气中含有的二氧化硫除去。采用“双碱法”脱硫的工艺流程如下。
图T4-12
(1)吸收塔中,用NaOH溶液吸收SO2生成亚硫酸钠(Na2SO3)和水,NaOH溶液喷成雾状能充分吸收SO2的原因是____________________。
(2)沉淀室中发生的是复分解反应,化学方程式为___________________________________________。
(3)氧化室中,化学反应的基本类型是________________反应。
(4)已知部分原料的价格如下表所示。
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.90 |
上述工业流程中,处理相同量的SO2,双碱法所需的原料成本比用NaOH直接吸收更低,原因是___________________________________________________________________________。
12.[东城一模] 氯气(Cl2)在生产与生活中有着广泛的用途,而氯气又是一种有毒气体。因此在工业生产中要对氯气尾气进行吸收和利用,同时利用废铁屑联合生产净水剂——聚合氯化铁混凝剂。其生产工艺流程如下:
图T4-13
(1)在吸收容器内主要发生了三个化学反应:反应①为置换反应;反应②为:2FeCl2+Cl2===2FeCl3;反应③为 Fe+M→FeCl2(未配平)。
写出反应①的化学方程式________________________________________________________________________;
完成反应③的化学方程式________________________________________________________________________。
(2)在上述流程中,有________种元素化合价发生了变化。
(3)此工业生产的优点是________________________________(填写一条即可)。
13.[海淀一模] 海水中含有NaCl、Na2CO3等物质。海水脱硫技术是用海水吸收燃煤烟气中SO2。
图T4-14
(1)海水脱硫设备中,排出的海水呈碱性的是______________ (填序号)。
A.海水泵 B.吸收塔
C. 曝气池① D.曝气池②
(2)向曝气池①内通入空气后,发生的主要化学反应如下:
Ⅰ.2H2SO3+O2 === 2H2SO4;
Ⅱ.2Na2SO3+O2 === 2Na2SO4。
反应Ⅰ、Ⅱ中化合价升高的元素是_______。
(3)曝气池②排放的海水中不含H2SO4的原因是_______________________(用化学方程式解释)。
14.[海淀一模] 矿山废水中含有大量的H2SO4和CuSO4,直接排放会影响水体酸碱性,并造成重金属污染。通过处理可以回收金属铜,并使废水pH和重金属含量达到排放标准。
图T4-15
已知:步骤Ⅰ无蓝色沉淀生成。
(1)步骤Ⅱ和步骤Ⅲ都需进行的操作是________。
(2)步骤Ⅱ得到金属铜的化学反应方程式为____________________________。
(3)加入Ca(OH)2可以降低铁屑的消耗量,原因是______________________(请用文字并结合化学方程式解释)。
(4)步骤Ⅲ需加入Na2S才能使废水达到排放标准,由此推测废水③不达标的主要原因是其中含有________________________。
15.[北京] 工业上用硫铁矿烧渣(主要成分是Fe3O4、Fe2O3等)、煤粉作原料制备FeCO3的主要流程如下:
图T4-16
(1)焙烧炉中,发生的主要反应为:
①3C+2O22CO+CO2;
②Fe2O3+CO2FeO+CO2;
③Fe3O4+CO3FeO+CO2。
上述反应中的各物质,碳元素呈现_____________________________种化合价。
(2)酸浸槽中,FeO转化为FeSO4,加入的物质X是________。
(3)主反应器中,生成FeCO3的反应物为____________________。
16.[西城二模] 侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年发明的,此法可以同时生产纯碱和氯化铵两种产品。
图T4-17
(1)设备1中分离操作的名称是________。
(2)煅烧炉中发生的化学反应,属于基本反应类型中的__________反应。
(3)以上流程中,可循环使用的物质有________________________。
17.化学材料和化学技术在智能房屋建设和家具生活中有着广泛的应用。
图T4-18
(1)智能房屋采用太阳能电池供电,生产太阳能电池需用纯硅。工业上由粗硅生产纯硅的工艺流程如图T4-19所示:
Si(粗)SiCl4(粗)SiCl4(纯)Si(纯)
步骤Ⅰ 步骤Ⅱ 步骤Ⅲ
图T4-19
①步骤Ⅰ中发生的化学反应,基本反应类型为________________。
②写出步骤Ⅲ中发生反应的化学方程式____________________________。
③该过程中需要隔绝空气,可能的原因是___________________________________________。
(2)有毒气体传感器可检测家用燃气不完全燃烧产生的有毒气体________(填化学式),并及时报警。
(3)新型碳纤维密度比铝小,强度是铁的20倍,具有抗电磁辐射、耐腐蚀的特点,化学性质与碳相似。新型碳纤维在智能房屋建设中可用作________(填序号)。
A.建筑材料
B.电磁辐射屏蔽材料
C.防火材料
(4)饮用水净化系统中设备一的作用是________。
参考答案
1.(1)BC (2)2NH33H2+N2
(3)CO(NH2)2+H2O2NH3↑+CO2↑
2.(1)①CO+H2OCO2+H2 ②C (2)氮
3.(1)①+4 ②NaCl (2)7∶22
4.(1)Fe+H2SO4===FeSO4+H2↑、Fe+CuSO4===FeSO4+Cu
(2)稀硫酸
5.(1)CaCO3
(2)CaO+H2O===Ca(OH)2
(3)大于
(4)Ca(OH)2+CO2===CaCO3↓+H2O
6.(1)MnCO3+H2SO4===MnSO4+H2O+CO2↑ (2)Mn、Fe、O (3)氮 (4)④⑤
7.(1)NO2 (2)H2O (3)3
8.(1)使反应物充分接触(合理即可)
(2)NaAlO2、NaOH
(3)Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
(4)NaOH
9.(1)过滤
(2)CH4+2O2CO2+2H2O
(3)化学
10.(1)Zn+H2SO4===ZnSO4+H2↑
(2)ZnSO4、H2SO4 (3)Na2CO3
11.(1)增大吸收面积
(2)Na2SO3+Ca(OH)2===CaSO3↓+2NaOH
(3)化合
(4)实现了NaOH的循环利用,减少了NaOH的用量
12.(1)Fe+2HCl===FeCl2+H2↑ Fe+2FeCl3===3FeCl2
(2)4 (3)减少环境污染(或联合生产)
13.(1)A (2)S
(3)Na2CO3+H2SO4===Na2SO4+CO2↑+H2O
14.(1)过滤 (2)Fe+CuSO4===Cu+FeSO4
(3)Ca(OH)2会与废水中的硫酸发生反应:Ca(OH)2+H2SO4===CaSO4+2H2O,消耗了废水中的硫酸,减少了铁屑与硫酸的反应:Fe+H2SO4===FeSO4+H2↑
(4)CuSO4(或Cu2+)
15.(1)3 (2)硫酸 (3)FeSO4和NH4HCO3
16.(1)过滤 (2)分解 (3)NaCl、CO2
17.(1)①化合反应 ②SiCl4+2H2Si+4HCl
③防止空气与氢气混合加热时发生爆炸(或防止加热条件下硅被氧气氧化)
(2)CO (3)AB (4)吸附
相关试卷
这是一份中考化学二轮复习重难点提升训练考点04—图像与分析专题突破(含解析),文件包含部编七年级上册语文第五单元教材知识点考点梳理pptx、部编七年级上册语文第五单元教材知识点考点梳理教案docx、部编七年级上册语文第五单元教材知识点考点梳理验收卷原卷版docx、部编七年级上册语文第五单元教材知识点考点梳理验收卷解析版docx等4份课件配套教学资源,其中PPT共31页, 欢迎下载使用。
这是一份中考化学二轮复习 重难点考点04—图像与分析专题突破(含解析),共26页。
这是一份中考化学二轮复习重难点考点04—图像与分析专题突破(含解析),共26页。












