资料中包含下列文件,点击文件名可预览资料内容










当前视频格式暂不支持在线播放,请下载使用
当前视频格式暂不支持在线播放,请下载使用
还剩17页未读,
继续阅读
沪教版九年级下册第3节 几种重要的盐课前预习课件ppt
展开
这是一份沪教版九年级下册第3节 几种重要的盐课前预习课件ppt,文件包含73几种重要的盐第1课时课件pptx、73几种重要的盐第1课时练习doc、73几种重要的盐第1课时教案doc、73几种重要的盐第1课时学案docx、盐酸与硝酸银溶液的反应mp4、硝酸银和氯化钠反应wmv、硫酸铜氯化铁与氢氧化钠反应mp4、铝与硫酸铜铜与硝酸银反应wmv等8份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
写出下列物质的电离方程式:
氯化钠、氯化钡、硫酸钠、硝酸钾、碳酸钠、氯化铵
NaCl === Na+ + Cl-
BaCl2 === Ba2+ + 2 Cl-
Na2SO4 === 2 Na+ + SO42 —
KNO3 === K+ + NO3-
Na2CO3 === 2 Na+ + CO32-
找出上列电离方程式的共同点。
电离出的阳离子都是金属离子或铵根离子,阴离子都是酸根阴离子。
NH4Cl === NH4+ + Cl-
将上述电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物,叫做盐。
这便是今天要学习的盐。
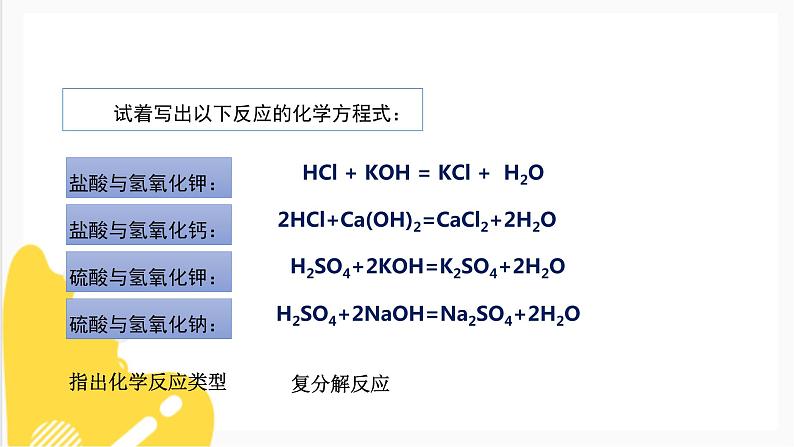
试着写出以下反应的化学方程式:
HCl + KOH = KCl + H2O
2HCl+Ca(OH)2=CaCl2+2H2O
H2SO4+2KOH=K2SO4+2H2O
H2SO4+2NaOH=Na2SO4+2H2O
由金属离子(或铵根离子)和酸根离子构成的化合物
常见酸根:CO32-(碳酸根离子)、SO42-(硫酸根离子)、 NO3- (硝酸根离子)、Cl-(氯离子)、HCO3-(碳酸氢根离子)
例如:NaCl、Na2CO3、CaCO3、KMnO4、CuSO4 、Fe(NO3)3 、NaHCO3、NH4NO3
理解:盐是一类化合物的总称,氯化钠是盐类中的一种,不能认为盐就是氯化钠。2) 盐类物质不一定都含有金属元素,如NH4NO3、 (NH4)2CO3.3)NaHCO3、 Cu2(OH)2CO3等物质中除含有金属离子和酸根离子外,还会有氢元素或氢氧根,也属于盐类物质。
依据组成盐的阳离子和酸根的种类进行分类
盐可以分为钠盐、钾盐、镁盐、铵盐等(如氯化钠为钠盐)
盐可以分为硫酸盐、碳酸盐、盐酸盐等(如氯化钠为盐酸盐)
氯化钠(NaCl)、氯化钙(CaCl2)、碳酸钠(Na2CO3)、硫酸铜(CuSO4)、硝酸铵(NH4NO3)都是盐,根据酸碱中和反应生成盐和水的事实,它们在组成上的相同之处是什么?
电离出的阳离子都是金属离子或铵根离子,阴离子都是酸根阴离子
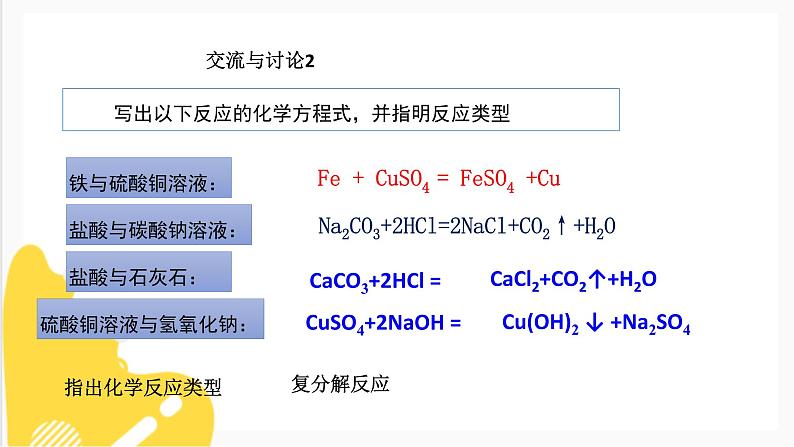
写出以下反应的化学方程式,并指明反应类型
硫酸铜溶液与氢氧化钠:
Fe + CuSO4 = FeSO4 +Cu
Na2CO3+2HCl=2NaCl+CO2↑+H2O
HCl + AgNO3 = AgCl↓+ HNO3
特点:(1)反应物、生成物均只有两种化合物; (2)发生反应的两种化合物相互交换成分; (3)各元素的化合价在反应前后均不改变。
复分解反应包括: 酸 + 碱 —— 盐 + 水 酸 + 盐 —— 新酸 + 新盐 碱 + 盐 —— 新碱 + 新盐 盐 + 盐 —— 新盐 + 新盐 酸 + 金属氧化物 —— 盐 + 水
那么酸碱盐之间一定能发生复分解反应吗?
含有SO42-的溶液与BaCl2反应产生白色沉淀,且沉淀不溶于硝酸,证明含有SO42-
向盛有少量BaCl2溶液的试管滴入硫酸钠溶液,观察现象。
BaCl2+Na2SO4=BaSO4↓+2NaCl
酸、碱、盐的溶解性(20℃)
1.钾钠铵硝酸盐都溶。2.硫酸钡不溶,硫酸钙银微溶。3.氯化银不溶,其他盐都溶。4.硝酸钾钠铵盐溶,其他都不溶。5.氢氧化钾钠铵钡钙溶,其他都不溶,酸全溶。
钾钠铵盐都可溶, 硝盐遇水影无踪,硫酸盐不溶硫酸钡, 硫酸钙银是微溶,碳酸盐只溶钾钠铵, 氯化物只有银不溶,碱溶钾钠钡氨钙, 酸除硅酸全都溶。
注:AgCl、BaSO4不仅不溶于水,而且不溶于稀硝酸。
现象:迅速出现大量气泡
NaHCO3+HCl=NaCl+CO2↑+H2O
酸碱盐之间并不是都能发生复分解反应的。只有当两种化合物相互交换成分时,生成物中有气体或有沉淀或有水生成时,复分解反应才可以发生。
酸、碱、盐之间在水溶液中解离出的离子相互结合,生成沉淀、气体或水的过程。
小结:复分解反应能否发生有“三看”
一看成分:一般如有相同的离子成分,则该反应不能发生。
2. 二看产物:生成物中是否有沉淀、气体或水生成。只需有其中一种,反应就能发生 。
3. 三看反应物的溶解性:有酸参加的复分解反应,另外一种物质可不溶于水,但需溶于酸,反应才能发生。无酸参加的复分解反应,反应物均需溶于水,反应才可能发生。
1.盐 + 金属 = 新盐 + 新金属
不要用K、Ca、Na置换盐溶液中的金属
铁参加的置换反应生成的都是亚铁盐
在金属活动性顺序表中,只有位于前面的金属才能把位于后面的金属从它的盐溶液中置换出来,与氢的位置无关;盐必须是可溶性盐。
1.金属的位置越靠前,它的活动性就越强
2.位于氢前的金属能置换出盐酸、稀硫酸(不能用浓硫 酸、硝酸)中的氢
3.位于前面的金属能把位于后面的金属从它们的盐溶液 中置换出来(钾、钙、钠除外)
金属活动性由强逐渐减弱
2Al+3CuSO4=Al2(SO4)3+3Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
2.盐 + 酸 = 新盐 + 新酸
条件:生成物中有沉淀或气体或水
3.盐 + 碱 = 新盐 + 新碱
条件:反应物两者均可溶;生成物有沉淀或气体或水
Na2CO3+CaCl2 =CaCO3↓+2NaCl
4.盐 + 盐 = 新盐 + 新盐
NaCl+AgNO3=AgCl↓+NaNO3
写出下列物质的电离方程式:
氯化钠、氯化钡、硫酸钠、硝酸钾、碳酸钠、氯化铵
NaCl === Na+ + Cl-
BaCl2 === Ba2+ + 2 Cl-
Na2SO4 === 2 Na+ + SO42 —
KNO3 === K+ + NO3-
Na2CO3 === 2 Na+ + CO32-
找出上列电离方程式的共同点。
电离出的阳离子都是金属离子或铵根离子,阴离子都是酸根阴离子。
NH4Cl === NH4+ + Cl-
将上述电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物,叫做盐。
这便是今天要学习的盐。
试着写出以下反应的化学方程式:
HCl + KOH = KCl + H2O
2HCl+Ca(OH)2=CaCl2+2H2O
H2SO4+2KOH=K2SO4+2H2O
H2SO4+2NaOH=Na2SO4+2H2O
由金属离子(或铵根离子)和酸根离子构成的化合物
常见酸根:CO32-(碳酸根离子)、SO42-(硫酸根离子)、 NO3- (硝酸根离子)、Cl-(氯离子)、HCO3-(碳酸氢根离子)
例如:NaCl、Na2CO3、CaCO3、KMnO4、CuSO4 、Fe(NO3)3 、NaHCO3、NH4NO3
理解:盐是一类化合物的总称,氯化钠是盐类中的一种,不能认为盐就是氯化钠。2) 盐类物质不一定都含有金属元素,如NH4NO3、 (NH4)2CO3.3)NaHCO3、 Cu2(OH)2CO3等物质中除含有金属离子和酸根离子外,还会有氢元素或氢氧根,也属于盐类物质。
依据组成盐的阳离子和酸根的种类进行分类
盐可以分为钠盐、钾盐、镁盐、铵盐等(如氯化钠为钠盐)
盐可以分为硫酸盐、碳酸盐、盐酸盐等(如氯化钠为盐酸盐)
氯化钠(NaCl)、氯化钙(CaCl2)、碳酸钠(Na2CO3)、硫酸铜(CuSO4)、硝酸铵(NH4NO3)都是盐,根据酸碱中和反应生成盐和水的事实,它们在组成上的相同之处是什么?
电离出的阳离子都是金属离子或铵根离子,阴离子都是酸根阴离子
写出以下反应的化学方程式,并指明反应类型
硫酸铜溶液与氢氧化钠:
Fe + CuSO4 = FeSO4 +Cu
Na2CO3+2HCl=2NaCl+CO2↑+H2O
HCl + AgNO3 = AgCl↓+ HNO3
特点:(1)反应物、生成物均只有两种化合物; (2)发生反应的两种化合物相互交换成分; (3)各元素的化合价在反应前后均不改变。
复分解反应包括: 酸 + 碱 —— 盐 + 水 酸 + 盐 —— 新酸 + 新盐 碱 + 盐 —— 新碱 + 新盐 盐 + 盐 —— 新盐 + 新盐 酸 + 金属氧化物 —— 盐 + 水
那么酸碱盐之间一定能发生复分解反应吗?
含有SO42-的溶液与BaCl2反应产生白色沉淀,且沉淀不溶于硝酸,证明含有SO42-
向盛有少量BaCl2溶液的试管滴入硫酸钠溶液,观察现象。
BaCl2+Na2SO4=BaSO4↓+2NaCl
酸、碱、盐的溶解性(20℃)
1.钾钠铵硝酸盐都溶。2.硫酸钡不溶,硫酸钙银微溶。3.氯化银不溶,其他盐都溶。4.硝酸钾钠铵盐溶,其他都不溶。5.氢氧化钾钠铵钡钙溶,其他都不溶,酸全溶。
钾钠铵盐都可溶, 硝盐遇水影无踪,硫酸盐不溶硫酸钡, 硫酸钙银是微溶,碳酸盐只溶钾钠铵, 氯化物只有银不溶,碱溶钾钠钡氨钙, 酸除硅酸全都溶。
注:AgCl、BaSO4不仅不溶于水,而且不溶于稀硝酸。
现象:迅速出现大量气泡
NaHCO3+HCl=NaCl+CO2↑+H2O
酸碱盐之间并不是都能发生复分解反应的。只有当两种化合物相互交换成分时,生成物中有气体或有沉淀或有水生成时,复分解反应才可以发生。
酸、碱、盐之间在水溶液中解离出的离子相互结合,生成沉淀、气体或水的过程。
小结:复分解反应能否发生有“三看”
一看成分:一般如有相同的离子成分,则该反应不能发生。
2. 二看产物:生成物中是否有沉淀、气体或水生成。只需有其中一种,反应就能发生 。
3. 三看反应物的溶解性:有酸参加的复分解反应,另外一种物质可不溶于水,但需溶于酸,反应才能发生。无酸参加的复分解反应,反应物均需溶于水,反应才可能发生。
1.盐 + 金属 = 新盐 + 新金属
不要用K、Ca、Na置换盐溶液中的金属
铁参加的置换反应生成的都是亚铁盐
在金属活动性顺序表中,只有位于前面的金属才能把位于后面的金属从它的盐溶液中置换出来,与氢的位置无关;盐必须是可溶性盐。
1.金属的位置越靠前,它的活动性就越强
2.位于氢前的金属能置换出盐酸、稀硫酸(不能用浓硫 酸、硝酸)中的氢
3.位于前面的金属能把位于后面的金属从它们的盐溶液 中置换出来(钾、钙、钠除外)
金属活动性由强逐渐减弱
2Al+3CuSO4=Al2(SO4)3+3Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
2.盐 + 酸 = 新盐 + 新酸
条件:生成物中有沉淀或气体或水
3.盐 + 碱 = 新盐 + 新碱
条件:反应物两者均可溶;生成物有沉淀或气体或水
Na2CO3+CaCl2 =CaCO3↓+2NaCl
4.盐 + 盐 = 新盐 + 新盐
NaCl+AgNO3=AgCl↓+NaNO3













