




苏教版 (2019)选择性必修1第一单元 化学反应速率教案配套ppt课件
展开课程目标1.了解反应活化能的概念,了解有效碰撞理论。2.理解外界条件(浓度、温度、压强、催化剂等)对化学反应速率的影响,认识其一般规律。3.了解催化剂在生产、生活和科学研究领域中的重大作用。4.了解通过改变外界条件改变化学反应速率的方法和意义。
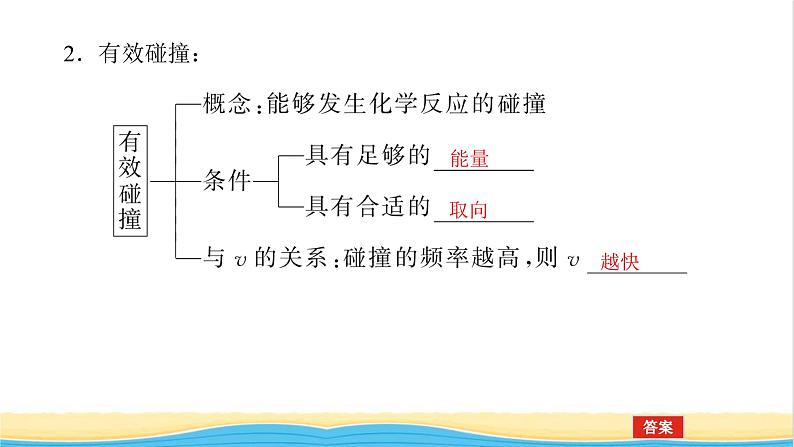
[新知预习]一、有效碰撞理论1.基元反应与反应历程(1)基元反应:一个化学反应往往经历 反应步骤才能实现, 反应都称为基元反应。(2)反应历程:与某化学反应有关的一组基元反应反映了该反应的反应历程,反应历程又称 。
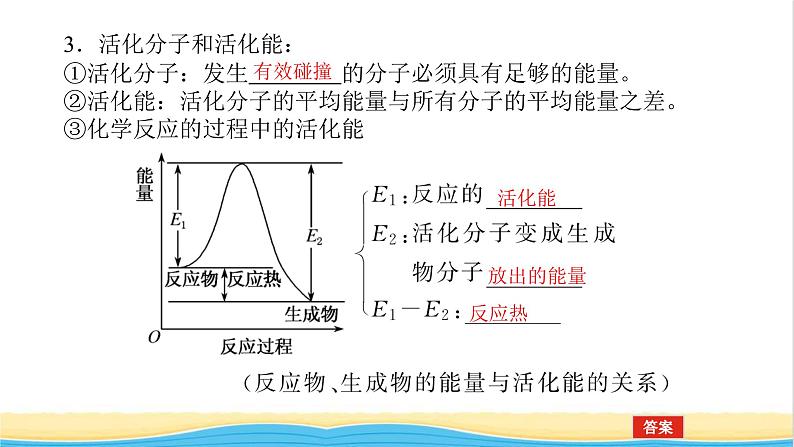
3.活化分子和活化能:①活化分子:发生 的分子必须具有足够的能量。②活化能:活化分子的平均能量与所有分子的平均能量之差。③化学反应的过程中的活化能
4.化学反应速率与活化分子、有效碰撞的关系活化分子的百分数越大,单位体积内 越多,单位时间内 越多,化学反应速率 。
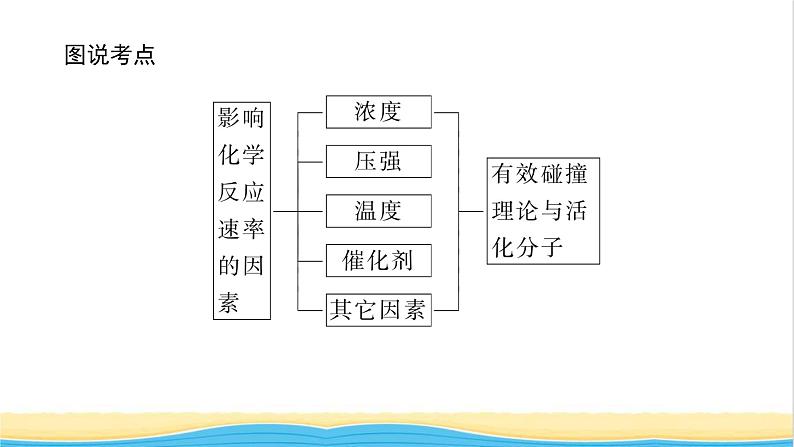
二、影响化学反应速率的因素1.内因——反应物的性质:影响化学反应速率的主要因素是反应物本身的性质。例如金属钠与冷水剧烈反应,而镁和沸水仅能微弱反应。2.外因——外界因素:(1)浓度①规律:其他条件相同时,增大反应物的浓度,反应速率 ;反之,反应速率 。②解释:
(2)压强①规律:对于有气体参加的反应,在密闭容器中保持温度不变时,增大压强,反应速率 ;反之,反应速率 。②解释:
(3)温度①规律:其他条件相同时,升高温度,反应速率 ;反之,反应速率 。②解释:
(4)催化剂。①规律:当其他条件不变时,使用催化剂,反应速率 。②解释:(5)其他因素对化学反应速率的影响。如光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨、增大反应物 等,均会对化学反应速率产生影响。
[即时性自测]1.判断正误,正确的打“√”,错误的打“×”(1)碳酸钙与盐酸反应过程中,再增加CaCO3固体的量,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率。( )(2)增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加。( )(3)增大压强一定能增大化学反应速率。( )(4)对于有气体参加的化学反应,若增大压强(即减小反应容器的体积),可增大单位体积内活化分子数,从而使反应速率加快。( )(5)反应N2+O2⇌2NO在体积不变的密闭容器中进行,若向容器中充入He使气体压强增大,但反应速率不变。( )
(6)升高温度使反应速率增大的主要原因是增加了活化分子的百分数。( )(7)对于正反应吸热的可逆反应,其他条件不变,升高温度,其正、逆反应速率均加快。( )(8)X和Y两种物质混合后发生反应:X+Y===Z,Y+Z===W+X+V,则Z是催化剂。( )(9)使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大。( )(10)催化剂能改变化学反应速率,但不能改变反应的反应热、活化能。( )
2.下列说法正确的是( )A.反应物分子相互碰撞即能发生化学反应B.活化分子之间的碰撞,一定可以发生化学反应C.活化分子所具有的能量称为活化能D.活化分子百分数越大,反应速率越大
解析:活化分子之间的有效碰撞才能发生化学反应,A、B项错误;活化能是活化分子具有的平均能量与反应物分子具有的平均能量之差,C项错误;活化分子百分数越大,则单位体积内活化分子数越多,单位时间内有效碰撞的次数越多,反应速率越大,D项正确。
3.某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )A.该反应为放热反应B.催化剂能改变该反应的焓变C.催化剂能降低该反应的活化能D.逆反应的活化能大于正反应的活化能
解析:由题图可知,反应物的总能量比生成物的总能量低,故该反应为吸热反应,A项错误;催化剂不能改变反应的焓变,B项错误;催化剂能降低该反应的活化能,C项正确;逆反应的活化能小于正反应的活化能,D项错误。
4.下列说法正确的是( )A.增大反应物浓度,可增大单位体积内活化分子的百分数,使有效碰撞次数增大B.有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率加快C.升高温度能使化学反应速率加快,主要原因是增加了反应物分子中活化分子的百分数D.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,加快反应速率
解析:增大反应物的浓度,单位体积内活化分子的个数增加,使有效碰撞次数增大,但活化分子的百分数不变,故A错误;增大压强,单位体积内活化分子的个数增加,使有效碰撞次数增大,反应速率加快,但活化分子的百分数不变,故B错误;升高温度,增加了活化分子的百分数,使有效碰撞次数增加,反应速率加快,故C正确;催化剂可降低反应活化能,使活化分子百分数增大,有效碰撞次数增大,反应速率加快,故D错误。
5.反应A(g)+B(s)⇌C(g) ΔH<0,在其他条件不变时,改变其中一个条件,则生成C的速率(横线上填“加快”“减慢”或“不变”):(1)升温 ;(2)加正催化剂 ;(3)增大容器容积 ;(4)恒容条件下加入A ;(5)恒容条件下加入B 。
解析:(1)升高温度生成C的速率一定加快;(2)加正催化剂生成C的速率一定加快;(3)增大容器容积,气体浓度减小,生成C的速率减慢;(4)恒容条件下加入A,增大A的浓度,生成C的速率加快;(5)恒容条件下加入B,B是固体,对反应速率没有影响。
提升点一 化学反应速率的影响因素 [例1] 向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小顺序排列正确的是( )甲:在500 ℃时,SO2和O2各10 ml反应乙:在500 ℃时,用V2O5作催化剂,10 ml SO2和5 ml O2起反应丙:在450 ℃时,8 ml SO2和5 ml O2反应丁:在500 ℃时,8 ml SO2和5 ml O2反应A.甲、乙、丙、丁 B.乙、甲、丙、丁C.乙、甲、丁、丙 D.丁、丙、乙、甲
比较时,先保证其它因素相同,只比较一个变量因素。
解析:影响化学反应速率的各因素,对反应速率影响程度大小的一般规律为:催化剂>温度>浓度,即有催化剂V2O5,温度高的化学反应速率快,所以反应速率由大到小顺序排列为乙、甲、丁、丙,故C项正确。
[提升1] 已知①N2(g)+3H2(g)⇌2NH3(g) ΔH<0,反应速率为v1;②2HI(g)⇌H2(g)+I2(g) ΔH>0,反应速率为v2。对于上述两个可逆反应,当改变条件的瞬间,试判断v1、v2的变化(填“增大”“减小”或“不变”)(1)保持体积不变,反应①通入N2,反应②分离出I2(g),v1 ,v2 。(2)保持压强不变,反应①②通入“He”气,v1 ,v2 。(3)反应①、反应②均压缩体积v1 ,v2 。
(4)保持体积不变,反应①②通入“He”气v1 ,v2 。(5)其他条件不变,反应①②均升温v1 ,v2 。(6)其他条件不变,反应①②均加入正催化剂v1 ,v2 。
状元随笔 恒温恒压和恒温恒容时,通入“无关气体”对速率的影响关键看是否改变了物质的浓度。保持体积不变,通入He虽然容器内压强变大,但各反应物的浓度不变,所以速率不变。保持压强不变时,通入He容器的容积要变大,因此,反应体系各物质浓度减少,故速率减小。
[关键能力]不同的外界条件对化学反应速率影响的注意点1.浓度:增大浓度、速率增大;减少浓度、速率减小;改变纯固体或纯液体的量对化学反应速率没有影响。2.压强:①必须有气体参加;②压强的改变实质是改变浓度。3.温度:无论是吸热反应还是放热反应,升高温度,速率增大,降低温度,速率减小。4.催化剂:催化剂只改变反应速率,不改变反应的方向,也不改变反应热的大小,若是可逆反应,则同等程度改变正、逆反应速率。
提升点二 探究化学反应速率的影响因素[例2] 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)实验Ⅰ和实验Ⅱ的目的是_______________________________。(2)写出实验Ⅲ中发生反应的化学方程式:______________________。(3)实验Ⅰ、Ⅱ、Ⅲ的起始反应速率由大到小的顺序为 (用实验编号表示)。
探究反应物浓度对反应速率的影响
2H2O2FeCl32H2O+O2↑
解析:本题考查化学反应速率的影响因素及化学反应速率的计算。(1)实验Ⅰ和Ⅱ均未使用催化剂,混合液的总体积均为11 mL,c(H2O2)不同,则实验目的是探究反应物浓度对反应速率的影响。(2)实验Ⅲ为H2O2在FeCl3催化作用下分解生成H2O和O2的反应,据此写出化学方程式。(3)实验Ⅰ中,c(H2O2)最小且未使用催化剂,则实验Ⅰ中起始反应速率最小;实验Ⅱ和Ⅲ中c(H2O2)相同,实验Ⅲ中加入FeCl3溶液,则实验Ⅲ的起始反应速率大于实验Ⅱ,故反应速率的大小顺序为Ⅲ>Ⅱ>Ⅰ。
(4)实验Ⅲ、Ⅳ、Ⅴ中,测得生成氧气的体积(折算成标准状况)随时间变化的关系如图所示。①分析图示能够得出的结论是__________________________________________________。②实验Ⅲ在t1~t2时间内,以H2O2表示的反应速率为__________________。
状元随笔 一个化学反应同时受多个因素影响时,可控制多个变量不变,只改变某一变量来设置对比实验,通过实验现象及数据来分析该单一变量对化学反应的影响。
碱性环境能加快H2O2分解的速率,酸性环境能减慢H2O2分解的速率
[提升2] 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“反应条件对化学反应速率的影响”。(1)向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽时,溶液紫色将褪去。为确保能观察到紫色褪去,初始H2C2O4与KMnO4的物质的量需要满足关系n(H2C2O4)/n(KMnO4) 。
(2)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案:
表中x= ,理由是_______________________________________________________________。
保证其他条件不变,只改变反应物H2C2O4溶液的
浓度,才能达到实验目的
解析: (2)根据表中提供的数据可知,应控制KMnO4溶液的浓度不变,调节H2C2O4溶液的浓度,所以x=2.0(即总体积保持13.0 mL不变)。
(3)已知(2)中实验①的c(H2C2O4)随反应时间t的变化曲线如图所示,若保持其他条件不变,请在图中画出50 ℃时c(H2C2O4)随t的变化曲线。
解析: (3)温度越高,反应速率越快,KMnO4反应完所需的时间越短。
[关键能力]利用“控制变量法”的解题策略
1.下列说法错误的是( )①当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应②发生有效碰撞的分子一定是活化分子③活化分子间的碰撞一定是有效碰撞④活化分子间每次碰撞都发生化学反应⑤能发生有效碰撞的分子必须具有相当高的能量⑥活化能指活化分子多出反应物分子平均能量的那部分能量A.①④ B.③④C.④⑤⑥ D.②⑤
解析:活化分子间的碰撞有适当的取向时,才能发生有效碰撞;活化分子间的碰撞是有效碰撞时,才发生化学反应。
2.反应3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g)在一体积可调的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A.增加Fe的表面积B.保持容器体积不变,充入Ne使体系压强增大C.将容器的体积缩小一半D.保持总压强不变,充入Ne使容器的体积增大
解析:增加Fe的表面积,增大了与水蒸气的接触面积,化学反应速率加快;保持容器体积不变充入Ne增大压强,对c(H2O)、c(H2)无影响,化学反应速率不变,B项符合题意;容器体积缩小一半,c(H2O)、c(H2)均增大为原来的2倍,化学反应速率加快;压强不变,充入Ne使容器体积增大,c(H2O)、c(H2)减小,反应速率减小。
3.下表中是各组反应的反应物和温度,反应刚开始时,放出H2速率最快的是( )
解析:A项中HNO3具有强氧化性,与金属反应时不产生H2,B、C、D三项中温度相同,由于Mg比Fe活泼,且D项中c(H+)=6 ml·L-1大于B项中c(H+),故反应开始时产生H2速率最快的是D项。
4.对恒温恒容密闭容器中的可逆反应:A(s)+3B(g)⇌2C(g) ΔH<0,下列叙述正确的是( )A.升高温度,v(逆)增大,v(正)减小B.增大压强,v(正)增大,v(逆)减小C.增加A的物质的量,v(正)增大,v(逆)减小D.使用催化剂,降低反应活化能,v(正)、v(逆)同时增大,且增大的倍数相同
解析:升高温度,正、逆反应速率都增大,故A错误;增大压强,正、逆反应速率都增大,故B错误;A为固体,增加A的物质的量,A的浓度不变,v(正)、v(逆)都不变,故C错误;使用催化剂,可同时同等程度地改变正、逆反应速率,所以使用催化剂,v(正)、v(逆)同时增大,而且增大的倍数相同,故D正确。
5.用下图所示的实验装置进行实验X、Y时,每隔半分钟分别测定放出气体的体积,下列选项中能正确表示实验X、Y的结果的是( )
解析:由镁和盐酸反应的化学方程式并结合题中数据可知实验X、Y中镁均过量,实验X、Y中盐酸的物质的量相等,因此两者产生的H2的最终体积相等,故C项和D项不正确。反应物的浓度越大,化学反应速率越大,故实验X产生H2的速率大,A项符合题意。
6.已知反应2HI(g)⇌H2(g)+I2(g)的能量变化如图所示。下列说法正确的是( )A.常温下,向体积为V L的容器中充人2 ml HI(g)充分反应,可吸收12.5 kJ的热量B.加入催化剂,分子的能量不变,但单位体积内活化分子数增多,反应速率加快C.其他条件不变,升高温度,活化能减小,反应速率加快D.H2(g)+I2(g)⇌2HIg(g)的活化能为12.5 kJ·ml-1
解析:该反应为可逆反应,充入2 ml HI(g)充分反应,反应不能进行到底,所以吸收的热量小于12.5 kJ,A错误;加入催化剂,单位体积内活化分子数增多,有效碰撞增多,反应速率加快,B正确;从题图可知,该反应为吸热反应,其他条件不变,升高温度,反应速率加快,但活化能不变,C错误;由题图分析可知,H2(g)+I2(g)⇌2HI(g)的活化能E′a=(185-12.5) kJ·ml-1=172.5 kJ·ml-1,D错误。
7.某班学生为了研究外界条件对化学反应速率的影响设计了如下一系列的实验,在实验过程中收集产生的气体,并记录获得相同体积的气体所需的时间。
(1)①②④中化学反应速率由快到慢的顺序为 (填序号,下同)。(2)探究浓度对化学反应速率影响的实验是 ;探究温度对化学反应速率影响的实验是 ;①③探究 对化学反应速率影响。(3)某同学查资料得知向上面的实验体系中加入少量硫酸铜固体能加快反应速率,其原因为___________________________________________________。
固体的表面积(或反应物的接触面积)
硫酸铜和锌反应生成铜,生成的铜与锌形成原电池,
解析:(1)①④中其他条件相同,影响化学反应速率的主要因素是温度,温度高的反应速率快,所以反应速率:④>①;①②中其他条件相同,影响反应速率的主要因素是浓度,浓度大的速率快,因此反应速率:①>②,则①②④中化学反应速率由快到慢的顺序为④①②。(2)①②中其他条件相同,硫酸溶液的浓度不同,因此探究浓度对化学反应速率影响的是①②;①④中其他条件相同,温度不同,因此探究温度对化学反应速率影响的是①④;①③中其他条件相同,锌的表面积不同,因此探究的是固体的表面积或反应物的接触面积对化学反应速率的影响。(3)锌比铜活泼,硫酸铜和锌反应生成铜,铜与过量的锌形成原电池,能够加快反应速率。
8.在一密闭容器中充入1 ml H2和1 ml I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)⇌2HI(g) ΔH<0。(1)保持容器容积不变,向其中加入1 ml H2,反应速率 ,理由是_____________________________。(2)保持容器容积不变,向其中加入1 ml N2(N2不参加反应),反应速率 ,理由是_______________________________。
增大反应物氢气的浓度,反应速率增大
反应物的浓度不变,反应速率不变
(3)保持容器内气体压强不变,向其中加入1 ml N2(N2不参加反应),反应速率 ,理由是______________________________________________________________________。(4)保持容器内气体压强不变,向其中加入1 ml H2 (g)和1 ml I2(g),反应速率 ,理由是_________________________________________________________________。(5)提高起始的反应温度,反应速率 ,理由是____________________________________________。
保持压强不变,向其中充入N2,体积变大,
反应物浓度减小,反应速率减小
保持压强不变,向其中充入1 ml H2
和1 mlI2,反应物浓度不变,反应速率不变
升高温度,提高活化分子百分数,反应速率增大
高中化学第一单元 化学反应速率教课ppt课件: 这是一份高中化学第一单元 化学反应速率教课ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
2020-2021学年第一单元 化学反应速率课堂教学ppt课件: 这是一份2020-2021学年第一单元 化学反应速率课堂教学ppt课件,共60页。PPT课件主要包含了分点突破1,分点突破2,分点突破3,分点突破4,分点突破5,关键能力培养,探究与创新能力等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率课文ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率课文ppt课件,共60页。PPT课件主要包含了微专题一,答案B,答案C,答案D,25×10-2,微专题二,及时移去产物,改进催化剂,0×10-3,k1=60k2等内容,欢迎下载使用。













