





新高考高考化学总复习专题一化学计量微专题1溶解度及溶解度曲线的应用课件
展开一、对溶解度及溶解度曲线的理解
2.影响溶解度大小的因素(1)内因:物质本身的性质(由结构决定)。(2)外因:①溶剂的影响(如NaCl易溶于水,不易溶于汽油)。②温度的影响:升温,大多数固体物质的溶解度增大,少数物质相反,如Ca(OH)2;温度对NaCl的溶解度影响不大。
典型案例例1 将80 ℃饱和KNO3溶液冷却至10 ℃,有KNO3固体析出。该过程中保持 不变的是 ( )A.溶剂的质量 B.溶质的质量分数C.KNO3的溶解度 D.溶液中K+的数目
解析 硝酸钾的溶解度随着温度的升高而增大,随着温度的降低而减小,KNO3晶体不带结晶水,当降低温度KNO3晶体析出时,溶质的质量减小而溶剂的质量不会改变。
二、溶解度的特点和物质分离方法的关系在解答化工流程题中的应用
1.根据溶解度曲线,能很快比较出两种物质在某温度范围内溶解度的大小。2.根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。3.根据溶解度曲线,选择分离某些可溶性混合物的方法。(1)溶解度受温度影响较小的物质(如NaCl)采取蒸发结晶的方法;若NaCl溶液 中含有KNO3,应采取蒸发结晶,趁热过滤的方法。(2)溶解度受温度影响较大的物质(或带有结晶水)采取蒸发浓缩、冷却结晶 的方法;若KNO3溶液中含有NaCl,应采取加热浓缩、冷却结晶、过滤的方法。
4.根据溶解度曲线,判断结晶的方法(1)溶解度受温度影响较小的(如NaCl)采取蒸发结晶的方法;(2)溶解度受温度影响较大的采取蒸发浓缩、冷却结晶的方法;(3)带有结晶水的盐,一般采取蒸发浓缩、冷却结晶的方法,应特别注意的是 若从FeCl3溶液中结晶出FeCl3·6H2O晶体,应在HCl气氛中蒸发浓缩、冷却结 晶。
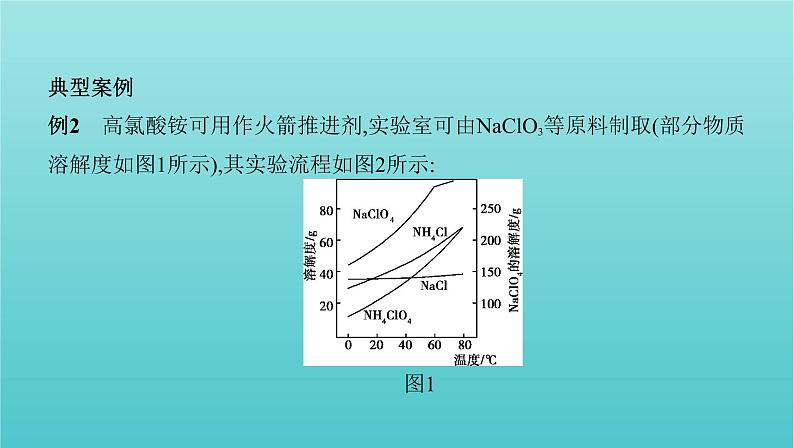
典型案例例2 高氯酸铵可用作火箭推进剂,实验室可由NaClO3等原料制取(部分物质 溶解度如图1所示),其实验流程如图2所示:图1
(已知氯酸钠受热分解生成高氯酸钠和氯化钠)(1)80 ℃时浸取液冷却至0 ℃过滤,滤渣的主要成分为 NaClO4 (写化学式)。(2)反应器中加入氯化铵饱和溶液发生反应的离子方程式为 N +Cl NH4ClO4↓ 。
解析 (1)80 ℃时浸取液主要含有NaClO4和NaCl,NaClO4溶解度受温度影响 较大,而NaCl受温度影响很小,当冷却至0 ℃时,NaClO4会因温度降低溶解度 减小而析出,所以滤渣中主要物质是NaClO4。(2)反应器中含有NaClO4,加入 氯化铵饱和溶液后,溶解度最小的NH4ClO4首先结晶析出,发生反应的离子方 程式为N +Cl NH4ClO4↓。
1.已知四种盐的溶解度(S)曲线如图所示,下列说法不正确的是 ( )A.将NaCl溶液蒸干可得NaCl固体B.将MgCl2溶液蒸干可得MgCl2固体C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯D.可用MgCl2和NaClO3制备Mg(ClO3)2
解析 MgCl2能够水解,水解产生了氢氧化镁和氯化氢,加热,水解平衡正向移 动,氯化氢易挥发,所以将MgCl2溶液蒸干得到的固体为氢氧化镁,故B错误。
2.以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如下:
氯化铵和硫酸钠的溶解度随温度变化如下图所示。回答下列问题:
(1)欲制备10.7 g NH4Cl,理论上需要NaCl 11.7 g。(2)实验室进行蒸发浓缩用到的主要仪器有 蒸发皿 、烧杯、玻璃棒、酒 精灯等。(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 35 ℃(33~40 ℃都可以) 。(4)不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是 取少量氯化铵 产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净 。(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 重结晶 。
新教材高考化学总复习专题一化学计量微专题1阿伏加德罗常数的判断课件: 这是一份新教材高考化学总复习专题一化学计量微专题1阿伏加德罗常数的判断课件,共21页。
江苏专用高考化学总复习专题一化学计量微专题1溶解度及溶解度曲线的应用课件: 这是一份江苏专用高考化学总复习专题一化学计量微专题1溶解度及溶解度曲线的应用课件,共14页。
江苏专用高考化学总复习专题一化学计量微专题2阿伏加德罗常数的计算课件: 这是一份江苏专用高考化学总复习专题一化学计量微专题2阿伏加德罗常数的计算课件,共20页。PPT课件主要包含了名师总结等内容,欢迎下载使用。












