
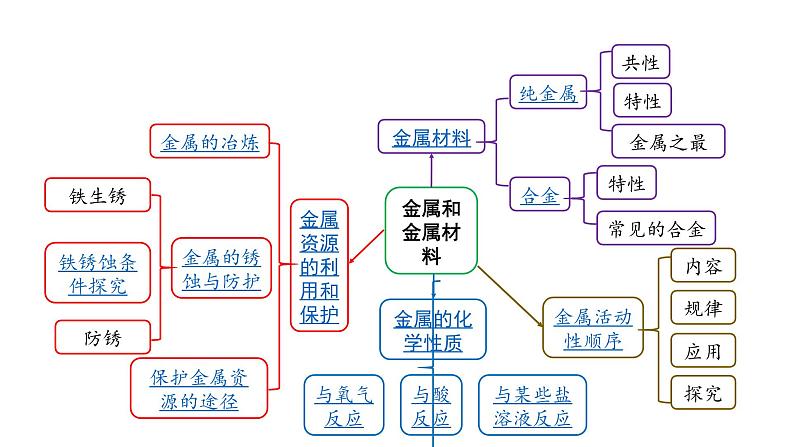





2022版中考化学大一轮培优训练及课件专题五 金属和金属材料课件
展开共性:有金属光泽(作首饰)、______性(作炊具)、______性(作导线)、_______性 (拉成丝或压成薄片)特性:铁、铝等大多数金属呈_____色,但铜呈_____色,金呈_____色,铁粉是黑色
概念:合金是指在金属中加热熔合某些金属或非金属而制成的具有金属特性的混合物特性:合金与组成它们的纯金属相比,硬度更_____、熔点降低,抗腐蚀性更强常见合金
钛合金:抗腐蚀性能非常好、与人体具有很好的“相容性”,因此可用来制造人造 骨骼等硬铝:强度高、硬度大,可制造飞机汽车,作建筑材料其他合金:不锈钢、青铜、18K黄金(光泽好)、焊锡(熔点低)、黄铜(强度 高)、锰钢等
金属之最:地壳中含量最高的金属元素:__________;目前世界上年产量最高的金属:__________ 人体中含量最高的金属元素:__________
生铁:含碳量2%~4.3%,硬度大钢:含碳量0.03%~2%,抗腐蚀性好,常用于制造医疗器械、炉具等
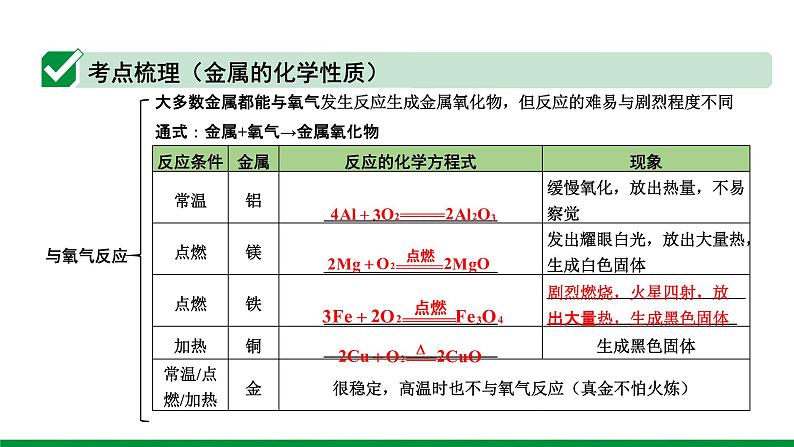
大多数金属都能与氧气发生反应生成金属氧化物,但反应的难易与剧烈程度不同通式:金属+氧气→金属氧化物
剧烈燃烧,火星四射,放出大量热,生成黑色固体
在四支试管中分别加入少量镁、锌、铁、铜,再分别加入5mL等浓度的稀盐酸,观察现象
现象:剧烈反应,产生大量气泡化学方程式:______________________________
通式:活泼金属+酸→盐+氢气
现象:反应比较剧烈,产生较多气泡化学方程式:______________________________
现象:反应缓慢,有________产生,溶液由_____色逐渐变为______色化学方程式:______________________________
铜:现象:__________
通式:金属+盐→新金属+新盐反应条件:金属的活动性强于新金属,K、Ca、Na除外;盐必须可溶
铁与硫酸铜溶液(写化学方程式,下同)________________________________铜与硝酸银溶液___________________________________ 铝与硫酸铜溶液___________________________________
金属的位置越靠前,它的活动性就越_____位于氢______的金属能置换出稀盐酸、稀硫酸中的氢位于______的金属能把位于______的金属从它们的盐溶液里置换出来(K、Ca、Na除外)
判断金属与酸能否发生反应判断金属与盐溶液能否发生反应判断金属发现和使用年代的早晚,在自然界中的存在形式
金属活动性顺序的验证与探究(详见微专题4)
常见的铁矿石:赤铁矿(主要成分是_______)、磁铁矿(主要成分_______)、黄 铁矿(主要成分是FeS2)、黄铜矿(主要 成分是CuFeS2)铁的冶炼(详见实验突破栏目)
金属锈蚀条件的探究(详见实验突破栏目)铁锈:主要成分是 ________,其化学式是Fe2O3(或Fe2O3·xH2O)
物理方法:打磨化学方法:加入试剂,如用稀盐酸除铁锈,发生反应的化学方程式: ______________________________________
原理:破坏金属锈蚀的条件,使金属制品隔绝空气中的氧气或水等
干:保持金属制品表面洁净干燥(如用过的菜刀擦干净)膜:在金属表面涂保护膜(如涂油、刷漆等)改:改变金属的内部结构,制成合金(如不锈钢等)镀:在金属制品表面镀一层能起防锈作用的金属(如铁表面镀锌)烤:用化学方法使金属制品表面形成致密的氧化膜(如烤蓝)
防止金属锈蚀回收利用废旧金属合理有效地开采矿物寻找金属的代用品等
下列关于金属和金属材料的说法正确的是_____。①合金属于合成材料②合金由两种或两种以上的金属组成③铝在空气中不易锈蚀而铁易锈蚀,所以铁的金属活动性比铝强④一氧化碳还原氧化铁的反应不属于基本反应类型
(1)写出下列化学式甲_______乙__________________
CuSO4(合理即可)
(2)写出图中涉及的化学方程式① ______________________________________________________② ______________________________________________________③ ______________________________________________________④ ______________________________________________________⑤ ______________________________________________________⑥ ______________________________________________________⑦ ______________________________________________________⑧ ______________________________________________________⑨ ______________________________________________________
(1)写出下列化学式甲________乙___________
(2)写出图中涉及的化学方程式① ________________________________________________________② ________________________________________________________ _________________________________________________________③ ________________________________________________________④ ________________________________________________________⑤ ________________________________________________________ _________________________________________________________⑥ ________________________________________________________ _________________________________________________________
1.反应原理:_________________________________(用化学方程式表示)。2. 实验装置
3.操作要点(1)实验开始时,先通一段时间CO,再点燃酒精喷灯给硬质玻璃管加热。目的:__________________________________________________________。
排尽装置内的空气,防止一氧化碳与空气混合在加热时发生爆炸
(2)实验结束,先熄灭酒精喷灯,继续通入CO直至硬质玻璃管冷却。目的:①防止硬质玻璃管内压强突然减小,导致澄清石灰水倒吸进入玻璃管,玻璃管有炸裂的可能;②____________________。(3)装置最右端酒精灯的作用是_________________________________。【小结】一氧化碳“早出晚归”,酒精喷灯“迟到早退”。4.实验现象及原理解释(1)硬质玻璃管中的现象:__________________________;反应原理:______________________________(用化学方程式表示,下同)。(2)试管中的现象:__________________;反应原理:_____________________________。(3)右端玻璃管口处气体燃烧,产生蓝色火焰。反应原理:______________________。
除去尾气中的CO,防止其污染空气
红棕色粉末逐渐变成黑色
5.微型装置:下图所示微型装置的优点是_________________________________。
6.尾气处理:(1)尾气处理除燃烧法外,是否还有其他方法?可采用气球收集;一氧化碳难溶于水,也可用排水法收集。
(2)若用右图所示装置进行实验,是否需要添加尾气处理装置,并说明理由______________________________________________________________________。
节约药品,节约能源(合理即可)
不需要,因为未反应的一氧化碳进入B装
置中,不会逸散到空气中(合理即可)
例 如图1为教材中实验室模拟炼铁的实验装置,试按要求填空:
(1)实验中,可观察到硬质玻璃管中的粉末由红棕色逐渐变黑,说明Fe2O3转化为了______(填化学式)。(2)试管中的澄清石灰水变浑浊,该反应的化学方程式为__________________________________。(3)实验时,先通入一段时间CO,待__________________后,再点燃酒精喷灯。
(5)(2019潍坊改编)用如图所示装置处理尾气,除了可以防止CO对空气的污染,还具有的优点是_______________________。
(4)用点燃法处理尾气时,发生反应的化学方程式为________________________。
①分析工艺流程,三脱装置中发生反应的化学方程式是_______________________________________________________________________________________________________________________(写一个)。②向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中的作用________(填一种仪器的名称)。③在钢水铸件机中,高温钢加工成钢制零件时,充入氮气的作用是____________。
(6)(2018山西)在一次实践活动中,小红和同学们一起参观了某钢铁公司,大家对矿石选取、冶铁和炼钢的工艺流程(如图2)、生铁和钢的区别等有了全新的认识。
(7)(2017河南)实验室可利用图3装置制取纯净、干燥的CO,然后用CO还原Fe2O3并检验气体产物,已知CO发生装置中的反应为 。要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置——____________________——尾气处理装置(用字母表示)。
hgefcdb(或hgefdcb)
(8)(2018毕节)某混合气体可能含有H2、CO2、CO、H2O(g)中的两种,一化学兴趣小组在老师指导下设计实验进行探究活动,已知:无水硫酸铜吸水后由白色变为蓝色,实验装置如图4(假设每步操作中,参加反应的气体都完全反应或吸收)。
①若观察到的现象是A中白色固体变蓝,B中溶液变浑浊,其它均无明显现象,据此得出混合气体中含有______和_______(填对应成分化学式)。
②若混合气体的组成是H2和CO,实验时,先通入混合气体,目的是___________________,再点燃D处酒精灯,一段时间后,观察到A、B无明显变化,D中黑色固体变成_____色,E中白色固体变蓝,F中溶液变浑浊,说明H2和CO均发生______反应(填“氧化”或“还原”)
排尽装置内的空气
2.实验结论铁制品生锈的主要条件是铁与空气中的_________、_______同时接触。
例 为了探究铁锈蚀的条件,某同学设计了如下实验,请回答下列问题:
(1)实验前,必须将铁钉打磨光亮的原因是______________________________。
除去铁钉表面的污物或氧化物
(2)图②中,最易生锈的部位是_____,图③中干棉球和生石灰的作用是__________。(3)设计对比实验①和②的目的是_________________________;能验证铁钉的锈蚀与水有关的实验组合是_______。(4)为探究盐溶液对铁钉锈蚀的影响,对比②和④,可得出的实验结论是________________________。
验证空气对铁生锈的影响
食盐水可以加速铁的锈蚀
(5)(2017河北)某同学根据铜绿的成分Cu2(OH)2CO3作出猜想:金属铜锈蚀的条件除有氧气和水外,还必须有二氧化碳。为证明“必须有二氧化碳”,需要进行如图所示实验中的( )
A. 甲和乙 B. 甲和丁 C. 乙和丁 D. 丙和丁
(6)(2017葫芦岛)为了探究铁制品锈蚀的条件做了如图三个对比实验。一周后,B、C中无明显现象,A 中的现象是___________、_________________。
(7)(2019日照改编)如图利用图甲所示装置将干燥的O2从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满O2后,在导管b处连接一活塞推至底部的注射器,收集20 mLO2后在导管a处连接乳胶管并用止水夹夹紧,如图乙所示。一段时间后,观察到U形管内只有潮湿的普通铁丝出现较多红褐色锈斑,干燥的普通铁丝和潮湿的纯铁丝无明显变化。
①检查U形管内是否已充满O2的方法是______________________________________ ______________________________。
②铁制品锈蚀的条件之一是需要O2,在此实验中能支持此条件的证据是___________________________________________________。③通过对比实验现象,此实验还可得出铁制品锈蚀的条件是____________________。
将带火星的木条放置在b导管口,若木条复燃,则证明U形管内已充满O2
观察到注射器活塞向左移动(或注射器内O2体积减小)
水分和金属的内部结构
(8)化学兴趣小组的同学对溶液的酸碱性对铁钉生锈的快慢是否有影响,溶液中的阴离子种类对铁钉锈蚀的快慢是否有影响展开了如下探究。按图1装置进行实验,测得装置中氯化铵、硫酸铵溶液上方氧气浓度的变化曲线如图2。
②实验中溶液上方氧气浓度变化越大,证明铁钉锈蚀速率________。
①将规格、材质相同的打磨过的铁钉放入下列不同溶液中,测得有关数据如下表:
③根据表中数据可知,铁钉在____(填“酸”、“碱”或“中”)性溶液中更易锈蚀,其中铁钉在含有________(填“氯离子”或“硫酸根离子”)的溶液中锈蚀更快。④图2曲线先陡后平说明铁生锈速率的规律是_________。⑤将铁生锈的原理用于食品脱氧时,要求铁能快速生锈从而达到脱氧的目的,因此食品脱氧剂中除了加入铁粉、炭粉外,还要加入________________。
1.(2015厦门)夏天防雷电,远离金属。这是因为金属具有( )A. 导电性 B. 导热性 C. 延展性 D. 光泽2.(2019莆田5月质检节选)微笑自行车、高铁、网购和扫码支付等方便我们的日常生活。高铁车体外壳采用铝合金材料,是利用该合金的______________________________________________性能。3.(2016龙岩节选)在“化解过剩产能”座谈会上,李克强总理指出:我国钢铁产能过剩,却不具备生产模具钢、圆珠笔“圆珠”的能力,产业结构极不合理,模具钢是制造仪器仪表加工模具的特种钢,生铁和钢属于铁的_______。
硬度大(或密度小或强度高或耐腐蚀等合理即可)
4.(2018福建10题3分)氧烛是一种便携式供氧设备(如图)。产氧药块由氯酸钠(分解时吸收热量为Q kJ·g-1)、金属粉末(燃烧时提供氯酸钠分解所需的热量)和少量催化剂组成。某兴趣小组拟自制氧烛,为确定每100 g氯酸钠需要添加金属粉末的质量[m(金属)],查得下表数据:
下列说法正确的是( )A. m(金属)只能采用不同比例的金属和氯酸钠在空气中实验获得B. m(金属)只能通过氯酸钠分解吸收热量与金属燃烧放出热量进行理论计算确定C. m(金属)过小将使氧烛中反应无法持续进行,过大将减小产氧量D. 不用催化剂时,分别使用铁、铝、镁作燃料,m(Fe)最小
5.(2014三明)“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利。下列关于鉴别“愚人金”与黄金的实验方案,合理的是( )①比较硬度,硬度小的是“愚人金”;②灼烧,表面变色的是“愚人金”;③浸没在稀硫酸中,表面有气泡产生的是“愚人金”;④浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”。A. ①③B. ②④C. ②③D. ①④
6.(2015南平)为探究锌、铜、镍三种金属的性质,某兴趣小组进行如下实验。【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光。【实验二】取粗细、长短相同的锌丝、铜丝、镍丝均与50 mL稀盐酸反应,实验记录如下:
【实验三】金属锌、铜和稀盐酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光。(1)实验一的现象说明三种金属都具有______性。
(2)镍与稀盐酸反应生成氯化镍(NiCl2)和氢气,反应的化学方程式是_____________________________,铜不能与稀盐酸发生化学反应的原因是___________________________________________________________________。(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是____________________________________________________________。(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变。下列关于实验三分析正确的是____(填选项)。A. 铜的金属活动性变得比锌强B. 铜与稀盐酸发生了置换反应C. 该装置将化学能转化为电能
铜在金属活动性顺序中位于氢后,不能置换出酸中的氢(或其他合理答案)
镍丝与50 mL 3%的稀盐酸反应(或锌丝与50 mL 15%的稀盐酸反应)
7.(2019龙岩5月质检)生活中常用锡纸包装食品、烧烤食品。市售的锡纸也称作铝箔、铝箔锡纸。某研究小组对锡纸中的金属到底是锡还是铝展开了如下探究。查阅资料:在空气中锡和铝的表面会形成一层致密的氧化膜,从而对金属起到保护作用;四氯化碳不与金属、水反应,且不溶于水。
【实验1】如图1,在U形管内注入四氯化碳液体,从右侧注入5 mL 20%的盐酸,从左侧注入5 mL 15%的盐酸,然后将锡纸卷成圆筒状并伸入U形管右侧,观察到锡纸筒表面先有少量气泡、稍后有大量气泡。此时,将锡纸筒推入四氯化碳层备用(如图2)。
【实验2】取一根粗细与锡纸筒一致的铁钉,用砂纸打磨后放入试管中,倒入5 mL稀盐酸(如图4),同时将U形管中的锡纸筒推入左侧盐酸中(如图3)。对比观察图3左侧和图4的实验现象。【实验结论】锡纸中的金属是铝。(1)“实验1”中,U型管右侧盛装的20%盐酸的作用是_____________________。(2)当锡纸筒表面产生大量气泡时,才能把锡纸筒推入四氯化碳层备用的原因是_______________________________,产生大量气泡的化学方程式是______________________________________。(3)图4试管中盐酸的质量分数应为______。
使锡纸筒表面的氧化膜完全除去
(4)研究小组的同学“对比观察图3左侧和图4的实验现象”,推断出“锡纸中的金属是铝”。你认为该现象是__________________________________________________,推断的理由是_____________________________。
8.(2016莆田)将金属M放入稀硫酸中,M溶解并产生气泡;将M放入硫酸锌溶液中,无明显现象。根据以上实验事实,推测M可能( )A. CuB. AgC. MgD. Fe
图3左侧锡纸筒与盐酸反应比图4中铁与盐酸反应更剧烈
铝比铁活泼、而铁又比锡活泼
9.(2016宁德)将a、b、c三种金属分别投入稀盐酸中,只有b溶解并产生气泡;把a和c分别放入硝酸银溶液中,在a表面有银析出,c没有变化。则a、b、c三种金属可能是( )A. Fe、Cu、AgB. Cu、Ag、FeC. Cu、Zn、AgD. Ag、Zn、Cu10.(2014泉州)硬铝的组成金属有铝、镁、铜、锰等。已知:锰丝放入稀硫酸中,有气泡产生;锰丝放入硫酸铝溶液中,表面没有金属析出。下列有关金属的活动性强弱判断错误的是( )A. Mn>CuB. Al>MnC. Mg>AlD. Mn>Mg
11.(2016三明)如图“→”表示一种金属能把另一种金属从其盐溶液中置换出来。则甲、乙、丙三种金属的活动性由强到弱的顺序是( )A. 甲、乙、丙B. 乙、丙、甲C. 丙、甲、乙D. 甲、丙、乙12.(2015泉州节选)A、B、C、D是初中化学常见的物质,在一定条件下四种物质存在如下转化关系:A+B→C+D,若A、C都是金属单质,B、D都是盐,请写出一个符合要求的化学方程式:____________________________________________________,该反应说明金属活动性:A_____(选填“<”或“>”)C。
13.(2019莆田5月质检)下列常见金属的活动性顺序中,关于X、Y、Z三种金属的推测正确的是( )
K Ca Na Al Zn Sn Pb (H) Hg Ag Pt Au
A. X、Y、Z都能与稀硫酸发生反应B. X、Y、Z对应的金属可能是Mg、Fe、CuC. X、Y、Z三种金属元素都位于元素周期表的第三周期D. 常温下,X、Y、Z都能将AgCl中的Ag置换出来
14.(2019福建14题8分)《天工开物》中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如图所示),泥封,“其底铺薪,发火煅”“冷定毁罐取出”。(已知:锌的熔点为419℃,沸点为907℃)
(1)反应区中,ZnCO3分解生成ZnO和另一种氧化物,反应的化学方程式为_____________________________________________________。C与ZnO发生置换反应得到Zn,反应中化合价升高的元素是_____________。(2)冷凝区中,锌由气态转化为液态,理论上该区应控制的温度范围是__________℃。(3)“冷定”后方能“毁罐”取锌,从化学变化角度解释其原因:___________________________________________________________________。
(反应条件写“△”也对)
温度下又被氧化成氧化锌
(或 )
15.(2019福建18题6分)改革开放以来,我国钢铁工业飞速发展,近年来钢铁产量已稳居世界首位。某钢铁厂采用赤铁矿(主要成分为Fe2O3)炼铁,反应原理为 。若该厂日产含铁1.4×104 t的生铁,至少需要含Fe2O380%的赤铁矿的质量是多少?(要求写出计算过程)
16.(2015厦门节选)用如图装置模拟工业炼铁:若B处盛放氧化铁粉末,在A处通入一氧化碳一段时间后,B处下方用喷灯加热,B处可观察到的现象为_____________________,尾气处理的方法为______________________________________________。《自然》杂志刊载“绿色炼铁”技术:电解熔融的氧化铁得到铁和氧气,该反应的化学方程式:_________________________,该炼铁技术另一种产物的用途为_____________________。
固体由红色变为黑色
将酒精灯放于右端导管口点燃尾气(或其他合理答案)
17.(2017福建5题3分)下列四支试管中,铁钉锈蚀最快的是( )
(1)方案一存在的问题是__________________________________________。(2)小组同学按方案二进行实验,一段时间后发现B试管固体表面出现绿色较为明显,由此可知______(填“黄铜”或“纯铜”)抗锈蚀性较强。
没有在相同条件下进行对比实验(合理即可)
18.(2014宁德节选)黄铜是铜锌合金,铜的质量分数为67%~70%。黄铜中锌含量越高硬度越大。某兴趣小组对纯铜和黄铜的抗锈蚀性能进行探究。【资料】铜锈蚀是铜与空气中的O2、H2O、CO2作用生成Cu2(OH)2CO3(绿色固体)。该兴趣小组设计了如图所示两个实验方案。
(1)比较与分析铁钉在不同条件下生锈程度。同学们设计了如图1所示的对比实验,并进行实验。4 h后观察到:试管Ⅰ、Ⅱ中的铁钉均生锈,试管Ⅰ铁钉生锈程度大于试管Ⅱ;试管Ⅲ中铁钉不生锈。①试管Ⅰ铁钉生锈程度大于试管Ⅱ的原因是_______________________________。②试管Ⅲ中,使用冷却后的沸水的目的是______________________。③铁钉生锈的其中一步反应是铁与氧气、水共同作用生成氢氧化亚铁,该反应的化学方程式是_____________________________。
试管Ⅰ中铁钉与氧气接触面积更大
19.(2019泉州5月质检)化学研究性学习小组对铁生锈开展深入的探究。
(2)探究植物油能否完全隔绝氧气。同学们第二天观察,发现试管Ⅲ中的铁钉也有些锈斑。为此大家又做了如下探究。【进行实验】实验1:将涂水的铁片置于植物油中,并放置于密封的无氧容器中,8 h后观察铁片无锈迹。排除植物油和铁片上的水中微量氧气对铁片锈蚀的影响。实验2:将涂水的铁片置于植物油中,并敞口放置于空气中,8 h后发现少量锈斑,再过一段时间后观察,锈斑面积增大。①综合以上两个实验,可得出的结论是_________________________________。【交流讨论】②查阅文献获知,植物油对空气中的水分有较好的隔绝效果,请设计实验方案加以验证:__________________________________________________________________________。
植物油不能完全隔绝空气中的氧气
将干燥的铁片置于植物油中,并敞口放置于潮湿的空气中,8h后观察到铁片无锈迹
(3)在老师的指导下,进一步探究酸性条件下铁锈蚀的情况。【查阅资料】Ⅰ.溶解氧是指溶解在水里氧气的量,用每升水里氧气的毫克数表示。Ⅱ.醋酸具有酸的通性,能与活泼金属发生反应。【实验探究】将4份等质量的铁粉和碳粉的混合物分别加入相同体积不同pH的醋酸的水溶液中,分别用溶解氧传感器和压强传感器采集数据获得图2和下表。
①从图2中可知,在酸性条件下水溶液中溶解氧随时间变化均呈下降趋势,原因是______________________________。②从表中可知pH为2.0~3.0时,实验后系统中气体压强增大,是因为_________________________________________________________________。
铁生锈不断消耗氧气(合理即可)
铁与醋酸反应产生氢气的体积大于铁生锈消耗氧气的体积(合理即可)
20.(2016福州)下列与金属相关的说法正确的是( )A. 生铁和钢的性能完全相同B. 炼铁过程只发生物理变化C. 常温下所有金属均为固态D. 铁在潮湿的空气中易生锈
21.(2014厦门)“金银铜铁锡”俗称五金,相关叙述错误的是( )A. 铁锅应用了铁的导热性B. 金属银可与硝酸铜溶液发生置换反应C. 金的化学性质最不活泼D. 焊锡(锡铅合金)比锡熔点低
22.(2015龙岩)锂常被人们誉为“金属味精”。已知锂的核电荷数为3,锂比铝活泼。下列说法错误的是( )A. 锂是一种金属材料B. 锂原子核外有3个电子C. 锂具有良好的导电性D. 锂不能与盐酸反应23.(2019三明5月质检节选)2019年1月3日,我国“嫦娥四号”探测器成功登陆月球。“嫦娥四号”的制作材料有硅、石墨、铝合金、钛合金和铜等。(1)纯金属制成合金,性能会发生改变,请写出其中一条__________________________________________。(2)请写出一种比较钛和铜金属活动性强弱的方法____________________________________________(不要写现象与结论)。
抗腐蚀性能变好(或强度更高或硬度更大等)
将钛放入硫酸铜(氯化铜)溶液中(合理即可)
24.(2019厦门5月质检)锌锰电池(俗称干电池)在生活中应用广泛,其构造如图1。(1)根据图1判断,属于金属材料的有铜帽和_____。
(2)利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到ZnSO4溶液,主要流程如图2。
已知:①写出过程Ⅱ中生成金属单质的化学方程式:______________________________。②过程Ⅲ中加入溶液A充分反应后,还需进行的主要操作是_______。③下列说法正确的是_______(填标号)。a. 过程Ⅰ中H2O2也有可能分解生成氧气b. 固体E是混合物c. 溶液F含有的ZnSO4比溶液B多
25.(2014龙岩)铁是生产、生活中应用广泛的金属材料。(1)酸菜等酸性的食物不宜用铁质器具长期盛放,因为_____________________________________。(2)为减缓海水对铁质海轮外壳的腐蚀,制造海轮时,会在海轮船底四周镶嵌比铁更活泼的金属。下列金属适宜船底镶嵌的是______(填选项)。A. Pb(铅)B. CuC. Pt(铂)D. Zn(3)对铁“发蓝”处理,其表面将形成致密氧化膜而有效避免腐蚀。①致密氧化膜能有效阻止铁锈蚀的原因是___________________________________________;
酸菜中的酸能与铁反应而腐蚀铁制容器
致密氧化膜阻止了外界空气和水与内部铁接触
②“发蓝”过程的化学方程式如下,式中X的化学式为________;③为检验“发蓝”处理的铁质零件表面是否形成致密氧化膜,将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质。由此可知该零件“发蓝”处理效果_____(填“好”或“不好”),因为__________________________(用化学方程式表示)。
26.(传统文化)(2019厦门一中一模)明代科学家宋应星所著的《天工开物》中详细记述了金、铜、铁、镁等金属的开采和冶炼方法。记述的金属中活动性最强的是( )A. 金 B. 铜 C. 铁D. 镁27.(传统文化)(2019杭州)有一种在古籍里称为鋈的银白色铜合金,是古代云南、四川地区的特产,其主要成分是铜、锌、镍等金属单质。炼制时需要黑铜矿(主要成分是CuO)、硫化镍矿(主要成分是Ni2S3)等多种矿物。下列有关说法不正确的是( )A. 鋈属于金属材料B. 鋈的样品在足量稀盐酸中能全部溶解C. Ni2S3中镍元素呈+3价D. 黑铜矿跟木炭共热能生成单质铜
28.(2019嘉兴)科学兴趣小组对金属R的活动性探究时发现:将R放入稀硫酸中,有气泡产生,同时生成正二价的盐;将R放入ZnSO4溶液中无任何变化。根据以上信息下列化学方程式正确的是( )A. R+MgCl2=== RCl2+MgB. R+2AgCl=== RCl2+2AgC. R+2HCl=== RCl2+H2↑D. Al+RSO4=== AlSO4+R
29.(传统文化)(2019海南)我国西汉时期,在《淮南万毕术》中记载“曾青得铁则化为铜”,意思是可溶性的铜的化合物与铁发生反应得到单质铜,此为现代湿法冶金的先驱。下列有关说法正确的是( )A. 由该反应可推测出铜能与稀硫酸反应B. 该反应证明了铁的金属活动性比铜强C. 若铁足量,溶液的颜色将逐渐变为无色D. 该反应属于复分解反应
30.(2019泰安)如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )①一段时间后,铁丝会由下向上出现锈蚀现象②一段时间后,水面处铁丝锈蚀严重③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关A. ①②B. ②④C. ②③D. ③④
(1)“明”字上的现象是____________________________________________________。(2)“和”字上产生气泡,用化学方程式解释:_____________________________。
“明”字位置逐渐出现红色固体,溶液由蓝色变为无色
31.(2019北京)用粗木棍在涂有蜡的锌板上写“明”“和”两个字,露出下面的锌板。向“明”字上滴加CuSO4溶液,向“和”字上滴加盐酸。
32.(传统文化)(2019淄博)央视综艺节目《国家宝藏》,在重温华夏文明中让我们感受到文化传承背后的科学温度——文化自信、民族自豪。展出的文物绚丽多彩,这些色彩的颜料主要来源于矿物和植物。如:彩陶罐的色彩用到的矿物颜料有蓝铜矿【主要成分CuCO3·Cu(OH)2】。温度达200 ℃时,蓝铜矿可生成氧化铜等物质,写出反应的化学方程式_______________________________________,此反应类型属于____________。有些颜料是从铁矿石中提取的,请写出一种铁矿石的名称_____________________________________。
赤铁矿(或磁铁矿或黄铁矿或菱铁矿)
33.(2019杭州)海绵铁是多孔隙的块状固体物质,主要成分是铁单质,常用于除去工业循环冷却水中的溶解氧。当含有氧气的水通过海绵铁时,其中铁单质跟氧气等物质发生化合反应,生成不溶于水的红褐色氢氧化物。回答:(1)写出上述生成红褐色氢氧化物的化学方程式______________________________。(2)海绵铁除去溶解氧的反应中,氧气表现了________性(选填“氧化”或“还原”)。跟成分相同的普通铁块相比较,海绵铁除氧效果要好得多,原因是__________________________________________________________。
海绵铁中多孔隙,增大了跟反应物的接触面积,加快了反应速率
34.(传统文化)(2018南平九上期末质检节选)我国古今有关金属的故事给人以智慧。(1)吴王夫差青铜剑,时隔二千多年出土,依然寒光逼人。青铜属于_______(填“纯金属”或“合金”)。(2)明“万历通宝”为黄铜制品(铜锌合金)。取黄铜样品于试管中,注入稀硫酸会产生大量气泡,该反应的化学方程式是____________________________ 。(3)大型客机C919使用了锂铝合金,该合金的硬度_____(填“<”、“>”或“=”)纯铝的硬度。
35.(数字化实验)(2019河南改编)某化学兴趣小组的同学利用压强传感器、数据采集器和计算机等数字化实验设备,测定铝片与足量稀硫酸反应时气体压强的变化,实验结果如图所示。(1)开始一段时间气体压强几乎不变,其原因是________________________________________________________________。(2)写出m点时所发生反应的化学方程式________________________________。
铝片表面有一层致密的氧化铝薄膜,稀硫酸与氧化铝反应时不生成气体
36.(新科技)(2019南京)2019年1月3日嫦娥四号探测器成功着陆在月球背面,并通过“鹊桥”中继星传回了近距离拍摄的月背影像图,揭开了月背的神秘面纱。“鹊桥”号上伞状通信天线是用表面镀金的钼丝编织而成的金属网。这种镀金钼丝纤维只有头发丝四分之一细,其性能稳定。“编”出来的金属网既 强韧,受得住发射飞行外力“折腾”,又能在太空中收放自如,可以说“刚柔并济”。(1)钼能制成细丝,是利用了钼的______性。(2)钼丝表面镀金,原因之一是利用了金的化学性质________。(3)我国的钼矿储量非常丰富,用辉钼矿(MS2)制备钼的过程如下:
2022版中考化学大一轮培优训练及课件专题四 常见的溶液课件: 这是一份2022版中考化学大一轮培优训练及课件专题四 常见的溶液课件,共29页。PPT课件主要包含了常见的溶液,NH4NO3,不饱和溶液,饱和溶液,蒸发溶剂,降低温度,固体溶解度,溶解度,影响因素,气体溶解度等内容,欢迎下载使用。
2022版中考化学大一轮培优训练及课件微专题1 气体的制取课件: 这是一份2022版中考化学大一轮培优训练及课件微专题1 气体的制取课件,共44页。PPT课件主要包含了发生装置及原理,反应物状态,反应条件,A固体加热型,B固液常温型,化学性质,可以控制反应速率,收集装置,移出导管,熄灭酒精灯等内容,欢迎下载使用。
2022版中考化学大一轮培优训练及课件专题十四 化学与能源和资源的利用 44PPT课件: 这是一份2022版中考化学大一轮培优训练及课件专题十四 化学与能源和资源的利用 44PPT课件,共44页。PPT课件主要包含了三者缺一不可,氧气或O2,可燃物,氧气或空气,最低温度,着火点,原理及方法,破坏燃烧条之一即可,有关图标,生活中的安全常识等内容,欢迎下载使用。












