

高中化学人教版 (2019)选择性必修2第一章 原子结构与性质第二节 原子结构与元素的性质第3课时一课一练
展开第三课时
1.下列叙述正确的是( )
A.常温下,0族元素的单质均为气体
B.同一周期(第一周期除外)主族元素中,碱金属元素的第一电离能最大
C.同一周期(第一周期除外)主族元素中,第ⅦA族元素的原子半径最大
D.同主族(第ⅠA族除外)元素中,第二周期元素的电负性最小
2.第三周期主族元素的某些性质随原子序数的变化如图所示,则轴可表示( )
①第一电离能 ②电负性 ③原子半径
④简单离子半径 ⑤最高正化合价 ⑥形成简单离子转移的电子数
A.①②③④⑤⑥ B.①②③⑤ C.②④⑤ D.②⑤
3.几种短周期主族元素在周期表中的相对位置如图所示,已知元素X的原子核外电子数是D的2倍。下列说法不正确的是( )
A.第一电离能:X<Y
B.X位于第三周期ⅡA族,其单质可通过电解其熔融氯化物制备
C.四种元素的最高价氧化物对应的水化物中酸性最强的是
D.气体分子的电子式为
4.C、Si和P元素的前四级电离能变化趋势如图所示。下列说法正确的是( )
A.元素电负性:c>b>a B.最简单气态氢化物的热稳定性:c>a>b
C.简单氢化物的沸点:a>c D.第五电离能:a>c>b
5.前四周期元素X、Y在元素周期表中的相对位置如图所示,X的基态原子的价电子排布式为,下列说法不正确的是( )
A.X元素的电负性大于Y元素的电负性 B.
C.Y位于元素周期表中第四周期第ⅤA族 D.原子半径:Mg<X
6.部分短周期元素的原子序数与其某种常见化合价的关系如图所示。若用原子序数代表所对应的元素,则下列说法正确的是( )
A.和属于同种核素 B.第一电离能:,电负性:
C.最简单气态氢化物的热稳定性: D.a和b形成的化合物不可能含共价键
7.a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族。a的原子结构示意图为,b、c形成的化合物的电子式为,下列说法正确的是( )
A.原子半径:a>c>d>b B.电负性:a>b>d>c
C.原子序数:d>a>c>b D.最高价氧化物对应水化物的酸性:c>d>a
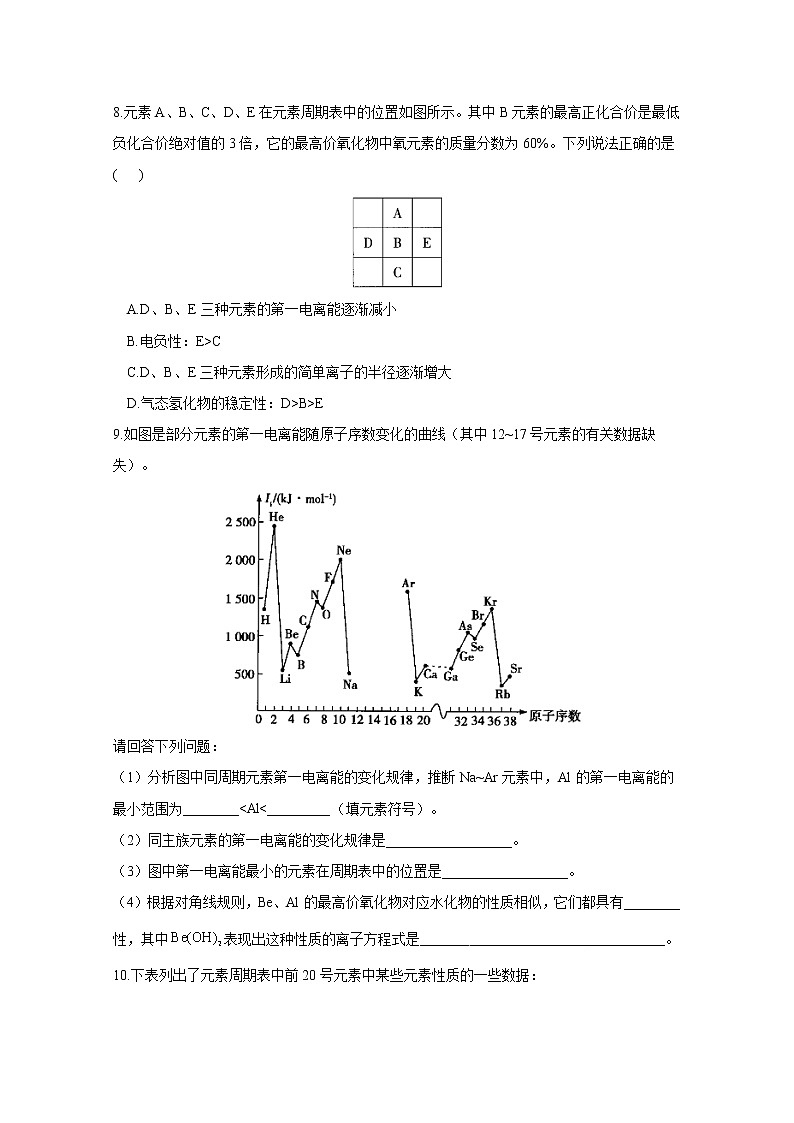
8.元素A、B、C、D、E在元素周期表中的位置如图所示。其中B元素的最高正化合价是最低负化合价绝对值的3倍,它的最高价氧化物中氧元素的质量分数为60%。下列说法正确的是( )
A.D、B、E三种元素的第一电离能逐渐减小
B.电负性:E>C
C.D、B、E三种元素形成的简单离子的半径逐渐增大
D.气态氢化物的稳定性:D>B>E
9.如图是部分元素的第一电离能随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
请回答下列问题:
(1)分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的最小范围为________<Al<_________(填元素符号)。
(2)同主族元素的第一电离能的变化规律是__________________。
(3)图中第一电离能最小的元素在周期表中的位置是__________________。
(4)根据对角线规则,Be、Al的最高价氧化物对应水化物的性质相似,它们都具有________性,其中表现出这种性质的离子方程式是_______ ___________。
10.下表列出了元素周期表中前20号元素中某些元素性质的一些数据:
原子半径/ | 最高价态 | 最低价态 | |
① | 1.02 | +6 | -2 |
② | 2.27 | +1 | — |
③ | 0.74 | — | -2 |
④ | 1.43 | +3 | — |
⑤ | 0.77 | +4 | -4 |
⑥ | 1.10 | +5 | -3 |
⑦ | 0.99 | +7 | -1 |
⑧ | 1.86 | +1 | — |
⑨ | 0.75 | +5 | -3 |
⑩ | 1.17 | +4 | -4 |
试回答下列问题。
(1)以上10种元素中,第一电离能最小的是_________(填序号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质有_________(填化学式,两种即可);元素⑨和⑩形成的化合物的化学式为_________;元素①的基态原子价电子排布式是_________。
(3)①、⑥、⑦、⑩四种元素的简单氢化物的稳定性由强到弱的顺序是_________(用化学式表示)。
(4)③和⑨两元素相比,非金属性较弱的是_____ ____(填名称),可以验证该结论的是_________(填序号)。
A.气态氢化物的挥发性 B.单质分子中的键能 C.两元素的电负性
D.含氧酸的酸性 E.最简单氢化物的稳定性 F.两单质在自然界中的存在形式
11.A、B、C、D是四种短周期元素,E是过渡元素,A、B、C同周期,C、D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E元素的正三价离子的3d亚层为半充满。回答下列问题:
(1)写出下列元素的名称:A__________, B_________,
C________,D________。
(2)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是________。
(3)D的氢化物比C的氢化物的沸点________(填“高”或“低”),原因是______________________________________。
(4)E元素的正三价离子的电子排布式为____________。E元素在周期表中的位置是________。
(5)写出A的最高价氧化物与B的最高价氧化物的水化物反应的离子方程式_________________________________________________________。
12.在元素周期表前四周期中,有A、B、C、D四种元素,它们的原子序数依次增大,A原子有3个未成对电子;B元素原子次外层有8个电子,1 mol B单质与足量盐酸反应可生成1 mol H2,B单质不易与冷水反应;C元素的+3价离子的d轨道是半充满的;D元素易形成-1价离子。
(1)填写下表:
元素 | A | B | C | D |
名称 |
|
|
|
|
电子排布式 |
|
|
|
|
轨道表示式 |
|
|
|
|
属于哪个区 |
|
|
|
|
(2)A元素位于第________周期________族,B元素位于第________周期________族。
(3)C元素位于第________周期________族,C2+的电子排布式为________。
(4)写出B与D两种元素形成的化合物的电子式:__________,此化合物属于________化合物。
(5)四种元素中电负性最大的元素是________(用元素符号表示,下同),第一电离能最小的元素是________。A、B两种元素的原子半径大小关系是________________,单核离子的离子半径大小是________。
答案以及解析
1.答案:A
解析:同一周期(第一周期除外)主族元素中,第一电离能从左到右呈增大趋势,碱金属元素的第一电离能最小,B项错误;同一周期(第一周期除外)主族元素中,原子半径从左到右逐渐减小,故第ⅦA族元素的原子半径最小,C项错误;一般来说,同主族元素,电负性从上到下逐渐减小,故同主族(第ⅠA族除外)元素中,第二周期元素的电负性最大,D项错误。
2.答案:D
解析:第一电离能:Mg>Al,P>S,①错误;一般来说,同周期主族元素从左到右,电负性逐渐增大,②正确;同周期主族元素从左到右,原子半径逐渐减小,③错误;对于电子排布相同的离子,核电荷数越大,离子半径越小,同周期金属元素形成的简单阳离子的半径从左到右逐渐减小,④错误;第三周期主族元素的最高正化合价由+1→+7,⑤正确;同周期主族元素原子形成简单离子转移的电子数,从左到右,金属元素原子逐渐增多,非金属元素原子逐渐减少,⑥错误。综上所述,D项正确。
3.答案:A
解析:D和E位于第二周期,X和Y位于第三周期,设D原子核外电子数为,则X原子核外电子数为,又因X原子核外电子数是D的2倍,故,解得,则D为C元素,X为Mg元素,根据元素在周期表中的相对位置可知,Y是Al元素,E为N元素。A项,元素的第一电离能:X>Y,错误;B项,Mg为第三周期ⅡA族元素,镁单质可通过电解熔融制备,正确;C项,元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,四种元素中非金属性最强的是N元素,所以酸性最强的是,正确;D项,气体分子为,其电子式为,正确。
4.答案:D
解析:同主族元素自上而下第一电离能逐渐减小,P元素原子3p能级为半充满稳定状态,其第一电离能高于同周期相邻元素的第一电离能,故三种元素中Si的第一电离能最小,由图中第一电离能可知,c为Si元素,P元素原子3s能级为全充满稳定状态,故其第四电离能与第三电离能相差较大,可知b为P元素,则a为C元素。一般来说,同周期元素自左而右电负性逐渐增大,同主族元素自上而下电负性逐渐减小,故Si的电负性最小,A项错误。非金属性越强,最简单气态氢化物越稳定,Si的非金属性最弱,故的热稳定性最差,B项错误。没有氢键存在时,相对分子质量越大,分子间作用力越强,沸点越高,故的沸点较的高,C项错误。C、Si分别失去4个电子后,C的、Si的均为全充满的稳定状态,再失去1个电子时,其第五电离能与第四电离能相差较大,且第五电离能:C>Si;P失去的第四个与第五个电子均为3s能级上的电子,故其第四电离能与第五电离能相差不大,故第五电离能:C>Si>P,D项正确。
5.答案:D
解析:基态X原子的价电子排布式中p能级上排有电子,则s能级有2个电子,即,,故X的价电子排布式为,为S元素,则Y为As元素,由此可判断A、B、C项正确。同周期元素从左到右原子半径逐渐减小,即原子半径:Mg>S,D项错误。
6.答案:B
解析:短周期元素中,有-2价,有+6价,均处于第ⅥA族,可推知 为O元素,为S元素,有+1价,原子序数大于O,则为Na元素,由原子序数可知处于第三周期,有+5价,则为P元素。和的质子数相同,中子数不同,是不同的核素,互为同位素,A项错误;同周期元素从左到右第一电离能呈增大趋势,但是P原子3p能级为半充满稳定状态,第一电离能较大,则第一电离能:P>S,电负性:P<S,B项正确;元素的非金属性越强,其最简单气态氢化物的热稳定性越强,则热稳定性:,C项错误;O和Na形成的化合物中含有共价键,D项错误。
7.答案:D
解析:由a的原子结构示意图可知为2,a是硅元素,由b与c形成化合物的电子式可知c为第ⅤA族元素,b为第ⅠA族元素,因a、b、d同周期,可推知b为钠元素,d为磷元素,c为氮元素。根据元素在周期表中的位置和递变规律可知D项正确。
8.答案:B
解析:B元素的最高正化合价是最低负化合价绝对值的3倍,则最高正化合价为+6,它的最高价氧化物为,其中氧元素的质量分数为60%,设B的相对原子质量为,则有,解得,则B为S元素,可推知A为O元素、D为P元素、E为Cl元素、C为Se元素。同一周期元素从左到右,第一电离能呈增大趋势,但P元素的3p轨道为半充满状态,较稳定,其第一电离能大于S元素的第一电离能,A项错误;一般来说,同主族元素的电负性随原子序数的增大而减小,则电负性S>Se,一般来说,同周期元素自左向右,电负性逐渐增大,则电负性:Cl>S,故电负性:Cl>Se,B项正确;P、S、Cl三种元素形成的简单离子,电子排布相同,原子序数越大,离子半径越小,C项错误;元素的非金属性越强,对应的气态氢化物越稳定,则气态氢化物的稳定性:D<B<E,D项错误。
9.答案:(1)Na Mg (2)从上到下逐渐减小 (3)第五周期 第ⅠA族
(4)两 、。
解析:(1)根据第二周期元素第一电离能的变化规律可推出Al的第一电离能介于Na和Mg之间。
(2)从图中可看出,同主族元素从上到下第一电离能逐渐减小。
(3)由图可知,第一电离能最小的元素是Rb,位于第五周期第ⅠA族。
(4)根据对角线规则,Be与Al的化学性质相似,其最高价氧化物对应的水化物均具有两性,有关反应的离子方程式为、。
10.答案:(1)② (2)、 (3)
(4)氮元素 CE
解析:解本题最容易犯的错误是不能读懂表中数据,并根据数据推断各元素。由題意可知,10种元素是前20号元素,根据表中数据可推出①是S元素,②是K元素,③是O元素,④是Al元素,⑤是C元素,⑥是P元素,⑦是Cl元素,⑧是Na元素,⑨是N元素,⑩是Si元素。
(1)一般来说,在同一周期中,自左至右,元素的第一电离能呈增大的趋势;同一主族中,从上到下,元素的第一电离能逐渐减小。故在10种元素中,第一电离能最小的是②。
(2)C、P、Cl中的某两种元素形成的化合物中,和分子中的每一个原子都满足8电子稳定结构;元素⑨和⑩形成的化合物是;基态S原子的价电子排布式是。
(3)元素的非金属性越强,形成的简单氢化物越稳定,非金属性由强到弱的顺序为Cl>S>P>Si,故其简单氢化物的稳定性:。
(4)氧元素和氮元素相比,非金属性较弱的是氮元素,可通过C、E项验证。
11.答案:(1)硅 钠 磷 氮 (2)Ne F (3)高 NH3分子间形成氢键 (4)[Ar]3d5 第四周期Ⅷ族 (5)SiO2+2OH-===SiO+H2O
解析:根据A的原子结构示意图知道x=2,所以A为硅,B与A同周期且第一电离能最小,所以B为钠,C为第三周期元素且最外层有三个成单电子,所以C的价电子排布式为3s23p3,所以C为磷,D与磷同主族且为短周期元素,所以D为氮, E元素的正三价离子的3d亚层为半充满,所以E的三价离子的价电子排布式为3d5,则其原子的价电子排布式为3d64s2,所以E为铁。根据元素及化合物的性质和元素周期律解答即可。
12.答案: (1)
元素 | A | B | C | D |
名称 | 氮 | 镁 | 铁 | 溴 |
电子排布式 | 1s22s22p3 | 1s22s22p6 3s2 | 1s22s22p63s2 3p63d64s2 | 1s22s22p63s23p6 3d104s24p5 |
轨道表示式 |
|
| ||
属于哪个区 | p区 | s区 | d区 | p区 |
(2)二 ⅤA 三 ⅡA
(3)四 Ⅷ 1s22s22p63s23p63d6
(5)N Mg Mg>N Mg2+<N3-
解析:A原子有3个未成对电子,其价电子排布为2s22p3或3s23p3;1 mol B与盐酸反应产生1 mol H2,B为第ⅡA族元素Mg或Ca,又由于B比A的原子序数大且不易与冷水反应,则B为Mg元素,那么A为氮元素。C元素的+3价离子的d轨道是半充满的即3d5,那么它的原子的价电子排布式为3d64s2,C为铁元素;D元素在第四周期(原子序数比C大)且易形成-1价阴离子,它是溴元素。
人教版 (2019)选择性必修2第二节 原子结构与元素的性质第2课时练习题: 这是一份人教版 (2019)选择性必修2第二节 原子结构与元素的性质第2课时练习题,共7页。试卷主要包含了已知X、Y元素同周期,且电负性,8B等内容,欢迎下载使用。
化学选择性必修3第3节 醛和酮 糖类和核酸第2课时课后作业题: 这是一份化学选择性必修3第3节 醛和酮 糖类和核酸第2课时课后作业题
高中化学第2节 醇和酚第1课时综合训练题: 这是一份高中化学第2节 醇和酚第1课时综合训练题













