
人教版 (2019)选择性必修2第一章 原子结构与性质第一节 原子结构教案设计
展开
第一章 原子结构与性质
第一节 原子结构
第3课时 教学设计
【教学目标】
1、了解原子核外电子的运动状态,知道电子云和原子轨道。
2、知道原子核外电子的排布遵循泡利原理、洪特规则和能量最低原理。
3、掌握1~36号元素的原子核外电子排布图(或叫轨道表示式)。
【教学重难点】
1、掌握泡利原理、洪特规则和能量最低原理;
2、掌握1~36号元素的原子核外电子排布图。
【教学过程】
1.新课导入
[学生活动]根据所学知识填写学案。
[设问]原子核外电子是如何运动的呢?
[讲解]20世纪处,丹麦科学家玻尔把原子类比为太阳系,提出了原子的行星模型。认为核外电子象行星绕太阳那样绕原子核运动。1916年玻尔因此获得诺贝尔物理奖。然而,在后来的十年间,玻尔建立的行星模型被量子理论学彻底否定了。
[引入]电子在核外空间运动,能否用宏观的牛顿运动定律来描述呢?
2.新课讲授
[板书]一、电子云与原子轨道
1.电子运动的特点:
①质量极小 ②运动空间极小 ③极高速运动。
[讲解]因此,电子运动不能用牛顿运动定律来描述,只能用统计的观点来描述。我们不可能像描述宏观运动物体那样,确定一定状态的核外电子在某个时刻处于原子核外空间如何,而只能确定它在原子核外各处出现的概率。
[板书]2.电子云
[讲解]概率分布图看起来像一片云雾,因而被形象地称作电子云。电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。小点代表的是概率密度,也就是单位体积内出现的概率;小点越密,表示概率密度越大。需要注意的一点,小点不是电子。
[讲解]电子云图很难绘制,使用不便,我们常使用电子云轮廓图。绘制电子云轮廓图的目的是表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简便描述。例如,绘制电子云轮廓图时,常把电子出现的概率约为90%的空间圈出来,即精简版电子云,人们把这种电子云轮廓图成为原子轨道。
[板书]3、原子轨道
[讲解]量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。s电子的原子轨道都是球形的(原子核位于球心),能层序数越大,原子轨道的半径越大。这是由于1s,2s,3s……电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。这是不难理解的,打个比喻,宇宙飞船必须依靠推动(提供能量)才能克服地球引力上天,2s电子比1s电子能量高,克服原子核的吸引在离核更远的空间出现的概率就比1s大,因而2s电子云必然比1s电子云更扩散。
[讲解]p的原子轨道是哑铃形的,每个P能级有3个轨道,它们互相垂直,分别以Px、Py、Pz为符号。P原子轨道的平均半径也随能层序数增大而增大。
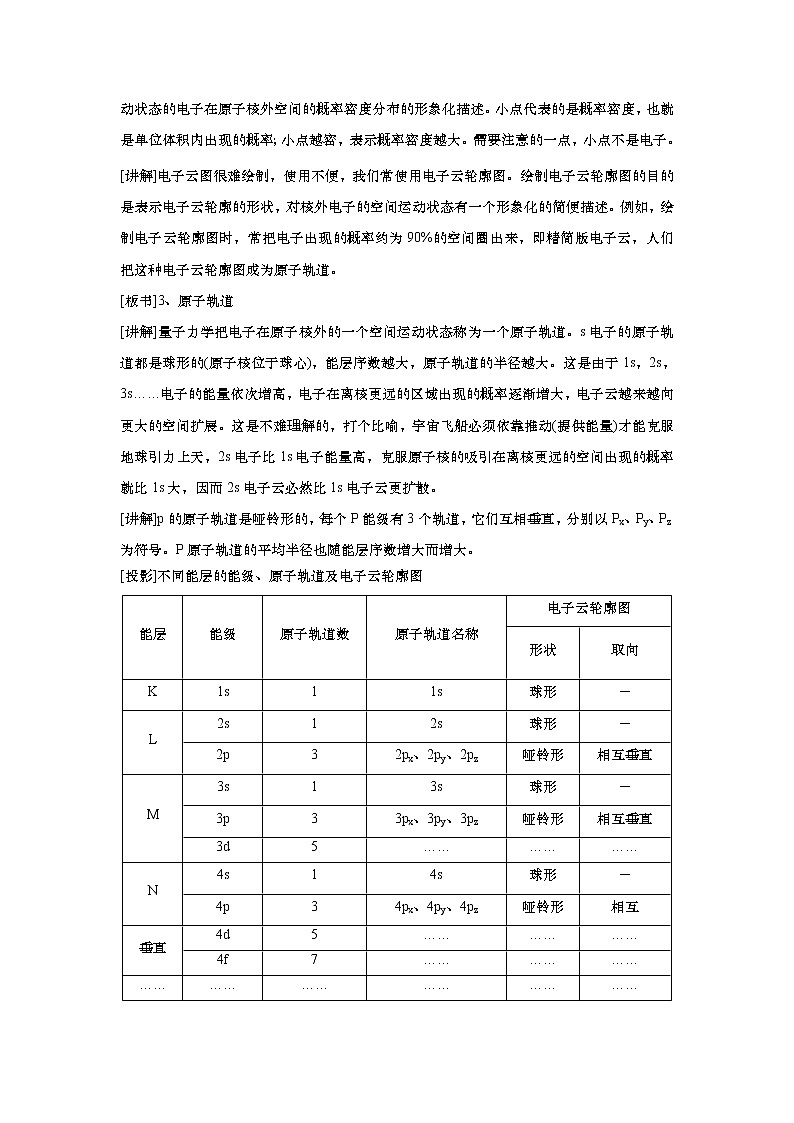
[投影]不同能层的能级、原子轨道及电子云轮廓图
能层 | 能级 | 原子轨道数 | 原子轨道名称 | 电子云轮廓图 | |
形状 | 取向 | ||||
K | 1s | 1 | 1s | 球形 | - |
L | 2s | 1 | 2s | 球形 | - |
2p | 3 | 2px、2py、2pz | 哑铃形 | 相互垂直 | |
M | 3s | 1 | 3s | 球形 | - |
3p | 3 | 3px、3py、3pz | 哑铃形 | 相互垂直 | |
3d | 5 | …… | …… | …… | |
N | 4s | 1 | 4s | 球形 | - |
4p | 3 | 4px、4py、4pz | 哑铃形 | 相互 | |
垂直 | 4d | 5 | …… | …… | …… |
4f | 7 | …… | …… | …… | |
…… | …… | …… | …… | …… | …… |
[讲解]d轨道和f轨道各有名称、形状和取向,此处不作要求。
[思考]根据刚刚我们学过的知识,试着回答一下: Zn原子中电子占有的能层数、能级数和原子轨道数分别为几?
[生]4 7 15
[讲解]量子力学告诉我们:ns能级各有一个轨道,np能级各有3个轨道,nd能级各有5个轨道,nf能级各有7个轨道.而每个轨道里最多能容纳2个电子,通常称为电子对,这是为什么呢?核外电子的排布遵循什么样的规则呢?
[投影]核外电子排布规则
(1)能量最低原理:在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。
(2)泡利原理(填多少):在一个原子轨道里,最多只能容纳2个电子,且它们的自旋状态相反。这两个电子称为电子对。
(3)洪特规则(怎么填):基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
[讲解]每个轨道里最多容纳的2个电子,通常称为电子对,用方向相反的箭头“↑↓”来表示。用□或○代表一个原子轨道,可用箭头表示一个电子,这样的式子称为轨道表示式或电子排布图。
[强调]在书写电子排布图时需要注意以下几点
[投影]
(1)表示原子轨道的□也可以用○代替,原子轨道名称也可以写在□或○的下面,一个箭头表示一个电子如Ne的电子排布图可表示为。
(2)不同能级中的□或○要相互分开,同一能级中的□或○要相互连接。
(3)整个电子排布图中各能级的排列顺序要与相应的电子排布式一致。
(4)当□或○中有2个电子时,它们的自旋状态必须相反。
(5)电子排布式给出了基态原子核外电子在能层和能级中的排布,而电子排布图还给出了电子在原子轨道中的自旋状态。另外,我们通常所说的电子排布是基态原子的电子排布。
(6)洪特规则的特例:在能量相同的轨道(同一能级)上的电子排布处于全充满(p6、d10、f14)、半充满(p3、d5、f7)和全空状态(p0、d0、f0)时,具有较低的能量和较高的稳定性。如24Cr的价电子排布式为3d54s1(3d、4s能级均为半充满),易错写为3d44s2;29Cu的价电子排布式为3d104s1(3d全充满、4s半充满),易错写为3d94s2。
【课堂小结】
核外电子排布遵循泡利原理、能量最低原理和洪特规则.能量最低原理就是在不违背泡利原理的前提下,核外电子总是尽先占有能量最低的轨道,只有当能量最低的轨道占满后,电子才依次进入能量较高的轨道,也就是尽可能使体系能量最低.洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同.后来量子力学证明,电子这样排布可使能量最低,所以洪特规则可以包括在能量最低原理中,作为能量最低原理的一个补充.
【板书】
1.1.3 原子轨道与电子排布原理
一、电子云与原子轨道
1.电子运动的特点
2.电子云
3.原子轨道
二、原子的核外电子排布
1.核外电子排布规则
(1)能量最低原理
(2)泡利原理(填多少)
(3)洪特规则(怎么填)
2.电子排布图(轨道表示式)
2021学年第1章 有机化合物的结构与性质 烃第3节 烃教案: 这是一份2021学年第1章 有机化合物的结构与性质 烃第3节 烃教案,共2页。
高中化学鲁科版 (2019)选择性必修3第3节 烃教案: 这是一份高中化学鲁科版 (2019)选择性必修3第3节 烃教案,共2页。教案主要包含了化学(鲁科版)33等内容,欢迎下载使用。
化学第一章 原子结构与性质第一节 原子结构教案设计: 这是一份化学第一章 原子结构与性质第一节 原子结构教案设计,共5页。教案主要包含了教学目标,教学重难点,教学过程等内容,欢迎下载使用。













