


















人教版 (2019)选择性必修2第一节 原子结构教学ppt课件
展开第一章 原子结构与性质
第一节 原子结构
1.1.3 泡利原理、洪特规则、能量最低原理
认识基态原子中核外电子的排布遵循能量最低原理、泡利不相容原理和洪特规则等。
教学重点:
1、掌握泡利原理、洪特规则和能量最低原理
2、掌握1~36号元素的原子核外电子排布图
教学难点:
1~36号元素的原子核外电子排布图
[复习回顾]
1、量子力学告诉我们:ns能级各有 个轨道,np能级各有 个轨道,nd能级各有 个轨道,nf能级各有 个轨道。
2、每个能级最多可容纳的电子数: ns、np、nd、nf……分别最多可容纳的电子数 。
[学生学习]
1、 泡利原理
(1)自旋:电子自旋有顺时针和逆时针两种状态,常用 表示自旋状态相反的电子。
(2)泡利原理:在一个原子轨道里,最多只能容纳 个电子,而且它们的自旋状态 。
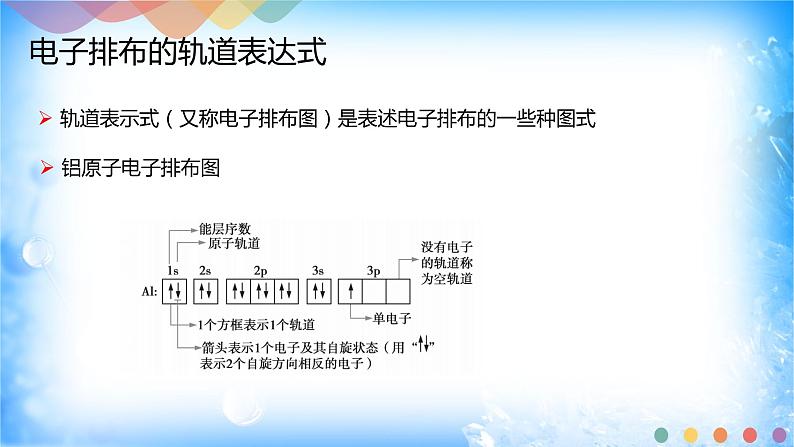
2、电子排布的轨道表示式
(1)电子排布的轨道表示式的定义
(2)H、O的基态原子的轨道表示式
(3)电子排布的轨道表示式的书写方法
(4)概念辨析:简并轨道、单电子、电子对、自旋平行、自旋相反
3、洪特规则
(1) 洪特规则内容
当电子排布在同一能级(能量相同)的不同轨道时,总是优先 占据一个轨道,而且自旋方向 。
如:2p3的电子排布为 ,不能表示为 或 。
(2) 洪特规则特例
当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1。
[思考与讨论]
(1) 下列轨道表示式中哪个是硼的基态原子?为什么?
A. B.
(2)下列轨道表示式中哪个是氧的基态原子?为什么?
A. B. C.
4、能量最低原理
能量最低原理:在构建 时,电子尽可能地先占有 ,然后进入能量高的轨道,使整个原子的能量处于
[思考与讨论]
(1) 为什么基态氦原子的电子排布式时1s2而不是1s12s1?
(2) 为什么基态氮原子的轨道表达式是 ,而不是?
(3) 为什么基态K和Ca的价电子是4s1和4s2,而不是3d1和3d2?
[易错误区]
1.忽视能量最低原理
如B:错写成
2.忽略泡利原理
如C:错写成
3.忽略洪特规则
如N:错写成或
[答案]
[复习回顾]
1、1 3 5 7
2、2x1、2x3、2x5、2x7……
[学生学习]
1、上下箭头(↑和↓) 2 相反
2、(1)电子排布的轨道表示式(电子排布图):表示电子排布的一种图式。
(2)H O
(3) ①用□或○代表一个原子轨道,能量相同的原子轨道(简并轨道)的方框相连
② 不同能级中的□或○要相互分开,同一能级中的□或○要相互连接
③ 整个电子排布图中各能级的排列顺序要与相应的电子排布式一致
④ 通常在方框下方或者上方标记能级符号
⑤ 箭头表示一种自旋状态的电子,一个箭头表示一个电子,↓↑”称电子对 ,“↓”或“↑”表示单电子,箭头同向,自旋平行,箭头相反,自旋相反
⑥ 电子排布式给出了基态原子核外电子在能层和能级中的排布,而电子排布图还给出了电 子在原子轨道中的自旋状态
(4)简并轨道:能量相同的原子轨道
单电子:“↓”或“↑”
电子对:↓↑
自旋平行:箭头同向
自旋相反:箭头相反
3、(1)单独 相同
[思考与讨论]
A A
4、基态原子 能量低的轨道 最低状态
[思考与讨论]
遵循能量最低原理
依据洪特规则
遵循能量最低原理
1.下列有关多电子原子的叙述中正确的是( )
A. 在一个多电子原子中,不可能有两个运动状态完全相同的电子
B. 在一个多电子原子中,不可能有两个能量相同的电子
C. 在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高
D. 某个多电子原子的3p能级上仅有两个电子,它们的自旋状态必须相反
【答案】A
【解析】填充在同一个能级的同一个轨道中的电子,能量相同,故B错误;根据构造原理,3d轨道上电子的能量比4s轨道上的要高,故C错误;电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同,故D错误。
2.下列表达方式正确的是( )
A. Na+的电子排布图:
B. 硫离子的核外电子排布式:1s22s22p63s23p4
C. 碘化铵的电子式:
D. H2O的电子式:
【答案】D
【解析】A项违反泡利原理;B项硫离子的核外电子排布式应为1s22s22p63s23p6;C项碘化铵的电子式应为;只有D项正确。
3.某原子核外电子排布式为1s22s22p3,下列说法正确的是( )
A. 该原子的核外电子排布图为
B. 该原子核外有3种能量不同的电子
C. 该原子核外最外层电子占据3个原子轨道
D. 该原子核外最外层上有3种运动状态不同的电子
【答案】B
【解析】该电子排布图违反洪特规则,正确的电子排布图为,A项错误;该原子核外有3种能量不同的电子,分别为1s、2s、2p原子轨道上的电子,B项正确;该原子核外最外层电子数为5,占据2s、2p原子轨道,共4个原子轨道,C项错误;该原子核外最外层电子数为5,则最外层上有5种运动状态不同的电子,D项错误。
4.下列化学用语的表达正确的是( )
A. 原子核内有10个中子的氧原子:O
B. 氯原子的结构示意图:
C. Fe3+的最外层电子排布式:3s23p63d5
D. 基态铜原子的价电子排布图:
【答案】C
【解析】原子核内有10个中子的氧原子应表示为O,A错误;氯原子的结构示意图为,B错误;Fe的原子序数是26,故Fe3+的最外层电子排布式为3s23p63d5,C正确;铜的原子序数是29,基态铜原子的价电子排布符合洪特规则的特例,价电子排布图为
,D错误。
5.下列叙述正确的是( )
A. [Ar]3d64s2是基态原子的电子排布式
B. 铬原子的电子排布式是1s22s22p63s23p64s13d5
C. 铜原子的价电子排布式是3d94s2
D. 氮原子的电子排布图是
【答案】A
【解析】B. 铬原子的电子排布式是1s22s22p63s23p63d54s1,错误;C. 铜原子的价电子排布式是3d104s1,错误;D.违反洪特规则。
6.下列有关化学用语的表述正确的是( )
A. 次氯酸的电子式:
B. 基态铜原子的外围电子排布图:
C. Se的简化电子排布式:[Ar]3d104s24p4
D. F-的结构示意图:
【答案】C
【解析】次氯酸的电子式为,A项错误;书写基态铜原子的外围电子排布图时,根据洪特规则的特例应为,B项错误;F-的最外层有8个电子,D项错误。
7.下列有关原子的最外能层的电子排布图正确的是( )
A. 铍原子: B. 碳原子:
C. 氯原子: D. 铝原子:
【答案】C
【解析】A项,铍原子的最外能层的电子排布图为,错误;B项,2p能级上的电子排布违反洪特规则,错误;C项氯原子的最外能层的电子排布图为,正确;D项,根据能量最低原理,3s轨道的能量低于3p轨道,则电子先排满3s轨道,才能排3p轨道,所以该电子排布违背了能量最低原理,错误。
8.下列原子的价层电子排布图正确的是( )
A. B.
C. D.
【答案】C
【解析】A的2p轨道应各排布一个电子且自旋状态相同,B的2s轨道中两个电子的自旋状态应相反,D的2s轨道中应排满两个电子后再排2p轨道。
9.下列基态原子的电子排布式中,其未成对电子数最多的是( )
A. 1s22s22p63s23p63d64s2 B. 1s22s22p63s23p64s1
C. 1s22s22p63s23p63d54s1 D. 1s22s22p63s23p63d104s1
【答案】C
【解析】根据s、p、d能级原子轨道数目及洪特规则可知,A、B、C、D项原子的未成对电子数分别为4、1、6、1,C项正确。
10.在核电荷数为26的元素Fe的原子核外3d、4s轨道内,下列电子排布图正确的是( )
A. B.
C. D.
【答案】C
【解析】核电荷数为26的Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,3d能级有5个轨道,只有1个轨道排满两个电子,且自旋方向相反,其他4个轨道各排1个电子,4s轨道排满2个电子,且自旋方向相反,即C项正确。
高中化学人教版 (2019)选择性必修2第一节 原子结构集体备课课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构集体备课课件ppt,共16页。PPT课件主要包含了目标一泡利原理,电子自旋,s22s22p4,不要标记电子数,练习1,目标二洪特规则,思考与交流1,s22s22p2,s22s22p3,s22s22p5等内容,欢迎下载使用。
人教版 (2019)选择性必修2第一节 原子结构多媒体教学ppt课件: 这是一份人教版 (2019)选择性必修2第一节 原子结构多媒体教学ppt课件,文件包含新人教版化学选择性必修二第一章第一节113泡利原理洪特规则能量最低原理课件pptx、新人教版化学选择性必修二第一章第一节113泡利原理洪特规则能量最低原理同步分层练习docx等2份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第一节 原子结构示范课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构示范课ppt课件,共31页。PPT课件主要包含了s22s22p3,或Ar3d6,①⑤⑥,s23p3,洪特规则,d104s1等内容,欢迎下载使用。













