





中考化学一轮复习第二单元探秘水世界第03课时原子的结构与元素课件鲁教版
展开这是一份中考化学一轮复习第二单元探秘水世界第03课时原子的结构与元素课件鲁教版,共34页。PPT课件主要包含了考点一原子的结构,汤姆森,绝大多数,一小部分,极少数,正电荷,负电荷,原子核,碳12,考点三原子中的电子等内容,欢迎下载使用。
1.原子结构的发现史(1)科学家 发现了电子并提出“葡萄干布丁”原子模型。 (2)卢瑟福实验①实验过程:用带正电的、质量比电子大得多的高速α粒子轰击金箔。②实验预期:高速α粒子会击穿金原子,顺利到达对面的探测板上。③实验现象: α粒子能穿过金箔且不改变原来的方向,有 改变了原来的前进方向, 的α粒子被反弹了回来。 ④实验结论:原子中肯定存在带 电的体积虽 但质量较 的微粒。
3.构成原子的各粒子之间的关系(1)体积关系:原子核居于原子中心,在原子中占的体积很 ,电子在原子核外做高速运动。 (2)质量关系:组成原子核的质子和中子的质量相差不大,都远大于电子的质量,因此原子的质量主要集中在 上。 (3)数量关系:核电荷数= 数=核外 数(与中子数无关)。4.原子的性质原子是构成物质的一种基本粒子,具有以下性质:(1)质量和体积很 。 (2)相互之间存在 和相互作用。 (3)总在不断 。
考点二 原子质量的计量
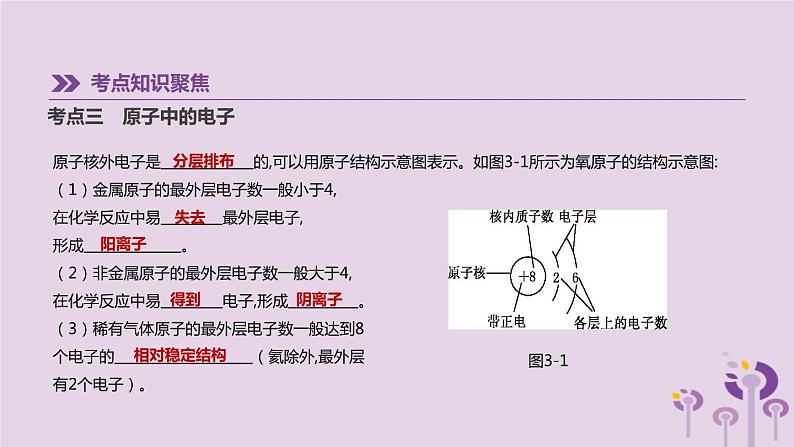
原子核外电子是 的,可以用原子结构示意图表示。如图3-1所示为氧原子的结构示意图: (1)金属原子的最外层电子数一般小于4,在化学反应中易 最外层电子,形成 。 (2)非金属原子的最外层电子数一般大于4,在化学反应中易 电子,形成 。 (3)稀有气体原子的最外层电子数一般达到8个电子的 (氦除外,最外层有2个电子)。
[注意] ①离子是显电性的,在阳离子中,核电荷数=原子序数=核内质子数>核外电子数;在阴离子中,核电荷数=原子序数=核内质子数<核外电子数。②元素的化学性质决定于原子的最外层电子数。③核外电子分层排布规律:核外电子总是最先排在能量较低的电子层,排满第一层才排第二层,排满第二层才排第三层……第一层上最多排2个电子,第二层上最多排8个电子,最外层电子数不超过8个(第一层为最外层时,不超过2个),次外层不超过18个电子。
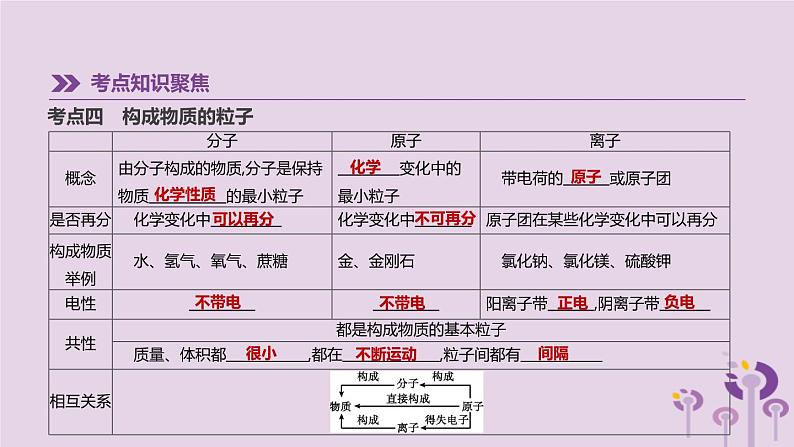
考点四 构成物质的粒子
3.元素周期表简介1869年,俄国化学家 编制了第一张元素周期表,如今的元素周期表是按照原子核内 由小到大的顺序排列而成的。 [注意] 每一种元素均占一格,其中每一部分的含义如图3-2所示:
例1 图3-3为某原子结构模型的示意图,其中a、b、c是构成该原子的种不同粒子。下列说法正确的是( )A.决定该原子种类的粒子是bB.原子中b与c的数目一定相同C.原子中a与c的数目一定相同D.原子的质量集中在a和c上
[解析] 图中a为核外电子,b为中子,c为质子。质子数决定元素的种类,因此决定该原子种类的粒子是c;质子数和中子数不一定相等,因此该原子中b与c的数目不一定相同;原子中质子数=核外电子数,因此a与c的数目一定相同;原子的质量主要集中在原子核上,即原子质量主要集中在b和c上。
例2 [2018·威海] 征服原子——揭开原子的神秘面纱伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是——一切东西都是由原子构成”。人类在探索物质是由什么构成的历史长河中,充满了智慧。(1)1803年,近代化学之父,英国科学家道尔顿(Daltn J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。1897年,汤姆森通过实验发现了 ,进一步发展了原子-分子论。汤姆森主要是纠正了“道尔顿原子论”中 的观点。 1911年,卢瑟福又通过实验,推测原子是由 构成,并提出了沿用至今的现代原子结构理论。
(2)道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆森和卢瑟福这样,对实验现象进行解释的过程叫作 。 原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了 来表达他们的理论成果。
1.[2013·宿迁] 关于下列微粒结构示意图的说法,正确的是 ( )A.①③属于金属元素B.①②属于同种元素 C.③④是阴离子D.②④是稳定结构
[解析] 质子数决定元素的种类,①②中质子数相同,属于同种元素。
2.[2015·宿迁] 如图3-5A是某金属元素形成微粒的结构示意图,该金属在空气中燃烧时放出大量的热并发出耀眼的白光,图B是该反应的微观示意图,请根据以上信息回答下列问题。 (1)该金属元素原子核外电子数= ,图A所示微粒的符号为 ;写出一种与图A所示具有相同电子层结构的阴离子的符号 。 (2)写出图B所示的化学方程式: 。
例3 [2018·雅安] 图3-6为钠的原子结构示意图。下列说法错误的是 ( )A.钠原子的质子数为11B.n=8C.钠原子在反应中容易失电子D.钠元素位于第二周期
[解析] 圆圈里的数字代表质子数,钠原子的质子数为11;在原子中,质子数等于核外电子数,11=2+n+1,n=8;钠原子的最外层电子数是1,小于4,在化学反应中容易失去电子;钠的原子结构示意图有三个电子层,周期数等于电子层数,所以钠在第三周期。
考向二 粒子结构示意图
例4 [2018·巴中] 根据下列粒子结构示意图,回答问题。(1)A、B、C、D所示粒子共表示 种元素。 (2)D所示粒子在化学反应中容易 (填“得到”或“失去”)电子。
[解析] (1)质子数决定元素的种类,判断是否是同种元素,要看原子核内质子数是否相等,题图中质子数相等的元素是B和C,所以二者属于同一种元素,故图中所示粒子共表示三种元素。(2)D表示的是氯原子的原子结构示意图,最外层电子数为7,在化学反应中易得到电子。
3.[2016·宿迁] 下列关于四种粒子的结构示意图的说法正确的是( )A.②表示的微粒在化学变化中易失去两个电子形成阳离子B.①和③属于不同种元素C.②和③对应的元素组成的化合物的化学式为MgO2D.④对应的元素属于金属元素
[解析] ②表示的原子最外层电子数是2,小于4,在化学反应中易失去2个电子形成带2个单位正电荷的阳离子,故A正确;同种元素质子数一定相同,①③的质子数都是8,所以两者属于同种元素,故B错误;②表示的原子最外层电子数是2,小于4,在化学反应中易失去2个电子形成带2个单位正电荷的阳离子,对应的元素化合价为+2,③表示的原子最外层电子数是6,大于4,在化学反应中易得到2个电子形成带2个单位负电荷的阴离子,对应的元素化合价为-2,②和③对应的元素形成的化合物的化学式是MgO,故C错误;④表示的粒子质子数是18,对应的元素是氩元素,属于非金属元素,故D错误。
考向三 构成物质的粒子
例5 [2017·青岛] 下列物质中,由离子构成的是( )A.铁B.氯化钠C.二氧化碳D.金刚石
[解析] 铁属于金属单质,是由铁原子直接构成的;氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的;二氧化碳是由二氧化碳分子构成的;金刚石属于固态非金属单质,是由碳原子直接构成的。
例6 [2017·成都] 图3-9是X、Y两种微粒的结构示意图。下列说法正确的是( )A.X 为原子,Y 为离子B.X、Y 均属于非金属元素C.X 在反应中可失去 6 个电子D.X 与 Y 形成化合物的化学式为 YX
[解析] X为氧原子,Y为镁原子;X为非金属元素,Y为金属元素;X在反应中易得到2个电子。
例7 [2018·广安] 用适当的化学符号填空。(1)自然界中硬度最大的金刚石 。 (2)硫酸亚铁中的亚铁离子 。 (3)使无色酚酞试剂变为红色的离子 。 (4)保持氢气化学性质的最小微粒 。
4.[2017·宿迁] 下列说法正确的是 ( )A.由分子构成的物质在发生化学变化时,分子种类改变,原子种类不变B.离子是带电的原子或原子团,所以带电的微粒一定是离子C.构成固体物质的微粒都是静止不动的D.与元素化学性质关系最密切的是原子的核外电子数
[解析] 化学变化的实质是分子分裂成原子,原子重新组合成新分子,故A正确;带电的微粒不一定是离子,如原子核带正电,但不属于离子,故B错误;构成固体物质的微粒也在不断地运动着,故C错误;与元素化学性质关系最密切的是原子的最外层电子数,故D错误。
5.[2013·宿迁] 下列物质由离子构成的是( )A.氯化钠 B.金C.氢气 D.金刚石
[解析] 氯化钠是由钠离子、氯离子构成的;金是由金原子构成的;氢气是由氢分子构成的;金刚石是由碳原子构成的。
6.[2013·宿迁] 请用化学符号表示:(1)2个镁原子 。 (2)人体中含量最多的金属元素 。 (3)氧化铝中铝元素显+3价 。
例8 [2017·河南] 下列科学家中,发现了元素周期律并编制了元素周期表的是 ( )A.拉瓦锡 B.门捷列夫C.道尔顿 D.阿伏加德罗
[解析] 法国化学家拉瓦锡用定量的方法研究发现了空气的成分;门捷列夫发现了元素周期律并编制出元素周期表;道尔顿提出了原子论;阿伏加德罗创立了分子学说。
例9 [2018·安徽] 硼是作物生长必需的微量营养元素,硼元素的相关信息如图3-10所示。下列有关硼的说法正确的是 ( )A.相对原子质量为10.81 gB.属于金属元素 C.原子的核电荷数为5 D.原子核外有6个电子
[解析] 本题主要考查元素周期表。相对原子质量不能表示原子的实际质量,表示的是一个比值,单位是“1”而不是“g”,A错误;硼的偏旁为“石”字旁,属于非金属元素,B错误;硼元素的原子序数为5,则其原子的核电荷数为5,C正确;硼原子的核外电子数=核电荷数=5,D错误。
例10 [2018·临沂] 如图3-11为某粒子的结构示意图,下列说法错误的是 ( )A.该元素属于非金属元素B.该元素位于元素周期表第三横行C.该粒子核外电子数是17D.在化学反应中,该元素原子易得电子形成Cl-
[解析] 由图可知,该粒子核外电子数是18。
例11 [2017·东营改编] 元素周期表是学习和研究化学的重要工具。图3-12是元素周期表的一部分。(1)很多科学家对元素周期表的发现和完善作出了重大贡献,请写出其中一位科学家的名字: 。
(2)学习化学后,我们学会了从微观角度认识事物。根据下列四种粒子的结构示意图,回答问题。①它们属于同种元素的是 (填序号,下同)。 ②图C是某元素的原子结构示意图,该元素在元素周期表中的位置是 (填“a”“b”或“c”)。 (3)原子序数为12的元素的原子在化学反应中易 (填“得”或“失”)电子,形成的离子符号是 。该元素在化合物中的化合价为 价,该元素和原子序数为9的元素组成的化合物是 (填化学式)。
相关课件
这是一份2024中考一轮复习 鲁教版化学 教材基础复习 第二单元 探秘水世界 课件,共51页。PPT课件主要包含了知识清单·理脉络,物质的分类,考点突破·释疑难,活性炭,实验探究·培素养,1∶2,淡蓝色,氢元素和氧元素,氢原子,氧原子等内容,欢迎下载使用。
这是一份鲁教版中考化学复习第二单元探秘水世界重难突破1元素周期表的应用课件,共19页。PPT课件主要包含了非金属,NaBr,五或5,氧或氧元素,相对稳定,AlCl3等内容,欢迎下载使用。
这是一份鲁教版中考化学复习第二单元探秘水世界第二节物质的构成及元素课件,共37页。PPT课件主要包含了SO3,质子数不同,碳原子的排列方式不同,构成物质的分子不同,非金属,O2-,阴离子,钠离子和氯离子,原子核,核电荷数等内容,欢迎下载使用。












