
2022年度最新人教版九年级化学下册第十单元 酸和碱期末考试卷A4版
展开这是一份2022年度最新人教版九年级化学下册第十单元 酸和碱期末考试卷A4版,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
最新人教版九年级化学下册第十单元 酸和碱期末考试卷A4版
(考试时间:90分钟,总分100分)
班级:__________ 姓名:__________ 分数:__________
一、单选题(每小题3分,共计24分)
1、下列叙述不正确的是
A.自行车链条涂油可防锈
B.印染厂的废水可以加入熟石灰进行处理
C.健康人体胃液的pH范围在0.9﹣1.5
D.硝酸铵不能与易燃物质混在一起,在高温或受猛烈撞击时易爆炸
2、下列实验设计不能达到目的的是
A.鉴别Na2CO3 B.除去H2中的HCl气体
C.干燥二氧化碳 D.探究质量守恒定律
3、推理是学习化学常用的思维方法。下列说法正确的是
A.5%的氯化钠溶液洒出一部分,剩余溶液的溶质质量分数仍为5%
B.稀硫酸和氢氧化钠溶液都具有导电性,则蔗糖溶液也具有导电性
C.金属镁、锌等能与稀盐酸反应产生氢气,则金属铜也能
D.一定温度下KNO3饱和溶液中不能继续溶解KNO3,则也不能继续溶解其他物质
4、三甲基一氯硅[(CH3)3SiCl]是一种生产有机硅化合物的原料,遇明火或氧化剂会引起爆炸,在空气中燃烧生成一氧化碳、二氧化碳、二氧化硅和氯化氢,与水接触可产生雾状盐酸。则下列说法错误的是
A.保存三甲基一氯硅时应密封防水
B.三甲基一氯硅水溶液pH小于7
C.三甲基一氯硅分子由3个碳原子、9个氢原子、1个硅原子和1个氯原子构成
D.扑灭三甲基一氯硅引发的着火,应使用二氧化碳、干粉灭火剂,并用弱碱性水处理
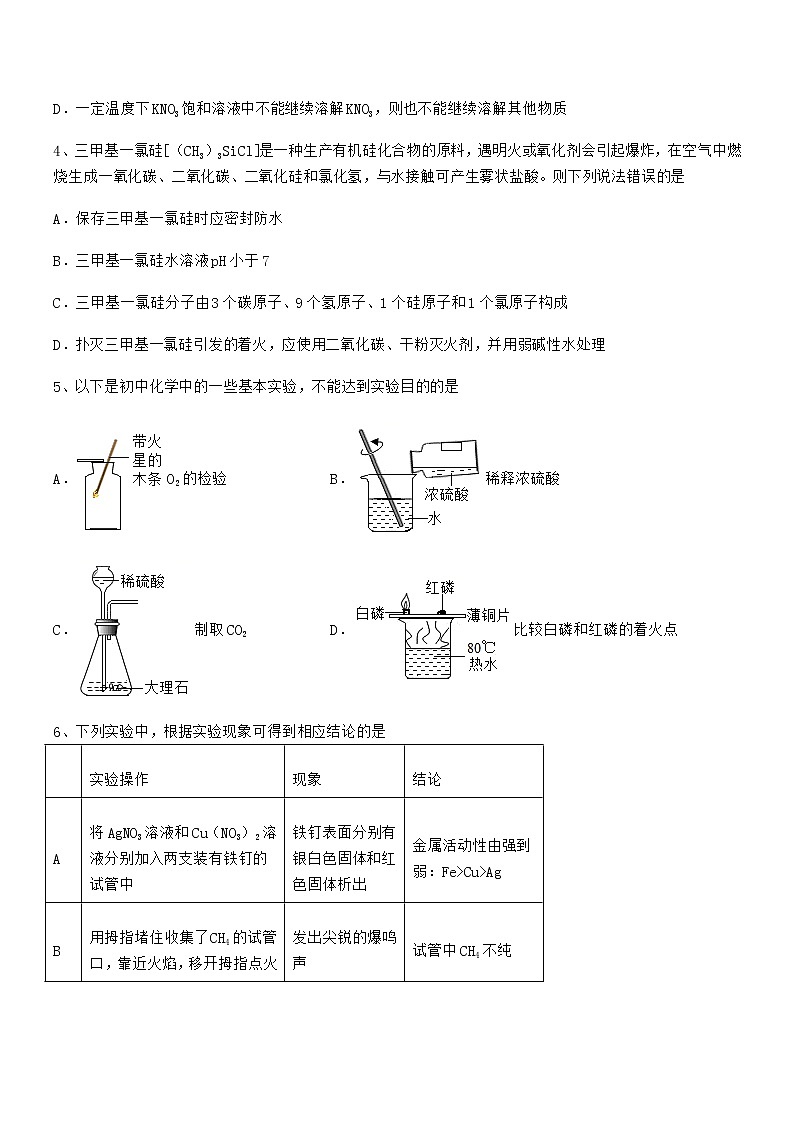
5、以下是初中化学中的一些基本实验,不能达到实验目的的是
A.O2的检验 B.稀释浓硫酸
C.制取CO2 D.比较白磷和红磷的着火点
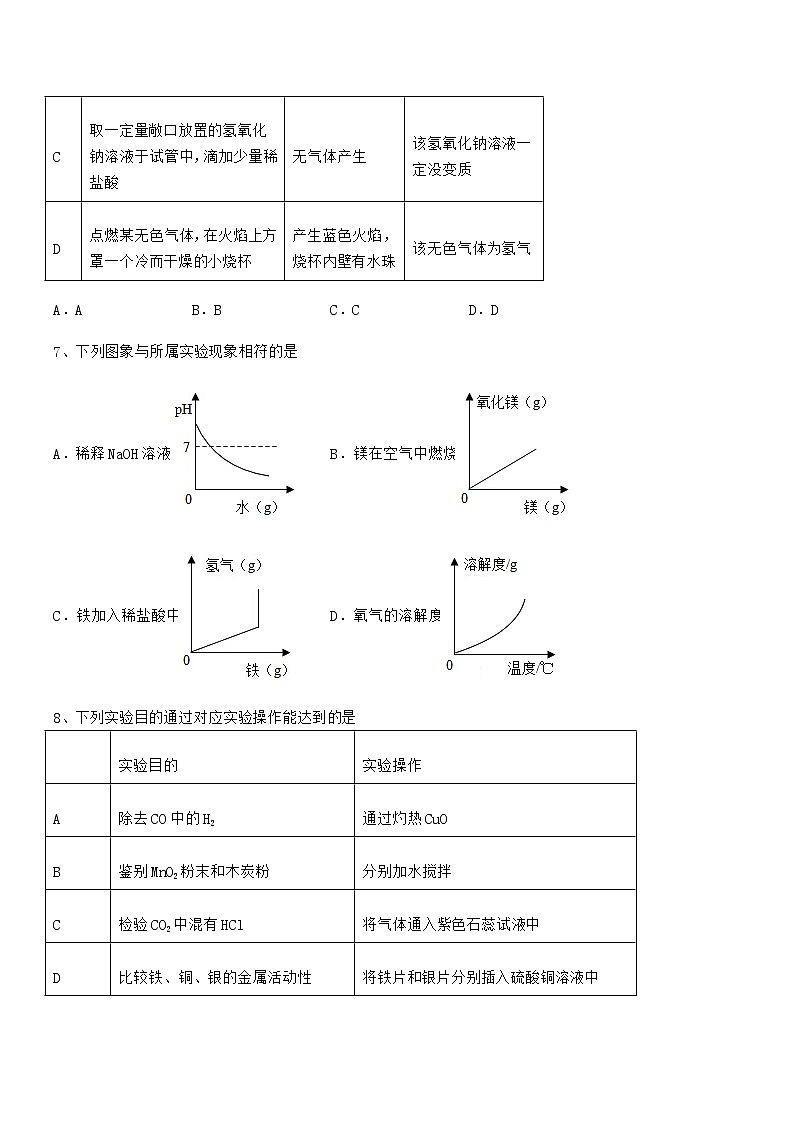
6、下列实验中,根据实验现象可得到相应结论的是
| 实验操作 | 现象 | 结论 |
A | 将AgNO3溶液和Cu(NO3)2溶液分别加入两支装有铁钉的试管中 | 铁钉表面分别有银白色固体和红色固体析出 | 金属活动性由强到弱:Fe>Cu>Ag |
B | 用拇指堵住收集了CH4的试管口,靠近火焰,移开拇指点火 | 发出尖锐的爆鸣声 | 试管中CH4不纯 |
C | 取一定量敞口放置的氢氧化钠溶液于试管中,滴加少量稀盐酸 | 无气体产生 | 该氢氧化钠溶液一定没变质 |
D | 点燃某无色气体,在火焰上方罩一个冷而干燥的小烧杯 | 产生蓝色火焰,烧杯内壁有水珠 | 该无色气体为氢气 |
A.A B.B C.C D.D
7、下列图象与所属实验现象相符的是
A.稀释NaOH溶液 B.镁在空气中燃烧
C.铁加入稀盐酸中 D.氧气的溶解度
8、下列实验目的通过对应实验操作能达到的是
| 实验目的 | 实验操作 |
A | 除去CO中的H2 | 通过灼热CuO |
B | 鉴别MnO2粉末和木炭粉 | 分别加水搅拌 |
C | 检验CO2中混有HCl | 将气体通入紫色石蕊试液中 |
D | 比较铁、铜、银的金属活动性 | 将铁片和银片分别插入硫酸铜溶液中 |
A.A B.B C.C D.D
二、填空题(每小题4分,共计20分)
1、生活离不开化学,回答下列问题:
(1)选择合适物质的字母填空。
A 活性炭 B 生石灰 C 武德合金 D 空气 E 金刚石 F 石墨
①可用作电极的是____;②可用作食品干燥剂的是___;③可用于防毒面具的是__;④可用作保险丝的是_______;⑤可用于工业制氧气的是_____;⑥可用来切割大理石的是___。
(2)2021年3月全国两会期间,“碳达峰”、“碳中和”成为热词,旨在推动社会各界和公众积极参与生态文明建设,携手行动,共建天蓝、地绿、水清的美丽中国。请回答:
①大气中CO2的含量不断上升,从而导致的环境问题是________增强,全球气候变暖。
②人类消耗的化石能源急剧增加,排入大气中CO2越来越多,目前使用的主要化石燃料有煤、______和天然气等,属于_______ (填“可再生”或“不可再生”)能源,其中,天然气的主要成分是_______(用化学式表示)。请列举一种新能源_______。
③“碳中和”主要是指抵消温室气体的排放量,实现正负抵消,达到相对“零排放”。下列说法不正确的是____(填字母序号)。
A 植树造林 B.捕集、利用和封存CO2 C.提倡使用一次性餐具
2、Y形管是一种简易实验仪器,同学们用Y形管按如图所示对分子的性质展开了探究。
(1)一段时间后,观察到的现象是___________,由此得出的结论是___________。
(2)另取一个相同装置,用热水对盛有浓氨水的一侧微微加热,观察到的现象是___________,由此又可以得出的结论是___________。使用酒精灯的一条注意事项___________。
3、为了探究金属的性质,小明进行如下实验探究,回答下列问题:
(1)观察到试管 A 中铁钉生锈,试管 B、C 中铁钉没有生锈。通过试管 A、B 中的现象 对比,说明铁生锈的条件之一是 ___________。实验 时蒸馏水经煮沸并迅速冷却的目的是 ___________。
(2)将一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,铝丝表面观察到的现象是 ___________写出反应的化学方程式: ___________。
(3)学生在探究活动中,向装有生锈的铁钉的烧杯中加入一定量的稀盐酸,观察到的现 象是 ___________,请写出有关化学方程式 ___________。
4、食品包装袋内常有下列物品。
(1)生石灰做干燥剂,其反应原理的化学方程式是___________,该反应___________(填“放热”或“吸热”)。
(2)铁粉脱氧剂的保鲜原理与铁生锈相同。铁生锈实际上是铁与空气中的_____________共同作用的结果;
(3)酒精保鲜卡以淀粉,二氧化硅为载体,吸附酒精制成。
①用化学符号表示酒精______________。
②从物质分类上看,二氧化硅属于______________(填序号)。
A.混合物 B.单质 C.氧化物
③保鲜原理是依靠气体保护层隔绝氧气,其中利用了酒精的_________性。
④酒精挥发过程中不发生改变的是____________(填序号)。
A.分子的种类 B.分子间的间隔 C.分子质量
5、科学知识在生产生活中有广泛的应用。
(1)厨房燃气灶中天然气燃烧的化学方程式是 __________。
(2)生活中有时遇到蚊虫叮咬,蚊虫会分泌一些酸性物质使皮肤奇痒难忍。你认为可选用下列 来涂抹止痒。(填序号)
A.食醋(含醋酸) B.氢氧化钠 C.食盐水 D.牙膏或肥皂水
(3)自来水的生产过程中,常用活性炭去除水中异味,这是利用活性炭的______性。
(4)为防止旅途中皮肤意外擦伤后感染,常备碘酒,碘酒中的溶质是_______(写物质名称)。
(5)在农历五月初五端午节,食用粽子是中华民族的传统风俗,过量食用粽子会导致胃酸过多,可服用含有Al(OH)3的药物中和过量的胃酸,其化学方程式为__________。
(6)易生水垢的水中含可溶性钙、镁化合物较多,叫做_______水。生活中常用煮沸的方法把这种水转化成含可溶性钙、镁化合物较少的________水。
(7)厨房油锅着火,盖上锅盖可以立即灭火,其原理是_______。
三、计算题(每小题4分,共计36分)
1、消化药片所含的物质能中和胃里过多的胃酸。某种消化药品的标签如图所示。医生给某胃酸过多的患者开出服用此药的处方为:每日6片。试计算,患者按此处方服用该药一天,理论上可中和HCl多少g?(计算结果精确至0.01)
2、为测定一瓶敞口放置的浓盐酸的溶质质量分数,某同学量取20 mL(密度为1.1 g/mL该盐酸与大理石充分反应,共用去含碳酸钙85%的大理石7.1 g。
(1)浓盐酸需要密封保存的原因是_________。
(2)计算该盐酸的溶质质量分数。
3、用溶质质量分数为5%的NaOH溶液中和115g的稀盐酸,反应过程中溶液的酸碱度变化如下图所示。请计算。
(1)用质量分数为10%的氢氧化钠溶液配制5%的氢氧化钠溶液100g要水_____克。
(2)当a为80g时,所得溶液中溶质的质量分数是多少?
4、根据如图所示的信息计算:
(1)加入的稀硫酸质量为______g
(2)恰好完全反应后所得溶液的质量分数。
5、过氧乙酸是一种常用的消毒剂,其说明书的一部分如图所示,回答下列问题:
(1)保存和配制过氧乙酸不宜使用__(填“铁”“玻璃”或“陶瓷”)材料制成的容器。
(2)双氧水和乙酸反应可得到过氧乙酸,该反应的化学方程式为CH3COOH+H2O2=CH3COOOH+X,则X的化学式为__。
(3)用质量分数为40%的过氧乙酸溶液配制8000g质量分数为0.5%的过氧乙酸溶液来浸泡消毒,需要取水__mL(水的密度为1g/mL)。
6、如下图是向50g溶质质量分数为80%的氢氧化钠溶液中加入溶质质量分数为10%的稀硫酸至过量的pH变化曲线图,根据下图回答问题:
(1)A点时,溶液中含有的阴离子是_______。
(2)求恰好完全反应时消耗稀硫酸的质量______。(写出计算过程)
7、某兴趣小组用10克镁条与溶质质量分数为49%的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如下图(假设镁条中除表面含有氧化镁外,没有其他杂质)。
(1)用化学方程式说明当稀硫酸的质量为10克时,为什么不产生氢气______________。
(2)计算镁条中镁元素的质量分数(写出计算过程)。
8、已知Na2CO3的水溶液呈碱性。在一烧杯中盛有31.4gNa2CO3和NaCl组成的固体混合物,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH______7(填>、=或<)。
(2)通过计算求出烧杯中溶液恰好是中性时,所得溶液中溶质的质量。
9、某化工厂的废水中含少量氢氧化钠,技术人员欲测其含量。取废水20g,向其中逐滴滴加9.8%的稀硫酸,利用pH传感器测定溶液pH变化如图所示。
(1)图中A点表示的意义是______。
(2)通过计算判断该废水是否可以直接排放?(排放标准:废水中氢氧化钠的质量分数<0.001%)
四、实验探究(每小题5分,共计20分)
1、某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图),他们决定对这瓶溶液的成分进行探究。
(提出问题)这瓶溶液的溶质是什么?
(获得信息)
酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
碳酸氢钠溶液与氯化钡溶液不反应;氯化钡溶液呈中性。
(提出猜想)猜想一:氢氧化钠;猜想二:碳酸钠;猜想三:碳酸氢钠。
(实验探究)
(1)小军取样滴加稀盐酸有气泡产生,得出结论:该溶液的溶质是___________。
(2)小军另取样加入过量的氯化钡溶液,观察到有___________产生,进而得出结论:该溶液的溶质是碳酸钠。
(3)小华认为小军的结论不完全正确,理由是___________。
小组同学讨论后一致认为还需要进行如下实验:取小军第二次实验后的上层清液,滴入无色酚酞溶液,溶液呈红色。
(实验结论)
(4)这瓶溶液的原溶质是___________。
(探究启示)
(5)实验中取用液体药品时,应注意___________。
2、某化学小组同学在实验室对氧化铜的性质进行相关探究活动,请你参与他们的探究,并回答有关问题。
(实验1)探究氧化铜与酸、碱的反应
小组同学按图1所示方案进行实验,实验中观察到的现象是:试管A中无明显现象,试管B中氧化铜溶解,且________。由此得出结论:氧化铜不与氢氧化溶液反应,可与稀硫酸反应,且反应的化学方程式为________。
(实验2)探究反应后的废液处理及所得滤液的成分
小组同学按图2所示进行实验:
①将实验1中反应后的废液混合,发现烧杯中有蓝色沉淀生成;
②待烧杯中反应充分,过滤,得滤渣和无色滤液。
(1)操作①中生成的蓝色沉淀是_______。
(2)操作②的装置中有一处明显错误是__________。
(3)最终所得滤液中溶质的成分,小组同学经讨论认为:一定含有硫酸钠;一定不含硫酸,他们的理由是___________。
(实验3)滤液中溶质的成分除硫酸钠外,还含有氢氧化钠、硫酸铜中的哪一种?(硫酸铜和氢氧化钠不能同时存在于溶液中)小红认为:溶液没有明显的蓝色,所以应该不含硫酸铜。
小刚不同意小红的观点,他的理由是__________。
为进一步证明溶液中除硫酸钠外,到底是含有氢氧化钠,还是硫酸铜,小组同学遇到了困难,请你帮他们设计一个实验方案加以证明。你的实验方案是:取少许滤液于试管中,___________。
3、化学兴趣小组同学用如图所示实验探究铝与盐酸的反应。实验时观察到刚开始无明显现象,一段时间后产生大量气泡,同时出现灰色沉淀。
(实验一)数字化实验探究铝和稀盐酸的反应
化学兴趣小组将未打磨的铝箔和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如下图所示。
(1)图中0s~50s温度和压强均无明显变化的原因是______(用文字表示),50s~100s压强增大的原因是______。
(2)图中A点溶液中的溶质为______(填化学式)。
(实验二)探究灰色固体的成分
(查阅资料)
①铝粉在颗粒较小时呈灰黑色:铝能与氢氧化钠和水共同反应生成偏铝酸钠(NaAlO2)和氢气。
②氯化铝固体为白色颗粒或粉末,易溶于水和乙醇。
(提出猜想)猜想1:灰色固体是铝;
猜想2:灰色固体是氯化铝;
猜想3:灰色固体是______。
(实验探究)将反应后的残留物过滤、洗涤、干燥后,完成如下实验。
实验序号 | 1 | 2 | 3 | 4 |
实验操作 | ||||
实验现象 | 有微量气泡产生,固体溶解 | 有少量气泡产生,固体溶解 |
| 固体部分溶解 |
(解释与结论)
(3)实验2中滴加NaOH溶液产生少量气泡的化学方程式为______;结合实验1和2可以判断灰色固体中含有______。
(4)由实验3和4可以判断灰色固体中还含有氯化铝,则实验3的现象是______。
综合上述分析,猜想3正确。
(实验三)探究盐酸浓度对灰色固体产生量的影响
取0.09g铝箔和5mL不同浓度的稀盐酸反应,观察实验现象。记录如下:
实验序号 | 1 | 2 | 3 |
盐酸浓度 | 4.0% | 2.8% | 1.4% |
灰色固体产生量 | 出现灰色沉淀 | 出现少量灰色沉淀 | 出现极少量的灰色沉淀 |
(解释与结论)
(5)实验三的结论是______。
(交流与反思)
(6)为了进一步探究灰色沉淀的出现是否与盐酸中的Cl-有关,请你设计实验方案进行探究:______。
4、探究氢氧化钠的化学性质:小燕同学取2mL氢氧化钠溶液倒入试管中,用胶头滴管向该试管中滴加硫酸铜溶液,观察到的现象是________,得出的结论是________;用试管夹夹持该试管,用酒精灯的外焰加热,观察到的现象是________。
相关试卷
这是一份2022年度最新人教版九年级化学下册第十单元 酸和碱期末考试卷【A4版】,共13页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
这是一份2022年度最新人教版九年级化学下册第十单元 酸和碱期末模拟试卷(A4可打印),共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
这是一份2022年度最新人教版九年级化学下册第十单元 酸和碱期末考试卷A4打印,共13页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。












