






苏教版选修4 化学反应原理第一单元 化学反应速率教案配套ppt课件
展开我们知道,在一定条件下的可逆反应存在化学平衡状态。那么,当达到化学平衡状态时,究竟有多少反应物转化成了生成物,平衡体系中各物质的浓度之间是否有一定的关系?请大家完成 P48页的问题解决。
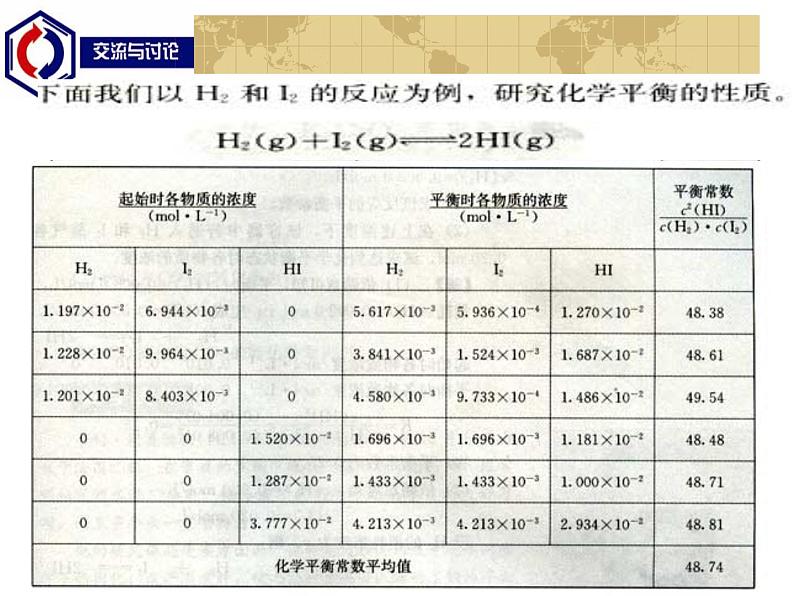
计算一定条件下,不同起始浓度的二氧化氮或四氧化二氮进行反应,达到平衡后各物质平衡浓度之间的关系。通过计算同学们是否发现什么规律?其中浓度的指数与化学方程式有何关系?如果反应物或生成物不止一种,情况又如何呢?如在一定条件下,可逆反应 H2(g) + I2(g) 2HI(g),起始以及平衡时各物质的浓度如下表所示。他们的浓度间存在何种关系?
即:一定温度下,生成物浓度的系数次方的乘积与反应物浓度系数次方的乘积之比为一常数。
问题:请大家阅读教科书P48页关于平衡常数的定义,并找出其中的关键词。
一、化学平衡常数——K
其中c为各组分的平衡浓度,温度一定,K为定值。
大家是否产生疑问,提出化学平衡常数的概念有什么意义?对我们研究化学反应进行的程度有什么帮助呢?分析教科书P48页表2-7,你能找出规律吗?
(1)意义:K值的大小,表示反应在该温度下达到平衡时该反应进行的程度(反应的限度)。
K值越大,表明反应进行的程度越大;反之则越小。
分析表2-8中的数据,你能得出什么结论?
(2)K值与浓度无关,随温度变化而变化
温度升高,K値不一定升高,与该正反应的热效应有关
分析表2-9中的数据,你能得出什么结论?
(3)K值表达式中,固体、液态水不写。
(4)平衡常数的表达式与方程式的书写方式有关
根据平衡常数的定义,请大家写出下列可逆反应的平衡常数表达式。
(5)利用K 值可判断某状态是否处于平衡状态
K′< K , v正> v逆,反应向正方向进行
K′= K , v正= v逆,反应处于平衡状态
K′>K , v正< v逆,反应向逆方向进行
由此得出启示:: 我们可以通过测出某一时刻体系中各物质的浓度,然后假设反应已经达到平衡,计算出平衡常数,与给定的平衡常数比较。如果相等,则假设成立,也就是说反应已达到平衡;如果不相等,则没有达到平衡。
例1、在某温度下,可逆反应:mA(g)+nB(g) pC(g) + qD(g)的平衡常数为K,下列说法正确的是( )A.K越大,达到平衡时,反应进行的程度越大.B.K越小,达到平衡时,反应物的转化率越大.C.K随反应物浓度改变而改变.D.K随温度改变而改变.
【例2】某温度下,向10L真空容器中注入1.00 ml H2(g) 和 1.00 ml I2(g),反应平衡后I2(g)的浓度为0.020 0 ml·L-1。试求该温度下 H2(g)+I2(g) 2HI(g)的平衡常数。
例3:在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)=CO(g)+H2O(g)其平衡常数K与温度t的关系如下表:1、该反应的平衡常数表达式为:2、某温度下,平衡浓度符合下式:c(CO2)·c(H2)= c(CO)·c(H2O),试判断该温度为____在此温度下,若该容器中含有1mlCO2、 1.2mlH2、 0.75mlCO、 1.5mlH2O,这状态是否平衡状态?若不是,反应向哪个方向进行?
【1】在一密闭容器中,CO与H2O混合加热到800℃达到下列平衡:CO(g)+H2O(g) CO2(g)+H2(g) K=1.00若反应开始时CO和H2O的浓度分别为0.200 ml·L-1 和1.00ml·L-1,求达到平衡时CO转化为CO2转化率是多少?
【2】高炉炼铁中发生的基本反应如下: FeO(s)+CO(g) Fe(s)+CO2(g)―Q。其平衡常数可表达为: K=c(CO2)/c(CO),已知1100℃,K=0.263 (1)若要使反应向右进行,高炉内CO2和CO的体积比值______,平衡常数K值______(填“增大”“减小”或“不变”) (2)1100℃时,测得高炉中c(CO2)=0.025ml·L-1,c(CO)=0.1ml·L-1,在这种情况下该反应是否处于平衡状态_______(填“是”或“否”),此时化学反应速率是V正____V逆(填“大于”、“小于”或“等于”),其原因是 。
c(CO2)/c(CO)=0.25<0.263,说明不是平衡状态,且向正反应方向进行
高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率课文ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率课文ppt课件,共31页。PPT课件主要包含了分点突破1,分点突破2等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第一单元 化学反应速率课文课件ppt: 这是一份苏教版 (2019)选择性必修1第一单元 化学反应速率课文课件ppt,共60页。PPT课件主要包含了图说考点,基础知识,保持不变,化学平衡的特征,化学平衡,生成物,反应物,某反应物,转化率,答案A等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第一单元 化学反应速率背景图课件ppt: 这是一份苏教版 (2019)选择性必修1第一单元 化学反应速率背景图课件ppt,共60页。PPT课件主要包含了图说考点,基础知识,保持不变,化学平衡的特征,化学平衡,生成物,反应物,某反应物,转化率,答案A等内容,欢迎下载使用。













