






苏教版选修4 化学反应原理专题二 化学反应与化学平衡第一单元 化学反应速率课文ppt课件
展开
这是一份苏教版选修4 化学反应原理专题二 化学反应与化学平衡第一单元 化学反应速率课文ppt课件,共23页。PPT课件主要包含了具有一定的方向性,生活中的自发过程,化学反应的方向,P42交流与讨论,课本P43,混乱度,水的三态的熵,问题解决,看书P45问题解决,学以致用等内容,欢迎下载使用。
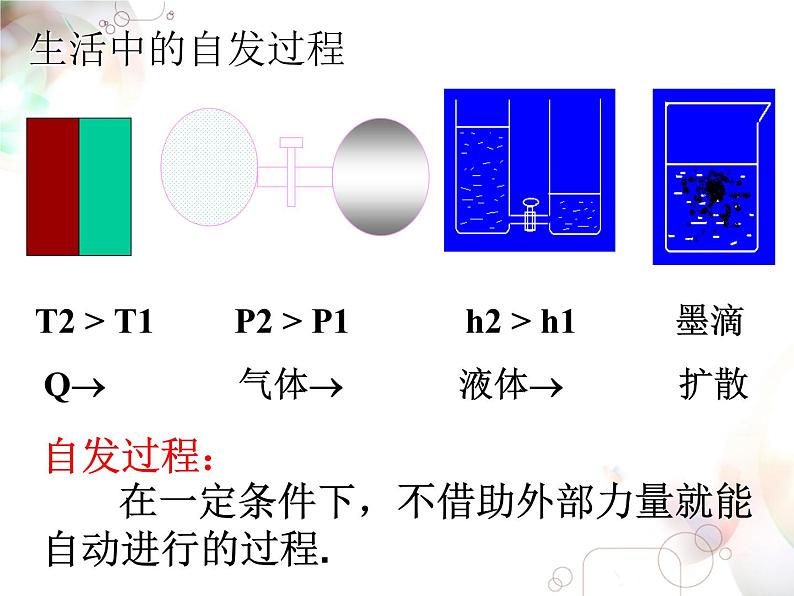
自然界中水总是从高处往低处流
是自动进行的自发变化过程
自发过程: 在一定条件下,不借助外部力量就能自动进行的过程.
化学反应中镁条燃烧、酸碱中和、铁器暴露在潮湿空气中生锈、甲烷和氧气的混合气体遇明火就燃烧、锌与CuSO4溶液反应生成Cu和ZnSO4等.这些过程都是自发的,其逆过程就是非自发的.
与自然界中的许多变化一样,化学反应也具有方向性。
注:①一定条件指:一定的温度T和压强P, 外界帮助指:通电、光照等。 ②自发反应在恰当条件下才能实现.
⑵特征:有方向性,且不能自动恢复原状,若 要恢复必须借助外力。
(1)定义:在一定条件下,无需外界帮助就 能自动进行的反应
1.水分解生成氢气和氧气的反应2.氯气与溴化钾溶液的反应3.乙烯与溴单质的反应4.氮气和氧气生成一氧化氮的反应
Cl2+2KBr=Br2+2KCl
如何判断一个过程,一个反应能否自发进行?
P43 “你知道吗” ,思考这些一定条件下能自发发生的反应有何共同特点?
共同特点:△H<0,放热反应。即体系趋向于从高能状态转变为低能状态
二、判断化学反应方向的依据
1、根据焓变⊿H(能量)判断
研究表明,对于化学反应, ⊿H<0(放热),有利于反应自发进行。且放出热量越多,体系降低能量越多,反应越完全。
“放热反应可以自发进行,吸热反应不能自发进行”,你同意这种观点吗?
实验现象:有刺激性气味的气体产生,混合物成糊状,小木块和锥形瓶粘在了一起
实验结论:氢氧化钡晶体与氯化铵反应吸热
问题:为什么有些吸热反应或吸热过程也能自发进行呢?
氢氧化钡晶体与氯化铵的反应有氨气生成,有气体生成使体系的混乱度增大是反应能自发进行的原因之一。
自发过程取向于最大混乱度的倾向。
熵(entrpy):描述体系混乱度的物量,符号:S 单位:J·ml-1·K-1
构成物质的微粒之间无规则排列的程度越大,体系的混乱度越大,熵值越大。
对于同一物质:S(g)﹥S(l)﹥S(s)
S(s) < S(l) < S(g)
2、判断化学反应方向的依据二(熵判据) : 大多数自发进行的反应趋向于使体系的混乱度增大的倾向。
反应前后体系熵的变化叫做反应的熵变。用△S表示
△S=S生成物总熵-S反应物总熵
化学反应的△S越大,越有利于反应自发进行
⊿S>0有利于反应自发进行,但自发反应不一定是⊿S>0的反应
综上所述,体系能量减小和混乱度增大都有促使反应自发进行的倾向。 要正确判断一个化学反应是否能自发进行,必须综合考虑反应的焓变和熵变。
3、综合判断 (⊿H、⊿S综合考虑)
△H <0 △S>0
△H >0 △S <0
NH3(g)+HCl(g)=NH4Cl(s)
CaCO3(s)=CaO(s)+CO2(g)
研究表明:在温度、压强一定的条件下
焓减小有利于反应自发,熵增大有利于反应自发
1.反应的自发性只能用于判断反应的方向,不能确定反应是否一定会发生和过程发生的速率。如钢制器件腐蚀。
2.在讨论过程的方向时,指的是没有外界干扰时体系的性质。如果允许外界对体系施加某种作用,就可能出现相反的结果。如石灰石分解,常温下是非自发的,但在1273K时是自发的反应。
1.下列说法不正确的是A. 焓变是一个与反应能否自发进行有关的因素,多数的能自发进行的反应是放热反应。B. 在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大。C. 一个反应能否自发进行取决于该反应放热还是吸热D. 一个反应能否自发进行,与焓变和熵变的共同影响有关
2.下列反应中,熵减小的是
D. 2CO(g)=2C(s)+O2(g)
B. 2N2O5(g)=4NO2(g)+O2(g)
A. (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)
C. MgCO3(s)=MgO(s)+CO2(g)
3.下列说法正确的是∶( )A、凡是放热反应都是自发的,由于吸热反应都是非自发的;B、自发反应一定是熵增大,非自发反应一定是熵减少或不变;C、自发反应在恰当条件下才能实现;D、自发反应在任何条件下都能实现。4. 自发进行的反应一定是∶( )A、吸热反应; B、放热反应;C、熵增加反应;D、熵增加或放热反应。
相关课件
这是一份苏教版 (2019)选择性必修1第一单元 化学反应速率授课ppt课件,共34页。PPT课件主要包含了图说考点,基础知识,不用借助于外力,混乱度,答案D,答案C,答案A,技能素养,复合判据的应用,形成性自评等内容,欢迎下载使用。
这是一份化学选修4 化学反应原理专题二 化学反应与化学平衡第一单元 化学反应速率说课课件ppt,共19页。PPT课件主要包含了化学平衡状态,研究对象,可逆反应,平衡前提,平衡特征,V正=V逆,条件改变→平衡改变,生产中应用,生活中应用,学习中应用等内容,欢迎下载使用。
这是一份选修4 化学反应原理第一单元 化学反应速率备课ppt课件,共12页。PPT课件主要包含了水往低处流,化学反应的方向,认识自发反应,一定温度和压强,无需外界帮助,影响因素一,影响因素二,综合考虑,△H和△S,想一想等内容,欢迎下载使用。










