


湖南省中考化学复习突破专题五流程图题课件
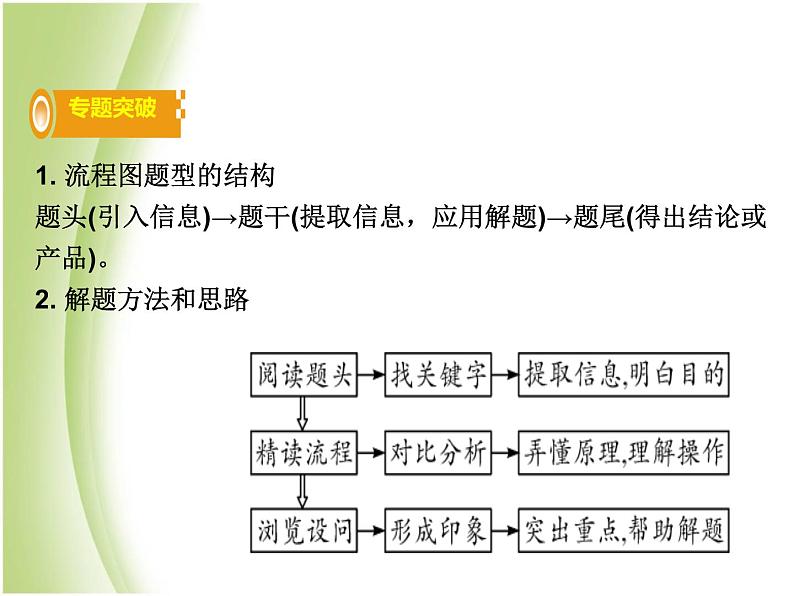
展开1. 流程图题型的结构题头(引入信息)→题干(提取信息,应用解题)→题尾(得出结论或产品)。2. 解题方法和思路
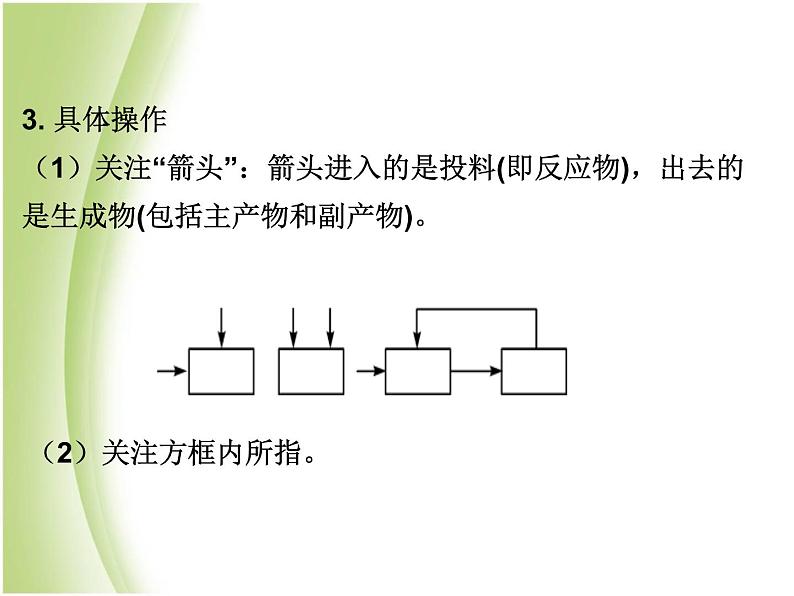
3. 具体操作(1)关注“箭头”:箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物)。
(2)关注方框内所指。
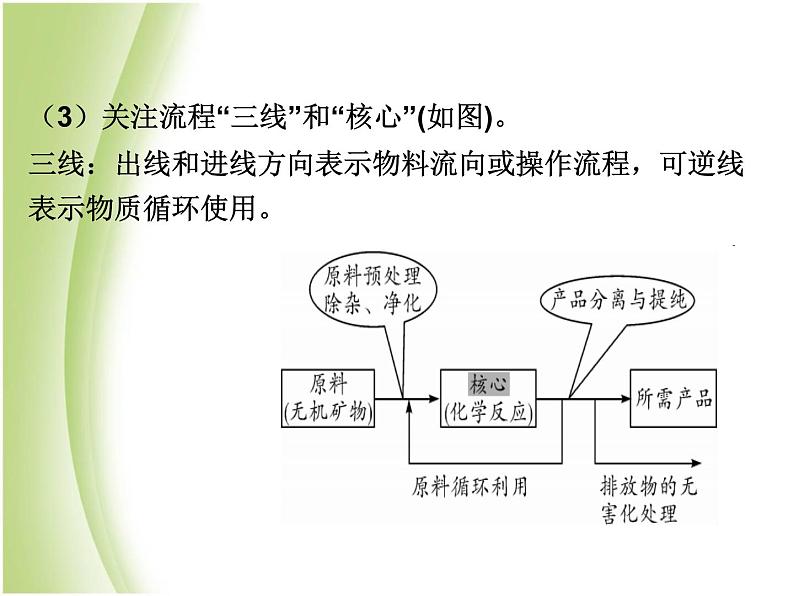
(3)关注流程“三线”和“核心”(如图)。三线:出线和进线方向表示物料流向或操作流程,可逆线表示物质循环使用。
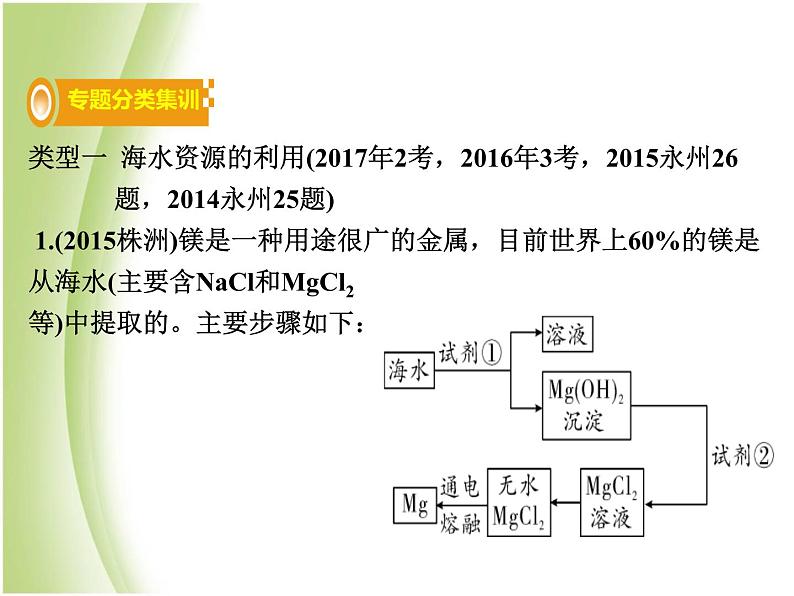
类型一 海水资源的利用(2017年2考,2016年3考,2015永州26 题,2014永州25题) 1.(2015株洲)镁是一种用途很广的金属,目前世界上60%的镁是从海水(主要含NaCl和MgCl2等)中提取的。主要步骤如下:
(1)上述步骤中试剂①应过量,理由是__________________________。(2)请写出Mg(OH)2沉淀与试剂②发生中和反应的化学方程式______________________________________。(3)无水MgCl2在熔融状态下通电得到金属镁和物质A,氢气在物质A中燃烧生成物质B,则物质A和B的化学式分别为:A________,B________。
使海水中的氯化镁充分反应
【解析】(1)MgCl2+2NaOH Mg(OH)2↓+2NaCl,试剂①为NaOH,若氢氧化钠量少,海水中的氯化镁反应不完,氢氧化钠过量能把海水中的氯化镁反应完。(2)根据提示,氢氧化镁与试剂②发生的是中和反应,故试剂②是酸,反应生成了氯化镁,所以试剂②是盐酸,发生反应的化学方程式为Mg(OH)2+2HCl MgCl2+2H2O。(3)MgCl2 Mg+Cl2 ↑,H2+ Cl2 2HCl,故A为Cl2,B为HCl。
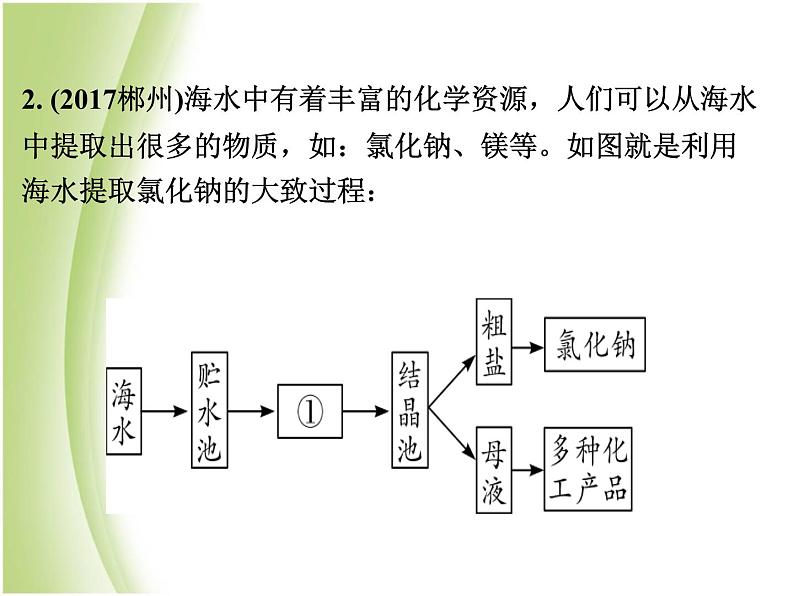
2. (2017郴州)海水中有着丰富的化学资源,人们可以从海水中提取出很多的物质,如:氯化钠、镁等。如图就是利用海水提取氯化钠的大致过程:
(1)图中①是________(填“蒸发池”或“冷却池”);(2)析出晶体后的母液是氯化钠的___________(填“饱和 溶液”或“不饱和溶液”);(3)实验室除去粗盐中难溶性杂质的主要实验步骤有: Ⅰ溶解 Ⅱ________(填操作名称) Ⅲ蒸发上述三个步骤中,用到的同一种玻璃仪器的名称是________,该玻璃仪器在步骤Ⅱ中的作用是________;
(4)提取粗盐后的母液中含有较多氯化镁,从母液中提取金属镁的过程大致如下:该过程中反应Ⅰ的基本反应类型是_________________;写出反应Ⅱ的化学方程式为____________________________。
【解析】(2)析出晶体后的母液不能继续溶解氯化钠固体,因此,该母液是氯化钠的饱和溶液。(3)实验室除去粗盐中难溶性杂质的主要操作步骤是:溶解、过滤、蒸发。三个步骤中都要用到玻璃棒,过滤时玻璃棒的作用是引流。(4)反应Ⅰ是氯化镁与氢氧化钙的反应,是由两种化合物相互交换成分,生成另外两种化合物的反应,它属于复分解反应。反应Ⅱ的一种反应物是氢氧化镁,生成物是氯化镁,则试剂X为HCl,其化学方程式为Mg(OH)2+2HCl MgCl2+2H2O。
类型二 矿产资源的利用(2017娄底43题,2016株洲28题,2015常德29题)(2017娄底)碳酸亚铁(FeCO3)可用于制作补铁药物,以下是用硫铁矿烧渣(主要成分为Fe2O3、SiO2等)为原料制备碳酸亚铁的生产流程示意图:【资料】40 ℃以上时,(NH4)2CO3易分解。
(1)操作Ⅰ的名称为________。(2)写出向固体A中加入稀硫酸后发生反应的化学方程式:________________________________。(3)加入(NH4)2CO3后,该反应必须控制的条件是_____________________。(4)从溶液C中可回收一种化工产品,请写出它的一种用途______________。
温度在40 ℃以下
Fe+H2SO4 FeSO4+H2↑
【解析】(1)过滤的方法可以将不溶物和液体分离,SiO2固体不溶于水,要将它与溶液B分开,可以使用过滤的方法,所以操作Ⅰ的名称为过滤。(2)硫铁矿烧渣与足量CO在高温下反应,得到的固体A中含有铁与二氧化硅。向固体A中加入过量稀硫酸,铁可以与稀硫酸反应生成硫酸亚铁和氢气,而二氧化硅不能与稀硫酸发生反应,其化学反应方程式为Fe+H2SO4 FeSO4+H2↑。(3)40 ℃以上时,(NH4)2CO3易分解,因此加入(NH4)2CO3后,温度必须控制在40 ℃以下。(4)溶液C中可回收的化工产品中含有硫酸铵,由于它组成中含有氮元素,故可用作氮肥。
类型三 “三废”的利用(2016湘潭27题) 1.(2016湘潭)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案。结合实验方案回答下列问题。
(1)固体A中含有____和___,无色气体X为____(均填化学式)。(2)步骤①中反应的化学方程式为________________________, 该反应属于四种基本类型中的________反应。(3)操作a的名称为________,在该操作中用到了玻璃棒其作用 为________。(4)理论上所得硫酸亚铁晶体的质量____(填“>”“<”或“=”)原废 液中硫酸亚铁的质量。
【解析】(1)铁的活动性比铜强,铁可与硫酸铜反应,生成铜和硫酸亚铁,所以固体A是铜和过量铁组成的混合物;铜和铁的混合物中加入稀硫酸,铁与稀硫酸反应生成硫酸亚铁和氢气,铜不与稀硫酸反应,所以无色气体X为氢气。(2)步骤①是铁与硫酸铜反应,生成铜和硫酸亚铁;该反应是一种单质与一种化合物反应生成另一种单质和另一种化合物,所以该反应属于置换反应。(3)操作a得到固体和溶液,所以该操作为过滤,过滤时玻璃棒的作用是引流。
(4)由于步骤①有铁参加反应,且转化为硫酸亚铁,步骤②中过量的Fe与H2SO4反应也生成FeSO4,所以理论上所得硫酸亚铁晶体的质量较原废液中硫酸亚铁的质量要大。
2.(2017陕西)我国每年报废的手机超过1亿部。废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。化学兴趣小组为回收其中的铜,设计并进行了如下实验。
已知:Cu+H2O2+H2SO4 CuSO4+2H2O;不考虑金、银发生类似反应。(1)将电路板粉碎成粉末的目的是________________________________________________________________。(2)步骤①所得滤液中的溶质除硫酸外,还有________________________________________。(3)步骤②中的实验现象是:固体部分溶解,___________________________________________。(4)步骤④中反应的化学方程式是______________________。
增大与稀硫酸的接触面积,使反应更充分,加快反应速率
FeSO4和Al2(SO4)3(或硫酸亚铁和硫酸铝)
溶液由无色变为蓝色(或溶液变为蓝色)
【解析】(1)将电路板粉碎的目的是让里面的各种金属与稀硫酸充分接触,使反应更充分和彻底,加快反应速率。(2)步骤①加入过量的稀硫酸,稀硫酸与铝、铁反应,分别生成硫酸铝和硫酸亚铁,而铜、银、金等不与稀硫酸反应,过滤后,滤液中有硫酸铝、硫酸亚铁和过量的稀硫酸;滤渣中有铜、银、金等。(3)步骤②中铜与稀硫酸、过氧化氢溶液反应生成硫酸铜,观察到的现象是固体部分溶解,溶液由无色变为蓝色,而
金、银没有反应,过滤后存在于滤渣中。(4)滤液(硫酸铜溶液)中加入过量铁粉,发生反应Fe+CuSO4 FeSO4+Cu,过滤后的滤渣中有铜和剩余的铁粉,再加入过量的稀硫酸,稀硫酸与铁粉发生反应:Fe+H2SO4 FeSO4+H2↑,除去铁粉,过滤后得到铜。
类型四 物质的制备(2017湘潭27题、株洲28题) 1.(2017北京)超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:
(1)石灰石主要成分的化学式为________。(2)乳化池中,生石灰与水发生反应,其化学方程式为 ___________________________。(3)过筛的目的是拦截________(填“大于”或“小于”)筛孔 直径的颗粒。(4)碳化塔中反应的化学方程式为 ____________________________________。
【解析】(1)石灰石的主要成分为碳酸钙,化学式为CaCO3。(2)乳化池中,生石灰与水反应生成氢氧化钙,化学方程式为CaO+H2O Ca(OH)2。(3)过筛的目的是拦截大于筛孔直径的颗粒。(4)碳化塔中为二氧化碳与氢氧化钙的反应,化学方程式为CO2+Ca(OH)2 CaCO3↓+H2O。
2. (2017重庆A卷)常温下,氯酸钾的溶解度较小,在工业上可通过如下转化制得。
(1)实验室用KClO3制取氧气的化学方程式为 _________________________________。
(2)反应Ⅰ中,通电时发生的反应方程式为NaCl+3X NaClO3+3H2↑,则X的化学式为________。(3)反应Ⅱ的基本反应类型为______________。(4)该转化中可以循环利用的物质是__________(填名称)。
【解析】(1)氯酸钾在二氧化锰的催化作用下分解生成氯化钾和氧气。(2)由反应的化学方程式NaCl+3X NaClO3+3H2↑,应用质量守恒定律的“两个不变”:①化学反应前后元素种类不变,②原子个数不变可知:
鲁教版中考化学复习题型突破五流程图题课件: 这是一份鲁教版中考化学复习题型突破五流程图题课件,共40页。PPT课件主要包含了酒精灯,蒸发皿,富集氯化镁,等合理即可,Fe2+,FeSO4,Fe或铁,更充分,除去废料中的铁,CO2等内容,欢迎下载使用。
人教版中考化学复习题型突破六流程图题练习课件: 这是一份人教版中考化学复习题型突破六流程图题练习课件,共47页。PPT课件主要包含了富集氯化镁,除去氢氧化钠和碳酸钠,氯化钠或NaCl,潮汐能合理即可,有机化合物,氩气的化学性质不活泼,CrOH3,催化作用,NH3•H2O,CuNO32等内容,欢迎下载使用。
人教版中考化学复习题型突破六流程图题课件: 这是一份人教版中考化学复习题型突破六流程图题课件,共37页。PPT课件主要包含了富集氯化镁,复分解反应,HCl,Mg2+,FeOH3,作氮肥,CuNO32,CuAg,混合物,H2SO4等内容,欢迎下载使用。












