




中考化学总复习课件 题型突破05 工艺流程图题 课件
展开工艺流程题的内容往往与生产、生活实际联系密切,因此从题干部分看一般都是采取流程图的模式。流程图的形式各异,有的以操作名称作框形成流程的主线,有的以物质作框,有的以设备作框,但每一题都固定某一种形式。近几年的试题常见的是以操作名称为主线,物质随着操作流程发生变化。这类题目中通常还包含简单的实验设计,实验一般为制备或对样品的定性、定量分析实验。突破方法:关注流程“三线”(去线、进线和可逆线)和“核心”。总结如下:读正文,找信息,灵活运用;看框内,看框外,里外结合;边分析,边思考,易处着手;先局部,后全盘,逐步深入。
例1 [2018·天津] (1)图T5-1是利用海水提取粗盐的过程。图中①是 (填“蒸发”或“冷却”)池。 (2)粗盐中含有少量CaCl2、MgCl2、Na2SO4和泥沙,某同学将该粗盐样品进行提纯。①将样品加适量水溶解,然后进行 ,除去泥沙等难溶性杂质,得到澄清溶液; ②向所得的澄清溶液中依次加入稍过量的BaCl2溶液、NaOH溶液和 溶液,除去生成的沉淀后,再滴加稍过量的稀盐酸,得到较纯净的NaCl溶液; ③蒸发溶液,得到较多氯化钠固体时停止加热,他注意到不能立即把 直接放在实验台上,以免烫坏实验台。 (3)另一同学用所得的氯化钠和蒸馏水配制溶质质量分数为6%的氯化钠溶液。配制步骤:①称量和量取;②溶解;③计算;④装入试剂瓶贴好标签。配制上述溶液的正确顺序是 (填序号)。
[答案] (1)蒸发 (2)①过滤②Na2CO3③蒸发皿(3)③①②④
[解析] (1)从海水提取粗盐,是利用蒸发结晶的原理。(2)①通过过滤可除去难溶性的固体杂质,得到澄清的溶液。②加入稍过量的BaCl2溶液目的是除尽Na2SO4,加入过量的NaOH溶液目的是除尽MgCl2,然后加入过量Na2CO3溶液除尽CaCl2和过量的BaCl2,除去生成的沉淀后,再滴加稍过量的稀盐酸,得到较纯净的NaCl溶液。③刚刚停止加热时,蒸发皿的温度较高,不能直接放在实验台上,以免烫坏实验台。(3)用固体配制溶液的操作步骤是计算、称量和量取、溶解、装入试剂瓶贴好标签,故填③①②④。
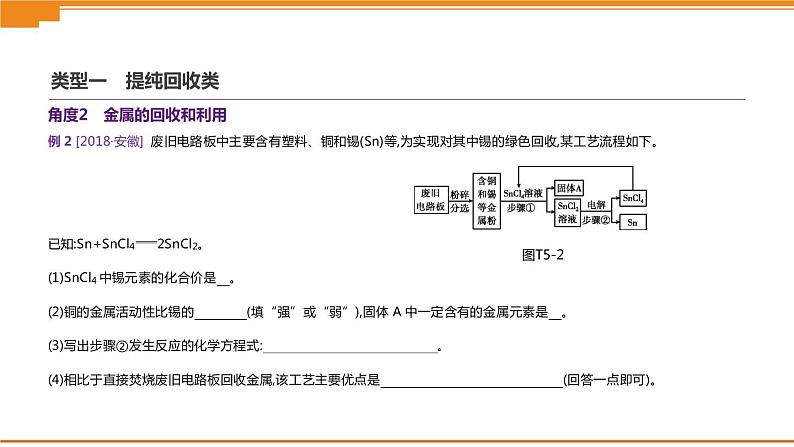
角度2 金属的回收和利用
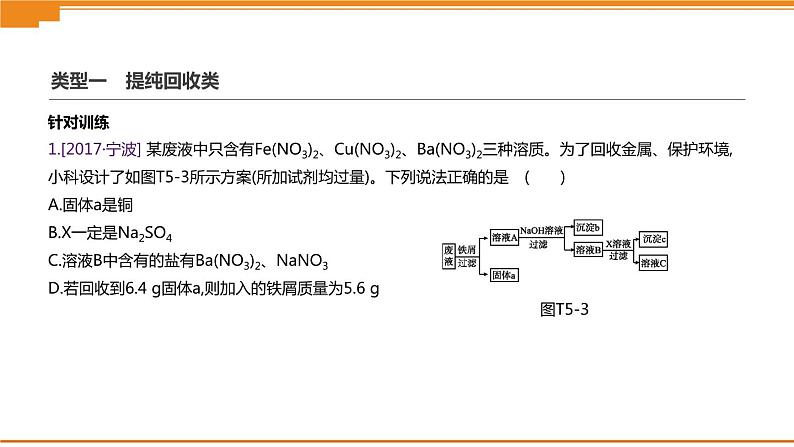
1.[2017·宁波] 某废液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三种溶质。为了回收金属、保护环境,小科设计了如图T5-3所示方案(所加试剂均过量)。下列说法正确的是( )A.固体a是铜B.X一定是Na2SO4 C.溶液B中含有的盐有Ba(NO3)2、NaNO3D.若回收到6.4 g固体a,则加入的铁屑质量为5.6 g
2.[2018·宿迁] 海洋是人类巨大的资源宝库。图T5-4为从海水中提取金属镁的简易流程图。(1)海洋中含量最多的物质是 。 (2)实验室中进行操作Ⅰ时,玻璃棒的作用是 。 (3)生石灰转化为石灰乳的过程是 (填“吸热”或“放热”)反应。 (4)上述流程中未涉及的基本反应类型是 反应。
[答案] (1)水 (2)引流 (3)放热 (4)置换
[解析] 本题主要考查海水资源的利用。(1)海洋中含量最多的物质是水。(2)经过操作Ⅰ得到固体氢氧化镁,则操作Ⅰ是过滤,过滤操作中,玻璃棒的作用是引流。(3)生石灰转化为石灰乳的过程是生石灰与水反应生成氢氧化钙,该反应中放出大量的热。(4)上述流程中发生的反应有碳酸钙分解生成氧化钙和二氧化碳,属于分解反应;生石灰和水化合生成氢氧化钙,属于化合反应;氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,属于复分解反应;氢氧化镁与稀盐酸反应生成氯化镁和水,属于复分解反应;电解氯化镁得到镁和氯气,属于分解反应,未涉及的基本反应类型是置换反应。
3.[2018·济宁] 海水晒制粗盐的主要成分为NaCl,还含有少量的MgCl2、CaCl2、MgSO4、泥沙等杂质。下面是由粗盐获取较纯净精盐的一种方法:请分析上面流程图,回答:(1)为除去MgCl2、CaCl2、MgSO4可溶性杂质,操作Ⅰ中依次加入的物质(过量)和顺序,合理的是 。 A.NaOH、BaCl2、Na2CO3 B.Ba(NO3)2、Na2CO3、NaOHC. Na2CO3、BaCl2、NaOHD.BaCl2、NaOH、Na2CO3 (2)操作Ⅰ加入过量各物质的目的是 。 (3)为获取较纯净精盐,操作Ⅱ的具体方法是 。
[答案] (1)AD(2)确保可溶性杂质完全被除去(3)在滤液中加入适量的稀盐酸,将溶液的pH调为7
[解析] 本题考查酸碱盐之间的反应及除杂质的先后顺序。(1)混合物中的杂质离子为Mg2+、Ca2+ 、S,所以选择的试剂为NaOH、BaCl2、Na2CO3。其中,NaOH、BaCl2顺序可以颠倒,最后加入Na2CO3除去Ca2+和过量的Ba2+,故选AD。(2)加入试剂过量为了使可溶性杂质完全除去。(3)最后的滤液中含有的杂质离子为OH- 、C,加入适量的稀盐酸除去这两种离子,再蒸发结晶,得到较纯净的精盐。
请回答下列问题。(1)将电路板粉碎成粉末的目的是 。 (2)步骤①所得滤液中的溶质除硫酸外,还有 。 (3)步骤②中的实验现象是:固体部分溶解, 。 (4)步骤④中反应的化学方程式是 。
[解析] (1)将电路板粉碎成粉末的目的是增大接触面积,使反应更充分,加快反应速率。(2)电路板粉末中的铝、铁能与稀硫酸反应,铜、银、金与稀硫酸不反应,故步骤①所得滤液中的溶质除硫酸外,还有硫酸亚铁和硫酸铝;根据题干可知,步骤②中滤渣中的Cu能与H2O2、H2SO4反应,生成CuSO4,溶液变为蓝色;步骤④所得的滤渣中含有Cu和过量的Fe,过量的Fe与稀硫酸反应生成硫酸亚铁和氢气。
5.[2018·福建] 以某矿山酸性废水(主要含硫酸、硫酸铁、硫酸铜和硫酸锌等)为原料,通过下述流程可将废水中的铁、铜和锌分步沉淀,实现回收利用。(1)步骤①中,加入Ca(OH)2有两个作用。一是中和废水中的硫酸,该反应的化学方程式为 。 二是将硫酸铁转化为Fe(OH)3,该反应属于 (填基本反应类型)。 (2)步骤③中,锌泥中最主要的含锌化合物的化学式为 。 (3)为分步回收铁、铜、锌等金属资源且直接得到铜单质,只需改变上述流程中的某步骤加入的试剂即可。该步骤和应加入的试剂分别是 。
例3 [2017·重庆A] 在牙膏中常用轻质碳酸钙粉末作摩擦剂。小李在实验室以石灰石(杂质不反应也不溶于水)为原料制取轻质碳酸钙和氢氧化钠。请回答下列问题。(1)操作②的名称是 。 (2)该流程中有两个反应,产物中均出现碳酸钙,这两个反应的化学方程式分别为 、 。 (3)为了验证加入Na2CO3溶液后,溶液M中的溶质是否反应完全,可取上层清液加入 (填序号)进行检验。 A.碳酸钠溶液 B.铁粉 C.无色酚酞
石灰石经过高温煅烧可得生石灰,生石灰与水反应可得氢氧化钙,而石灰水可以和纯碱反应制得氢氧化钠(烧碱),但常常要考虑纯碱和氢氧化钙过量带来的杂质问题。
例4 [2018·昆明] 金属钛被用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成分为FeTiO3)制取钛并获得副产品A的主要工艺流程如下:(1)反应①的化学方程式为 。 (2)TiO2与焦炭(C)和Cl2在高温下反应,该反应中C和Cl2按质量比为12∶71的比例参加反应,相应的化学方程式为 。 (3)反应②的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体。则该反应的化学方程式为 。
[答案] (1)H2TiO3 TiO2+H2O (2)TiO2+2C+2Cl2 TiCl4+2CO (3)2FeSO4 Fe2O3+SO2↑+SO3↑
例5 [2018·德阳] 氢氧化镁是一种重要的化工原料。某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:
部分金属阳离子以氢氧化物形成沉淀时的溶液的pH见下表。
(1)熟石灰主要成分的化学式是 。 (2)溶液A中的阳离子是 (填离子符号)。 (3)沉淀C的成分是 。 (4)溶液B与熟石灰反应的化学方程式是 。
1.[2018·呼和浩特] 黄铁矿的主要成分是二硫化亚铁(FeS2),工业上可利用黄铁矿煅烧的产物,冶炼铁和生产浓硫酸,其工业流程如下。下列说法错误的是( )A.反应②不是置换反应,反应③④为化合反应 B.反应①中各元素的化合价均发生了改变C.该工业生产过程产生的废气中的SO2可以用熟石灰溶液吸收D.向制得的100 g 98%的浓硫酸中加入100 g蒸馏水配制49%的稀硫酸
[解析] 本题是一道工业流程图题,主要考查了金属的冶炼,工业炼铁。反应②炼铁的主要原理是一氧化碳还原氧化铁,该反应不是置换反应;反应③为二氧化硫和氧气反应生成三氧化硫,反应④为三氧化硫和水反应生成硫酸,都是化合反应,故A正确。反应①中,原料二硫化亚铁(FeS2)中铁元素的化合价为+2,硫元素的化合价为-1,氧气中氧元素的化合价为0;反应后产物氧化铁中,铁元素的化合价为+3,氧元素的化合价为-2,二氧化硫中硫元素的化合价为+4,氧元素的化合价为-2,故各元素化合价均发生了改变,故B正确。该工业生产过程产生的废气中的SO2可以用熟石灰溶液吸收,产生的亚硫酸钙亦为工业原料,故C正确。浓硫酸的稀释操作,应该是将浓硫酸沿烧杯内壁缓慢地注入水中,并用玻璃棒不停地搅拌,以防散热不均,造成液体飞溅,故D错误。
2.海水中含有丰富的镁,目前世界上生产的镁60%来自于海水。分离出食盐的海水称作苦卤水,其中含有丰富的MgCl2。工业上以苦卤水为原料制取金属镁的流程如下:(1)写出沉淀槽中发生反应的化学方程式: 。 (2)Y与Z反应后的产物溶于水可得X溶液,从而实现了Y的循环利用,则Z的化学式为 ,X溶液的名称是 。 (3)烘干后得到的MgCl2中可能含有的杂质是 。
[解析] (1)牡蛎壳(主要成分是碳酸钙)高温煅烧生成氧化钙,氧化钙与水反应生成氢氧化钙,氯化镁与氢氧化钙反应生成氯化钙和氢氧化镁沉淀。(2)氯化镁电解为分解反应,产物为镁和氯气,单质Y为氯气,氯气和氢气反应生成氯化氢,氯化氢溶于水形成盐酸,故Z是氢气。(3)氢氧化钙是微溶物,混杂在氢氧化镁沉淀中,与盐酸反应生成氯化钙,所以烘干后得到的MgCl2中可能含有的杂质是氯化钙。
3.[2017·北京] 超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意图如图T5-13所示。请回答下列问题。(1)石灰石主要成分的化学式为 。 (2)乳化池中,生石灰与水发生反应,其化学方程式为 。 (3)过筛的目的是拦截 (填“大于”或“小于”)筛孔直径的颗粒。 (4)碳化塔中反应的化学方程式为 。
4.[2018·广州] 氧化锌(ZnO)可作为紫外线吸收剂应用于化妆品中,其一种生产工艺如下:(1)推测草酸的化学式是 。 (2)“沉锌”过程中发生复分解反应,反应的化学方程式是 。 (3)“操作A”的名称是 ;实验室常用的研磨仪器是 。 (4)“高温灼烧”时草酸锌分解,反应的化学方程式是 。
例6 [2018·北京] 为保护绿水青山,可将工业残留的钡渣[主要成分为碳酸钡(BaCO3)]进行无害化处理,制取化工原料硫酸钡(BaSO4)。主要流程如下:已知:BaSO4难溶于水,氯化钡(BaCl2)可溶于水。(1)粉碎钡渣的目的是 。 (2)反应釜1中的气体X为 。 (3)反应釜2中发生复分解反应的化学方程式为 。
例7 随着环境问题的日益严重,垃圾的处理问题正日益被人们所重视。某垃圾处理厂对金属垃圾(主要成分是铁、铜、氧化铁、二氧化硅)处理及综合利用的部分工艺如图T5-16所示,请回答下列问题。(1)Ⅰ、Ⅱ均为 操作,此操作中玻璃棒的 作用是 。 (2)步骤③所发生的反应属于基本反应类型中的 。 (3)请写出步骤②④所发生反应的化学方程式:② ; ④ 。
[解析] (1)操作Ⅰ、Ⅱ是将固体与液体分离,是过滤操作;此过程中玻璃棒的作用是引流,防止液体飞溅。(2)步骤③是硫酸铁溶液中加入碱溶液,生成红褐色沉淀氢氧化铁,其基本反应类型为复分解反应。(3)步骤②是氧化铁、二氧化硅中加入硫酸,氧化铁能与硫酸反应生成硫酸铁和水;步骤④是加热红褐色沉淀氢氧化铁,其分解产物是氧化铁和水。
1.[2018·宜昌] 工业上可通过图T5-17所示工艺流程处理工厂排放的含二氧化硫的尾气并获得氢气。主反应器中反应的化学方程式是 。膜反应器中反应的类型是 。该工艺流程中,能被循环利用的物质是 。
[解析] 二氧化硫、水和碘单质共同反应能生成碘化氢和硫酸。膜反应器中碘化氢能分解生成氢气和碘单质,属于分解反应。该工艺流程中,能被循环利用的物质是碘单质。
2.CO2是造成温室效应的主要气体,而工业上却可用CO2来制备甲醛等物质。“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来并加以利用——如可利用NaOH溶液来“捕捉”CO2,其过程如图T5-18所示(部分条件及物质未标出)。(1)用NaOH溶液“捕捉”CO2的化学方程式是 。 (2)“反应、分离”环节中,分离物质所采用的基本操作是 。 (3)此化学工艺流程中没有涉及的基本反应类型是 。
安徽中考复习 人教版化学 题型突破 题型四 工艺流程图题 课件: 这是一份安徽中考复习 人教版化学 题型突破 题型四 工艺流程图题 课件,共29页。PPT课件主要包含了专题突破·明技法,Fe和Cu,较多固体出现,玻璃棒,FeSO4+,作钾肥,强化训练·检成效,HCl,H2O,复分解反应等内容,欢迎下载使用。
人教版中考化学复习题型突破六流程图题课件: 这是一份人教版中考化学复习题型突破六流程图题课件,共37页。PPT课件主要包含了富集氯化镁,复分解反应,HCl,Mg2+,FeOH3,作氮肥,CuNO32,CuAg,混合物,H2SO4等内容,欢迎下载使用。
中考化学复习题型突破六流程图题练习课件: 这是一份中考化学复习题型突破六流程图题练习课件,共37页。PPT课件主要包含了富集氯化镁,H2O,玻璃棒,置换反应,稀盐酸,I2或碘,白色固体,碳酸铵,NH42S,AgNO3等内容,欢迎下载使用。












