





河南省中考化学复习第13讲质量守恒定律化学方程式课件
展开1. 内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。【温馨提示】①“总和”意味着把各种状态的反应物和生成物都算在内。如沉淀、肉眼看不见的气体也应考虑。②参加化学反应的各物质的质量总和并不是各物质的任意质量之和,不参加反应的物质的质量不能计算在内。③质量守恒定律的“守恒”,是指质量守恒,而不是体积、反应物的分子个数守恒。
2. 实质:化学反应的过程是参加反应各物质的原子重新组合而生成其他物质的过程,因此在化学反应前后,原子的种类没有改变,数目没有增减,质量也没有改变,所以物质的总质量不变。3. 质量守恒定律的理解理解质量守恒定律应抓住“六个不变、两个一定变、两个可能改变”。
4. 质量守恒定律的验证(详见实验突破)(1)反应:必须发生化学反应。(2)装置:如有气体参加或生成,则必须在密闭容器中进行。5. 质量守恒定律的应用(1)解释有关现象(依据化学反应前后总质量不变)(2)求反应中某反应物(或生成物)的质量(依据参加化学反应的各物质的质量总和等于生成的各物质的质量总和)(3)确定某物质的化学式(依据化学反应前后原子种类、数目不变)(4)求某物质的组成元素(依据化学反应前后元素的种类不变)
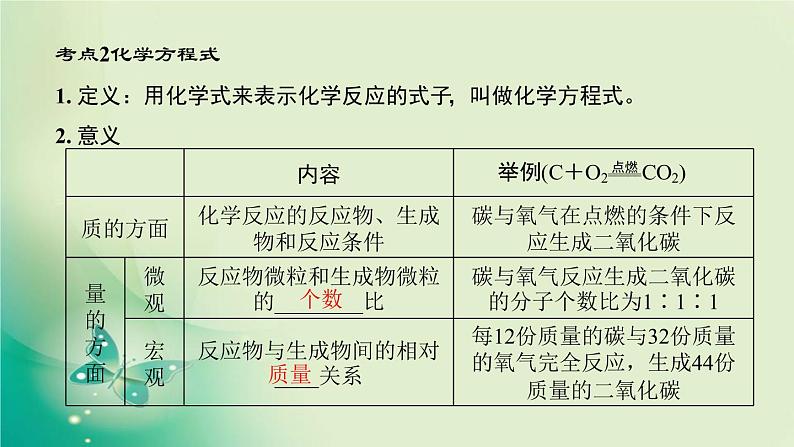
1. 定义:用化学式来表示化学反应的式子,叫做化学方程式。2. 意义
3. 化学方程式的书写(1)书写原则:一是一定要以客观事实为基础,不能凭空臆造不存在的物质和化学式;二是遵守质量守恒定律,等号两边的原子个数必然相等。(2)书写步骤:
考点3有关化学方程式的简单计算
1. 理论依据:质量守恒定律,即各物质间有确定的质量比。2. 计算步骤:设、写、找、列、求、答。3. 计算过程若20 g质量分数为7.3%的盐酸与12.7 g氢氧化钠溶液恰好完全反应,试计算反应后所得溶液中溶质的质量。
4. 化学方程式计算的几种类型(1)由一种纯净的反应物(或生成物)的质量求生成物(或反应物)的质量。【特别提醒】①质量守恒定律是计算的依据,书写化学方程式时必须配平。②相对分子质量必须写在对应物质的化学式下面,相应的已知量(包括单位)、未知量写在相对分子质量下面。(2)含一定杂质(杂质不参加反应)的反应物或生成物的计算。【特别提醒】①代入方程式计算的必须是纯净物质量,纯净物质量=混合物质量×纯净物的质量分数。②代入方程式计算的必须是真正参加反应或反应后生成的物质质量。③若涉及物质的体积,可用公式m=ρV进行换算。
(3)溶液中的有关化学方程式计算。溶液属于混合物,即为不纯物质,可按照(2)中方法进行解答,常用计算公式:溶液的质量=溶质的质量+溶剂的质量;溶质的质量=溶液的质量×溶质的质量分数。
类型1质量守恒定律的应用
Ⅱ.物质的元素组成的推断【例2】(2017达州)某纯净物3 g在氧气中完全燃烧,生成8.8 g二氧化碳和5.4 g水。下列说法不正确的是( )A. 该纯净物中含有C、H元素,不含O元素B. 该反应中O2和CO2的质量比为14∶11C. 该反应中O2和H2O的分子数之比为7∶6D. 该纯净物中C、H原子的个数比为1∶4
解题思路:根据质量守恒定律的含义(即六不变)中的“元素的种类不变”可知,生成物所含的碳、氢、氧三种元素中的碳元素和氢元素一定来自于纯净物,至于氧元素可能全部来自于氧气,也可能部分来自于氧气,另一部分则来自于3 g物质,可根据元素的质量不变进行判断;根据生成物CO2和H2O中C、H元素质量,让碳、氢元素的质量分别除以各自的相对原子质量再相比,就可以得到该物质中碳、氢两元素的原子个数比。
Ⅲ.微观反应示意图【例3】(2017宁波)如图是物质甲和乙反应生成丙的微观示意图。下列说法正确的是( )A. 该化学反应属于化合反应B. 甲和乙属于单质,丙属于化合物C. 参加反应的甲与乙的分子个数比为1∶1D. 1个丙分子由1个甲分子和2个乙分子构成
方法指导:①反应类型判断:根据题中所给信息,先抵消化学反应前后相同的物质(即由相同小球组成,且结构也相同的物质),写出该反应的表达式,判断其反应类型。②化学方程式的书写:利用化学反应中小球的组合形式及图中小球所代表的原子,写出反应前后的物质,利用化学方程式的配平原则,正确书写化学方程式。
③物质类别的判断:若小球代表的原子已知,根据反应示意图写出物质的化学式,判断该物质的类别;若小球代表的原子未知,用字母代表小球写出物质的化学式,判断其物质类别。④参加反应的物质的分子个数比:利用②中方法书写化学方程式,根据化学方程式判断参加反应的物质的分子个数比即可。
Ⅳ.有关质量守恒定律的数据分析【例4】(2017滨州)在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后测得有关数据如下表:
下列说法中,不正确的是 ( )A. 反应后物质甲的质量为13 gB. 乙是反应物C. 反应中乙、丁的质量比为5∶4D. 物质丙可能是该反应的催化剂
方法指导:考场中解答表格型质量守恒定律试题的解决方法如下:第一步:未知物质质量的计算根据反应前后物质的质量总和不变列出等式,求出未知物的质量。第二步:反应物、生成物、催化剂的判定反应后质量增加——生成物;反应后质量减少——反应物;质量不变——可能是催化剂,也可能是未参与反应的物质。第三步:根据反应物、生成物种类及反应特点判断反应类型等其他信息的正误。
及 时 练 习1. (2017安阳一模)Sb2O5是一种重要的阻燃剂,制取该物质的化学方程式为:Sb2O3+2X === Sb2O5+2H2O,则X的化学式为( )A. H2O2 B. O2C. H2 D. H2SbO42. (2017邵阳)AgNO3固体见光或受热易分解,故保存在棕色瓶中,AgNO3见光分解时产生一种有刺激性气味的气体,该气体可能是( )A. H2S B. SO2 C. N2 D. NO2(导学号 12604087)
3. (2017濮阳一模)如图是一定条件下某反应的微观过程。下列说法中正确的是( )A. 反应物个数比:水、双氧水的比为1∶1B. 产物质量比:氧气、水的比为2∶1C. 化学变化的本质:原子的重新组合D. 化学计量数:氧气、水的比为1∶4
4. (2017洛阳八校联考)一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下表。下列说法正确的是( )
A. m的值为1.7B. 物质X可能为催化剂C. 参加化学变化的物质Y、N的质量比为22∶9D. 该反应一定是高锰酸钾分解制氧气(导学号 12604088)
5. (2017南阳一模)如图是某反应的微观示意图。图中的单质为________;该反应的基本类型为________;生产物有________种。
6. (2017开封一模)现有2.3 g某可燃物和O2充分反应,经测定生成2.2 gCO2、1.4 gCO和2.7 gH2O,则该可燃物分子中所含原子的最简个数比为________,该反应中O2与CO2的化学计量数之比为________。(导学号 12604089)
类型2化学方程式的书写
【例】(2017洛阳一模)下列方法及相关化学反应方程式都正确的是( )A. 用灼烧法除去氧化铜中的木炭粉: C+O2 === CO2B. 用铁和稀盐酸反应来制取氯化铁: 2Fe+6HCl === 2FeCl3+3H2↑C. 用氢氧化钙和硝酸钾反应来制取氢氧化钾: Ca(OH)2+2KNO3 === 2KOH+Ca(NO3)2D. 用含氢氧化镁的药物治疗胃酸过多症: Mg(OH)2+2HCl === MgCl2+2H2O
方法指导:化学方程式书写注意事项(判断书写正误的标准):1. 化学式书写必须正确;2. 化学方程式要符合客观事实;3. 化学方程式要配平;4. 要注明反应条件[“点燃”、“加热”(常用△表示)、“高温”、“催化剂”等,写在生成符号上方];5. 如果反应物中没有气体而生成物中有气体,在气体物质的化学式右边注“↑”;6. 溶液中的反应如果反应物中没有固体而生成物中有固体,则在固体物质化学式右边注“↓”。
2. (2017洛阳模拟)用化学方程式表示下列反应原理:(1)酒精灯中用酒精作燃料。(2)将氧化铜粉末置于试管中加热,通入氨气,则生成铜、水和一种气体单质。
3. 用化学方程式或文字完成下列问题:(1)铁与硫酸铜溶液反应的化学方程式__________________________,基本反应类型是______________________。(2)工业上用CO还原赤铁矿(赤铁矿的主要成分是Fe2O3)炼铁。(3)天然气的主要成分甲烷燃烧的化学方程式。
Fe+CuSO4 === FeSO4+Cu
4. 写出下列反应的化学方程式。(1)镁条在空气中燃烧生成氧化镁____________________________________________________________(2)锌和稀硫酸反应____________________________________________________________(3)氢氧化钠溶液和稀盐酸反应____________________________________________________________(4)实验室加热高锰酸钾制取氧气____________________________________________________________(5)硫化氢(H2S)气体和二氧化硫气体混合生成硫和水____________________________________________________________
HCl+NaOH === NaCl+H2O
2H2S+SO2 === 3S+2H2O
5. (2017商丘模拟)生产或生活中蕴含着许多化学原理,请用化学方程式解释下列原理。(1)生活中用盐酸除铁锈。(2)医疗上用含有小苏打的药物来治疗胃酸过多症。(3)如何检验硫酸铵与硫酸钾这两种化肥?(导学号 12604090)
Fe2O3+6HCl === 2FeCl3+3H2O
NaHCO3+HCl === NaCl+H2O+CO2↑
(NH4)2SO4+Ca(OH)2 === CaSO4+2NH3↑+2H2O
类型3化学方程式的简单计算
注意事项:1. 各代入量均指纯净物的质量。若物质不纯必须换算成纯净物的质量才能代入化学方程式进行计算。2. 计算中所用的质量必须是实际参加反应的物质的质量。
及 时 练 习1. (2017洛阳一模)取Mg和MgO的混合物6.4 g,与一定量稀硫酸恰好完全反应(反应后溶液中无晶体析出),所得溶液中溶质的质量为24 g。则原混合物中氧元素的质量( )A. 1.6 g B. 2.56 g C. 3.2 g D. 4.8 g(导学号 12604091)
2. (2017德阳)某校化学课外活动小组的同学在实验室的一次探究性活动中,他们将50 g氢氧化钠溶液与50 g硫酸铜溶液混合恰好完全反应,得到9.8 g沉淀,请你计算氢氧化钠溶液中溶质的质量分数。
实验 质量守恒定律的验证
2. 质量守恒定律的适用范围及验证质量守恒定律的化学反应的选择(1)质量守恒定律只能应用于化学变化,不能应用于物理变化。(2)质量守恒定律的实验探究必备的条件是:选择反应现象明显且没有气体生成的化学反应。3. 有气体参加或生成的实验装置要求如果所选的化学反应中有气体参加或生成,则应在密闭容器中进行。
4. 实验现象分析应从三个方面着手:一是化学反应的现象(说明肯定发生了化学反应),如B装置中蓝色溶液变为浅绿色溶液;二是天平的平衡状况(说明化学反应前后质量关系),如A装置中,红磷燃烧,产生大量白烟,小气球鼓起,冷却后小气球变得更瘪,天平平衡;三是如果反应后天平不平衡,对此现象的解释(反应中是否有气体逸散,外界物质是否进入,用气球收集反应生成的气体时浮力的影响等),如C装置中产生大量气泡,用气球收集产生的气体,天平平衡。
【例】(2017青岛)为了探究化学反应前后物质的总质量是否发生改变,甲同学和乙同学分别设计了下面两个实验,请根据图示回答问题:
(1)甲同学设计的实验如图A所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应后,托盘天平的指针________(选填“向左”、“向右”或“不”)偏转,原因是____________________________________________________________。
稀硫酸与锌粒反应生成的H2逸散到空气中,使得天平左侧质量减少
(2)乙同学设计的实验如图B所示,通过实验得出结论:化学反应前后物质的总质量________。(3)两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在________装置中进行。(4)从微观角度分析,在化学反应前后一定不变的是________(选填序号)。①原子种类 ②分子种类 ③原子数目 ④分子质量 ⑤分子数目 ⑥原子质量(导学号 12604092)
命题点1 质量守恒定律的验证
2. (2015河南19题2分)为验证质量守恒定律,某同学设计了如图实验。该实验能否达到实验目的?请说明理由。
不能。因为稀盐酸与硫酸钠溶液不能发生化学反应。
应用一 推断未知物质的化学式及元素组成1. (2017河南11题1分)硝酸铜受热分解会产生一种污染空气的有毒气体,该气体可能是( )A. N2 B. NO2 C. NH3 D. SO2(导学号 12604093)
命题点2质量守恒定律的应用
2. (2016河南10题1分)偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该化学方程式为:C2H8N2+2N2O4=== 2X↑+3N2↑+4H2O↑。下列说法正确的是( )A. X的化学式为COB. 偏二甲肼中碳的质量分数为40%C. 该反应属于分解反应D. 生成N2和H2O的质量比为14∶9
3. (2013河南9题1分)探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象。推测该气体可能是( ) A. 氢气 B. 二氧化硫C. 二氧化碳 D. 一氧化碳
应用二 表格数据分析5. (2012河南10题1分)一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
下列说法正确的是( )(导学号 12604094)A. 反应后X的质量为1.5 gB. X中一定含有碳元素和氧元素C. X中一定含有碳元素和氢元素D. X中两种元素的质量比为1∶1
应用三 推断反应物或生成物的质量6. (2016河南17题第二空1分)2015年诺贝尔奖获得者屠呦呦发现的青蒿素是一种抗疟疾药,若14.1 g青蒿素燃烧生成33.0 g CO2和9.9 g H2O,则青蒿素中氧的质量与其燃烧消耗氧气的质量之比为________。7. (2015河南17题2分)在点燃条件下,2.6 g C2H2与7.2 g O2恰好完全反应,生成6.6 g CO2、1.8 g H2O和x g CO。则x=__________;化学方程式为______________________________。(导学号 12604095)
8. (2014河南16题2分)一定条件下,4.8 g CH4与16.0 g O2恰好完全反应,生成10.8 g H2O、4.4 g CO2和物质X。则X的质量为________g;该反应方程式中O2与X化学计量数之比为________。
应用四 微观反应示意图9. (2017河南12题1分)如图是某反应的微观示意图,下列有关该反应的说法不正确的是( )A. 属于置换反应B. 相对分子质量最小的是NH3C. 生成丙和丁的质量比为1∶3D. 氢元素的化合价在反应前后没有变化(导学号 12604096)
10. (2014河南6题1分)如图是高温下某反应的微观过程。下列说法中正确的是( )A. 该反应属于复分解反应B. 该反应中元素的化合价没有变化C. 图中的两种化合物都属于氧化物D. 该反应所得生成物的质量比为1∶1
11. (2016河南16题2分)如图是某反应的微观示意图,其化学方程式为___________________________;以上反应生成的酸能和碱中和,如果将Cl2通入到石灰乳中可制取漂白粉[有效成分Ca(ClO)2],化学方程式为___________________________________________________。
Cl2+H2O=== HCl+HClO
2Cl2+2Ca(OH)2=== CaCl2+Ca(ClO)2+2H2O
12. (2015河南16题3分)如图是某反应的微观示意图。图中的单质为____________;该反应前后化合价没有发生变化的元素为________;生成物的质量比为__________。
7∶22(或22∶7)
13. (2013河南12题2分)如图是治理汽车尾气反应的微观过程。图中单质是________(填名称);化学方程式为__________________。
命题点3化学方程式的书写
2. (2017河南16题第二空1分)在医疗上可用小苏打治疗胃酸(HCl)过多症,其原理是_____________________________________________(用化学方程式表示)。3. (2017河南20题第一空1分)电解食盐水可得到烧碱、氯气(Cl2)和一种可燃气体,反应的化学方程式为____________________________________________。
NaHCO3+HCl === NaCl+H2O+CO2↑
4. [2015河南23(2)题2分](2)钠与水反应生成氢氧化钠和氢气,化学方程式为_______________________________________________;小苏打受热分解成碳酸钠、二氧化碳和水,化学方程式为______________________________________________。
2Na+2H2O=== 2NaOH+H2↑
5. [2013河南15(2)(3)题2分]化学与生产、生活密切相关。(2)酒精燃烧的化学方程式为__________________________。(3)氯碱工业中电解食盐水得到烧碱和两种气体,一种是最轻的气体,另一种的相对分子质量为71。该反应的化学方程式为________________________________________。
6. [2017河南25题(1)①题1分]化学是以实验为基础的科学,实验是科学探究的重要手段。(1)某化学兴趣小组的同学利用下图微型实验装置进行探究实验。
①写出一个双球管中可能反应的化学方程式。
7. (2014河南20题3分)用化学方程式表示下列反应原理。(1)用电解水的方法制取氢气。(2)用磁铁矿石(含Fe3O4)炼铁。(3)实验室制取氧气。(写出一个即可)
8. [2012河南18(3)(4)题2分]请用所学化学知识解释下列原理。(3)用化学方程式表示含Mg(OH)2的药物治疗胃酸过多症的原理。(4)用化学方程式表示“联合制碱法”中的如下反应:向饱和食盐水中先后通入足量的NH3和CO2,生成小苏打(在该溶液中难溶)和一种氮肥。(导学号 12604097)
(3)Mg(OH)2+2HCl=== MgCl2+2H2O(4)NaCl+H2O+NH3+CO2=== NaHCO3↓+NH4Cl
1. (2015河南12题1分)现有10.6 g碳酸钠和8.4 g碳酸氢钠,分别与过量盐酸反应,其中( )A. 碳酸钠消耗的氯化氢多B. 碳酸钠生成的二氧化碳多C. 碳酸氢钠消耗的氯化氢多D. 碳酸氢钠生成的二氧化碳多(导学号 12604098)
命题点4化学方程式的简单计算
3. (2017河南20题第三空1分)现有NaCl和NaBr的混合物共2.2 g,溶于水并加入过量AgNO3溶液后,生成AgCl和AgBr沉淀共4.75 g,则原混合物中含钠元素的质量为________g。(导学号 12604100)
4. [2017河南25(3)题3分](3)将30.9 g氯酸钾(KClO3)和二氧化锰的固体混合物装入试管中,加热制取氧气,同时生成氯化钾。待反应完全后,将试管冷却、称量,可以得到21.3 g固体物质。请计算原固体混合物中氯酸钾的质量。
5. [2016河南23(5)题3分](5)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来。若用铝与四氧化三铁反应来制取25.2 kg铁,理论上需要消耗铝的质量是多少?
6. [2015河南23(5)题3分](5)钛和钛合金性能优良,广泛用于航空、造船和化学工业中。工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛。若要用该方法制取2.4 kg钛,理论上需要钠的质量是多少?
8. [2013河南21(4)题3分](4)LiOH和NaOH的化学性质相似。“神舟”飞船内,可用盛有LiOH的过滤网吸收航天员呼出的气体,以降低CO2含量。请计算:用LiOH完全吸收176 g CO2,生成Li2CO3和H2O,理论上至少需要LiOH的质量是多少?
初中化学一轮复习课件 专题13 质量守恒定律与化学方程式(讲通练透): 这是一份初中化学一轮复习课件 专题13 质量守恒定律与化学方程式(讲通练透),共45页。PPT课件主要包含了中考化学一轮复习策略,聚焦中考复习目标,复习目标,聚焦中考命题解读,命题解读,聚焦中考考点梳理,考点1质量守恒定律,质量守恒定律,化学反应前后,一定不变等内容,欢迎下载使用。
中考化学复习第6讲质量守恒定律和化学方程式课件: 这是一份中考化学复习第6讲质量守恒定律和化学方程式课件,共39页。PPT课件主要包含了质量守恒定律,知识梳理答案,H2O,CO+,CO2,⑤④①②③,温度未达到红磷的,着火点,置换反应,m1+m2+m3-等内容,欢迎下载使用。
中考化学复习第3讲质量守恒定律与化学方程式精练课件: 这是一份中考化学复习第3讲质量守恒定律与化学方程式精练课件,共19页。PPT课件主要包含了能溶于水,H2O,逆风向高处跑用湿,毛巾捂住口鼻等,盘上翘右盘下降,∶3∶12等内容,欢迎下载使用。












