




- 河南省中考化学复习第2讲碳和碳的氧化物课件 课件 0 次下载
- 河南省中考化学复习第3讲自然界的水课件 课件 0 次下载
- 河南省中考化学复习第5讲金属的化学性质课件 课件 0 次下载
- 河南省中考化学复习第6讲金属材料及其利用和保护课件 课件 0 次下载
- 河南省中考化学复习第7讲常见的酸和碱课件 课件 0 次下载
河南省中考化学复习第4讲溶液课件
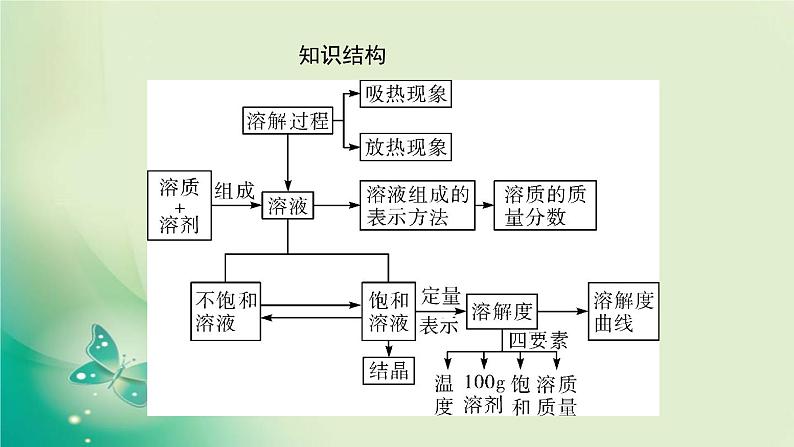
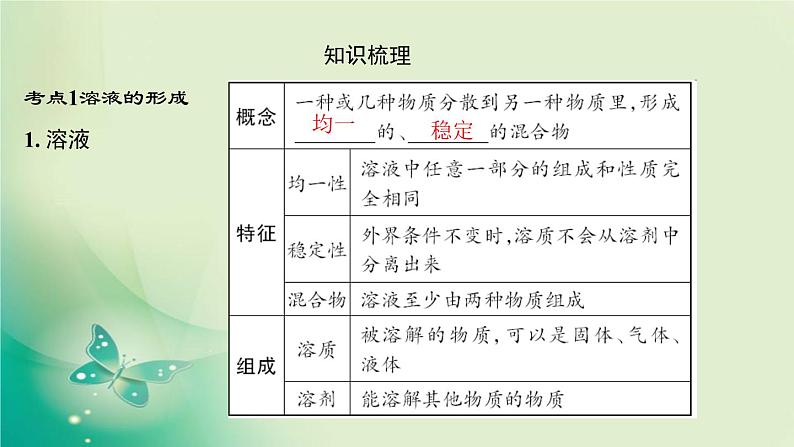
展开考点1溶液的形成1. 溶液
【温馨提示】①均一、稳定的液体并不一定是溶液,如水、酒精等。②溶液不一定都是无色的,如硫酸铜溶液呈蓝色,氯化铁溶液呈黄色等。③溶质可以是固体,也可以是液体或气体。如果两种液体相互溶解时,一般把量多的一种叫做溶剂,量少的一种叫做溶质。如果其中一种是水,一般把水叫做溶剂。
2. 溶解时的吸放热现象
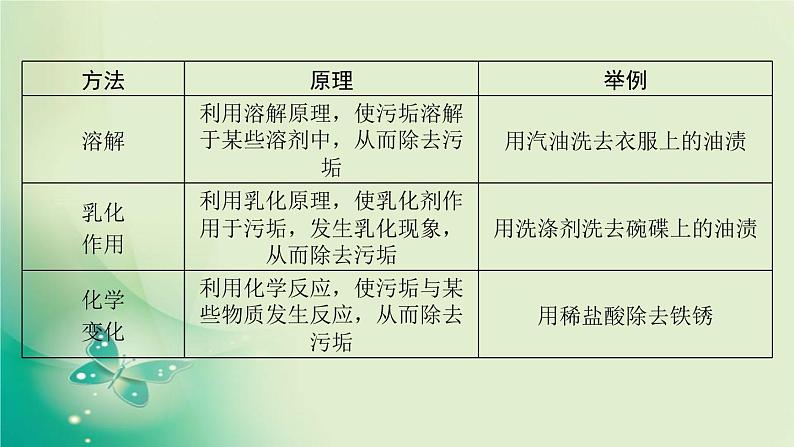
【温馨提示】CaO加入水中后溶液温度升高,但它不是溶于水放热,而是与水发生化学反应放出热量。3. 乳化(1)乳浊液:小液滴分散到液体里形成的混合物,如豆浆。其特征是:不稳定、静置易分层。(2)乳化剂:能使乳浊液稳定的物质。(3)乳化作用:乳化剂所起的作用。(4)物质除污的方法和原理(溶解、乳化及化学变化)
考点2饱和溶液和不饱和溶液1. 概念:在一定________下,向____________里加入某种溶质,当溶质________________________时,所得的溶液叫做这种溶质的饱和溶液;反之,叫不饱和溶液。2. 判断方法(1)在条件(温度、溶剂的量)不变时,继续向溶液中加入这种溶质,观察是否溶解,若不再溶解则为饱和溶液,反之,则为不饱和溶液。
(2)一定条件下,若溶液中有未溶解的溶质,则溶液一定是该溶质的饱和溶液。(3)降低温度或蒸发溶剂析出晶体后所得到的溶液一定为该溶质的饱和溶液。
4. 结晶(1)冷却热饱和溶液法(降温结晶):适用于溶解度受温度影响大的物质,如KNO3。(2)蒸发溶剂法(浓缩结晶):适用于溶解度受温度影响不大的物质,如NaCl。
【温馨提示】溶液的稀、浓与溶液是否饱和的关系:如图所示,饱和溶液不一定是浓溶液;不饱和溶液不一定是稀溶液;但同种溶质在同一温度下,其饱和溶液一定比其不饱和溶液浓。
考点3溶解度及溶解度曲线1. 固体物质的溶解度(1)定义:在______________下,某固态物质在____________里达到________状态时所溶解的质量。(2)四要素:一定温度、饱和状态、溶质的质量、100g溶剂。
(3)影响因素:①内因:溶质和溶剂的性质。②外因:温度a.大多数物质的溶解度随温度的升高而____________,如:硝酸钾、氯化铵等;b.少数物质的溶解度受温度的影响________,如:氯化钠等;c.极少数物质的溶解度随温度的升高而______,如氢氧化钙。
【温馨提示】溶解度与溶解性的关系
2. 气体的溶解度(1)定义:指该气体的压强为101 kPa和一定温度时,在1体积水里达到饱和状态时的气体体积。(2)影响因素①内因:气体本身的性质和溶剂种类。②外因:温度和压强。气体溶解度随温度的升高而减小,随压强的增大而增大。
3. 溶解度曲线(1)概念:指溶解度随温度变化的曲线。横坐标表示温度,纵坐标表示溶解度。(2)意义
(3)应用①查找某物质在不同温度下的溶解度。②比较不同物质在相同温度时的溶解度大小,若某温度下两种物质的溶解度曲线有交点,则在该温度下,两种物质的溶解度相等。③比较不同物质的溶解度受温度变化影响的大小,据此可以判断结晶的方法。溶解度受温度变化影响大(曲线向上且“陡”)的,常用________________________________________的方法结晶;溶解度受温度变化影响小(曲线变“平缓”)的,常用________________的方法结晶。
冷却热饱和溶液(降温)
④判断适合某物质饱和溶液、不饱和溶液之间相互转化的方法。⑤比较变化后溶液溶质的质量分数关系。
【温馨提示】计算时要考虑溶质是否全部溶解;加入的溶质是否和原溶液中的溶质一致;某物质溶于水时,与水发生化学反应,应计算最终所得溶液中溶质的质量分数。2. 有关溶液稀释的计算(1)原理:溶液稀释前后,溶质的质量不变。(2)计算公式:A×a%=B×b%(其中a%、b%分别为稀释前、后溶质的质量分数,A、B分别为稀释前、后溶液的质量,即B=A+水的质量)。
【特别提醒】不同质量分数的溶液混合,混合液的体积不等于混合前各溶液的体积之和,而质量可以相加。3. 根据化学方程式进行溶质质量分数的综合计算(1)解题关键:通过化学方程式计算溶质的质量,并求出反应后溶液的质量。(2)反应后溶液质量的计算方法:①溶液组成法:溶液的质量=溶质的质量+溶剂的质量②质量守恒法:溶液的质量=参与反应的固体质量+液体质量-生成沉淀的质量-生成气体的质量
考点5 一定溶质质量分数溶液的配制(详见实验突破)
类型 溶解度及溶解度曲线【例】如图为甲、乙两种物质的溶解度曲线。下列有关说法不正确的是( )(导学号 12604017)A. 向t1 ℃时,乙的饱和溶液加水可变为不饱和溶液B. 将t2 ℃时,甲的饱和溶液降温至t1 ℃,溶液质量变小C. t1 ℃时,将50 g水加入到20 g甲物质中,可得到70 g溶液D. 将t1 ℃时甲、乙的饱和溶液分别升温至t2 ℃,两溶液的溶质质量分数:乙>甲
解题技巧:解答溶解度曲线类试题时,可从以下几点考虑:①什么时候物质的溶解度相等?答:找交点——溶解度曲线交点对应的温度就是物质溶解度相等的温度。②溶解度随温度的变化趋势?答:甲曲线呈上升趋势,说明溶解度随温度的升高越来越大;乙曲线基本平稳,说明溶解度随温度的升高变化不大。
⑤结晶时,溶质质量分数有没有变化问题?(针对甲物质的饱和溶液)答:降温结晶——溶质质量分数减小;恒温蒸发结晶—溶质质量分数不变。
1. (2017洛阳一模)如图为甲、乙两物质的溶解度曲线,下列有关说法中不正确的是( )A. 温度大于t1 ℃时,甲的溶解度大于乙的溶解度B. t1 ℃时,甲的饱和溶液中溶质的质量分数为15%C. 要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法D. t2 ℃,将50克甲物质放入100克水中,可得到溶液的质量为130 g
2. (2017南阳一模)甲、乙、丙三种固体物质的溶解度曲线如图所示。下列叙述不正确的是( )A. 将35 ℃时丙的饱和溶液降温到25 ℃,则其溶液的溶质质量分数变大B. 若固体甲中有少量乙,则可以用降温结晶的方法提纯甲C. 35 ℃时,甲、乙、丙三种物质的饱和溶液的溶质质量分数的大小关系为:甲>乙>丙D. 25 ℃时,将等质量的甲、乙分别配制成饱和溶液,所得溶液质量:乙>甲
3. (2017信阳一模)根据图中A、B两种物质的溶解度曲线回答相关问题:(1)________ ℃时,A、B两种物质的溶解度相同。(2)t2 ℃时,若将125 g A的饱和溶液的溶质质量分数稀释成以前的一半,需加水________ g。(3)将t2 ℃时,A、B两种物质的饱和溶液降温至t1 ℃(其他条件不变),所得溶液的溶质质量分数的关系是A________(填“>”“<”或“=”)B。
4. 下表是硝酸钾、氯化钠在不同温度下的溶解度。(1)从表中数据分析,溶解度受温度影响较大的物质是________。硝酸钾和氯化钠溶解度曲线的交点在________(填字母序号)之间。A. 20 ℃~30 ℃ B. 30 ℃~40 ℃C. 40 ℃~50 ℃
(2)20 ℃,将50 g硝酸钾与100 g水混合,充分搅拌后静置,得到的溶液是硝酸钾的_______(填“饱和”或“不饱和”)溶液。若将温度升高到40 ℃,该溶液溶质的质量分数为________(准确到0.1%)。(3)保持温度20 ℃,将氯化钠的不饱和溶液变成饱和溶液,写出一种可行的方法_____________________________________。
加溶质氯化钠(或恒温蒸发溶剂)
5. 20 ℃时,将不同质量的NaCl晶体分别加入100 g 水中,充分溶解后所得溶液质量与加入NaCl晶体质量的对应关系如下表:
请回答下列问题:(1)A组的溶液为________(填“饱和”或“不饱和”)溶液。(2)C组X的值为________。
(3)如图为NaCl的溶解度曲线图,图上a点纵坐标的值为________。Ca(OH)2的溶解度随温度变化的趋势与NaCl相反。则室温时,向饱和石灰水中加入少量生石灰,并恢复到室温,此时溶液中溶质的质量________(填“>”“<”或“=”)原溶液中溶质的质量。
实验一定溶质质量分数溶液的配制1. 仪器的选用及各仪器的作用(1)所用仪器:托盘天平(带砝码)、镊子、药匙、量筒、胶头滴管、烧杯、玻璃棒。(2)部分仪器的作用:①玻璃棒的作用是搅拌,目的是加快固体或液体溶质的溶解速率。②量筒的作用是量取液体的体积,选取量筒时量程要比量取液体的体积略大且越接近越好。
2. 操作步骤(1)所配制的溶液的溶质为固体时,整个配制过程如图所示:计算:计算所需溶质的______和水的________。计算公式:溶质质量=溶液质量×溶质的质量分数
溶剂质量=溶液质量-溶质质量称量:用____________称取一定质量的固体。量取:用________量取一定体积的水。溶解:将固体倒入烧杯中,再将量取的水倒入烧杯中,用________不断搅拌直至固体完全溶解。装瓶:将配制好的溶液转移到______________中,并贴上标签。
(2)用浓溶液配制稀溶液计算:计算所需浓溶液的体积和所需水的体积。计算公式:浓溶液质量×浓溶液溶质质量分数=稀溶液质量×稀溶液溶质质量分数量取:用量筒量取溶液(接近所需体积时改用胶头滴管)和水。溶解:将量取的浓溶液和水倒入烧杯中,用玻璃棒不断搅拌。装瓶:将配制好的溶液转移到试剂瓶中并贴上标签。
3. 注意事项(1)溶质为固体时计算所需物质的质量精确到小数点后一位(托盘天平只能准确到0.1 g)。(2)用托盘天平称量时要遵循“左物右码”的原则,且左右两盘上要垫上相同的纸片。(3)称量有腐蚀性或易潮解的药品时要放在玻璃器皿中称量,如称量NaOH固体。(4)用浓溶液配制稀溶液,进行计算时要准确运用体积、质量、密度的关系式。
4. 误差分析(1)由加入溶质的质量引起
(2)由加入溶剂的质量引起
2. (1) 4.(1) (2)
【例】(2017邵阳)某同学配制50 g 6%氯化钠溶液,整个操作过程如图所示,回答下列问题:(1)配制溶液的正确操作顺序为____________(填序号,下同),其中操作错误的是____________。
(2)图②中盛放氯化钠固体的仪器名称是________,需称取氯化钠________g。(3)量水时选用的量筒的量程最合适的是________(填序号),读数时视线要与量筒内_____________________________保持水平。A. 10 mL B. 25 mLC. 50 mL D. 100 mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是________(填序号)。A. 氯化钠固体不纯B. 用生锈砝码称量C. 装瓶时有少量溶液洒出D. 溶解时烧杯内壁有水珠
(5)步骤④中玻璃棒的作用是什么?(6)经检测,该同学配制的溶液溶质质量分数偏大,可能是什么错误实验操作导致的?(写出一条即可)
量取水的体积时俯视读数(合理即可)
命题点1乳化作用1. [2012河南18(1)题1分]请用所学化学知识解释下列原理。(1)洗涤剂能除去油污,是因为它具有________功能。
命题点2溶解度及溶解度曲线(含饱和溶液与不饱和溶液、溶质质量分数)1. (2016河南8题1分)如图是甲、乙的溶解度曲线。下列说法不正确的是( )(导学号 12604023)A. t1℃时,乙的溶解度大于甲的溶解度B. t2℃时,甲、乙饱和溶液中溶质的质量分数相等C. 降低温度能使接近饱和的甲溶液变为饱和溶液D. t3℃时,75 g甲的饱和溶液中加入50 g水,可以得到质量分数为25%的溶液
2. (2014河南9题1分)如图是甲、乙两种固体的溶解度曲线。下列说法中不正确的是( )A. t1℃时,甲和乙的溶解度相等B. t1℃时,30 g乙加到100 g水中形成饱和溶液C. t2℃,各100 g饱和溶液降温至t1℃析出固体甲多于乙D. t2℃,75 g甲的饱和溶液中加100 g水得到20%的溶液
3. (2015河南11题1分)下表是KCl和KNO3在不同温度时的溶解度。下列说法不正确的是( )A. 20 ℃时,KCl的溶解度大于KNO3的溶解度B. 两种物质溶解度相等的温度在20~30 ℃之间C. 40 ℃时,5 g KCl中加10 g水可得33.3%溶液D. 50 ℃时,10 g KNO3中加20 g水,充分溶解后再降温到30 ℃,有KNO3固体析出
4. (2013河南14题2分)如图是A、B的溶解度曲线。t2℃时分别将100 g A、B的饱和溶液降温至t1℃,析出固体质量A_______B(填“>”、“<”或“=”);把t2℃时150 g A的饱和溶液稀释为20%,需加水_________g。
5. (2017河南18题3分)如图是甲、乙两种固体的溶解度曲线。将t3 ℃时相同质量的甲、乙两种物质的饱和溶液降温至t1 ℃,只有甲的溶液中有固体析出。则乙的溶解度曲线为________(填“X”或“Y”);甲和乙的溶解度相等时的温度为________;t3 ℃时,将30 g甲的饱和溶液稀释为质量分数为10%的溶液,需加水的质量为________g。
命题点3一定溶质质量分数溶液的配制1. (2017河南20题第二空1分)配制质量分数为5%的氯化钠溶液,若量取水时俯视量筒刻度读数(其他操作正确),溶液的质量分数________5%(填“大于”、“小于”或“等于”)。
2. [2015河南23(3)题2分](3)配制一瓶如图溶液需氯化钠_________g;配制50 g 6%氯化钠溶液,若用量筒量取水时俯视读数(其他操作正确),则溶液的质量分数________6%(填“>”、“<”或“=”)。
3. (2012河南13题第三空1分)如图是某输液瓶标签上的部分内容。要把10 g这种葡萄糖溶液稀释为2%的溶液,需要水的质量为________g。
4. (2014河南21题3分)生产、生活中常需配制溶液。(1)配制一瓶如图所示溶液需氯化钠___________g。
2024贵州中考复习 人教版化学 板块一 第4讲 常见的溶液 课件: 这是一份2024贵州中考复习 人教版化学 板块一 第4讲 常见的溶液 课件,共60页。PPT课件主要包含了复习导航·析考向,知识清单·理脉络,溶解与乳化,考点突破·释疑难,1∶4,蒸发结晶,乙甲丙,实验探究·培素养,托盘天平,玻璃棒等内容,欢迎下载使用。
中考化学复习第15讲溶液的酸碱度课件: 这是一份中考化学复习第15讲溶液的酸碱度课件,共38页。
中考化学复习第9讲溶液课件: 这是一份中考化学复习第9讲溶液课件,共56页。PPT课件主要包含了第9讲溶液,溶解现象,结晶现象,知识梳理答案,溶质水=≠,乳化溶解乳化,故选C,胶头滴管,B>A=C,丙>乙>甲等内容,欢迎下载使用。












