

2021年高一上学期化学期末复习题(2019人教版必修一)教案
展开2021年高一上学期化学期末复习题
一、单选题(15题)
1.化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A.高炉炼铁 B.硅胶作袋装食品的干燥剂
C.天然气作燃料 D.肥皂水作蚊虫叮咬处的淸洗剂
2.在强酸性无色透明溶液中,下列各组离子能大量共存的是
A.Fe3+、K+、Cl-、NO B.Ag+、Na+、NO、Cl-
C.K+、Mg2+、SO、Cl- D.Ba2+、NH、Cl-、CO
3.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于Lv的叙述正确的是
A.原子序数为116 B.中子数为293
C.核外电子数为177 D.元素Lv的相对原子质量为293
4.下列化学用语或模型不正确的是
A.H2O的电子式∶
B.CO2的结构式∶O=C=O
C.CH4分子的空间充填模型∶
D.硫酸铁的电离方程式∶Fe2(SO4)3=2Fe3++3
5.某国外化学教材中有一张关于氧化还原反应的插图,由图可知,在该反应中是
A.还原剂 B.氧化剂 C.氧化产物 D.还原产物
6.实验室将NaClO3和Na2SO3按物质的量比2:1倒入烧瓶中,用水浴加热,同时滴入H2SO4溶液,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
A.ClO2 B.Cl2O C.Cl2 D.Cl2O3
7.下列各组中的两种物质作用,反应条件(温度或者反应物用量)改变,不会引起产物种类改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.Na2CO3和HCl
8.2019年12月以来,突发的新冠病毒肺炎威胁着人类的身体健康。乙醚、75%乙醇、含氯消毒剂、过氧乙酸()、氯仿等均可有效灭活病毒。下列有关说法正确的是
A.冠状病毒肺炎可通过气溶胶传播,胶体粒子直径大于100nm
B.口罩中间的熔喷布具有核心作用,其主要原料聚丙烯是一种天然高分子化合物
C.过氧化氢、过氧乙酸等消毒液均可以将病毒氧化而达到消毒的目的
D.“84”消毒液是以为主要有效成分的消毒液,为了提升消毒效果,可以与洁厕灵(主要成分为盐酸)混合使用
9.设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.16gCH4中含有的电子数为10NA
B.0.5mol/LAlCl3溶液中Cl-的数目为1.5NA
C.5.6gFe与足量氯气反应失去电子数为0.2NA
D.标准状况下,11.2LCCl4所含的分子数为0.5NA
10.小铭将wgNaCl固体完全溶于1L水中,溶解和电离过程如图所示。下列说法正确的是
A.a离子为Na+,b离子为Cl-
B.溶解和电离过程中,水分子与晶体不存在相互作用
C.所得溶液中c(Na+)等于mol/L
D.若再加入NaCl固体至离子浓度不再变化时,则所得为饱和溶液
11.将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比是
A.2∶3 B.3∶2 C.1∶2 D.1∶1
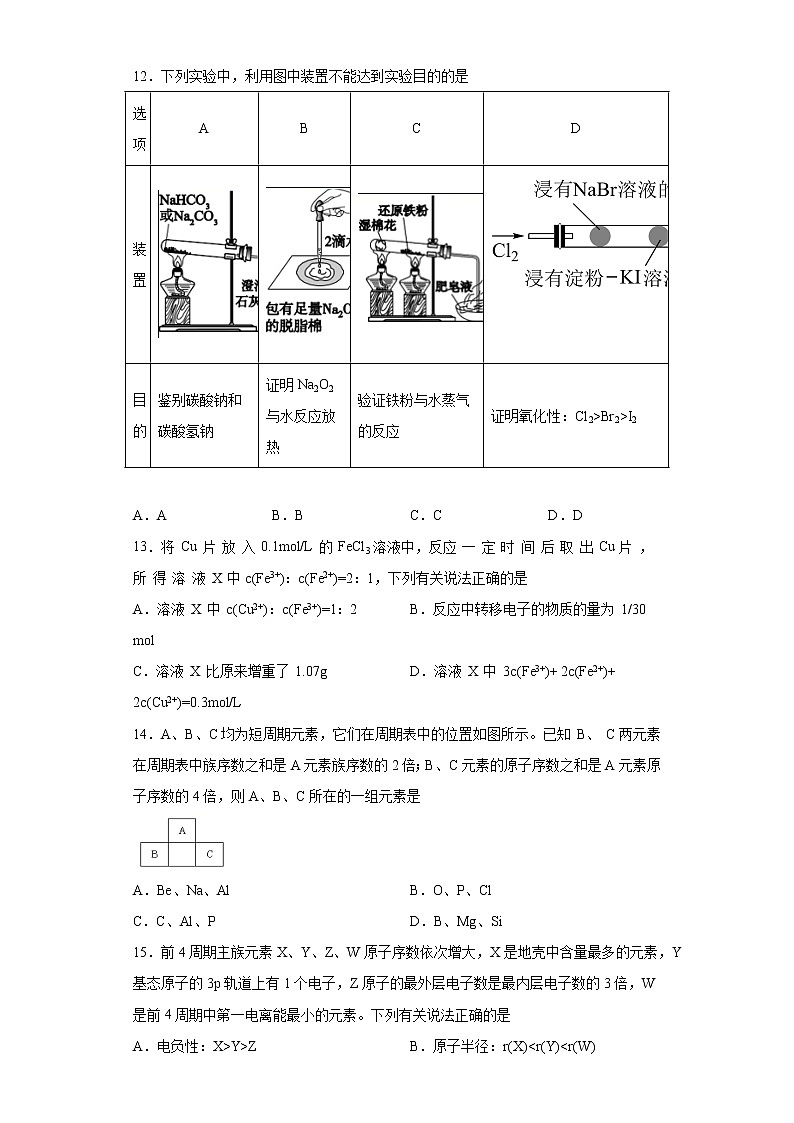
12.下列实验中,利用图中装置不能达到实验目的的是
选项 | A | B | C | D |
装置 |
| |||
目的 | 鉴别碳酸钠和碳酸氢钠 | 证明Na2O2与水反应放热 | 验证铁粉与水蒸气的反应 | 证明氧化性:Cl2>Br2>I2 |
A.A B.B C.C D.D
13.将 Cu 片 放 入 0.1mol/L 的 FeCl3溶液中,反应 一 定 时 间 后 取 出 Cu片 , 所 得 溶 液 X 中c(Fe3+):c(Fe2+)=2:1,下列有关说法正确的是
A.溶液 X 中 c(Cu2+):c(Fe3+)=1:2 B.反应中转移电子的物质的量为 1/30 mol
C.溶液 X 比原来增重了 1.07g D.溶液 X 中 3c(Fe3+)+ 2c(Fe2+)+ 2c(Cu2+)=0.3mol/L
14.A、B、C均为短周期元素,它们在周期表中的位置如图所示。已知 B、 C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是
A.Be、Na、Al B.O、P、Cl
C.C、Al、P D.B、Mg、Si
15.前4周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y基态原子的3p轨道上有1个电子,Z原子的最外层电子数是最内层电子数的3倍,W是前4周期中第一电离能最小的元素。下列有关说法正确的是
A.电负性:X>Y>Z B.原子半径:r(X)<r(Y)<r(W)
C.最高价氧化物对应水化物的碱性:Y>W D.简单氢化物的熔沸点:X<Z
二、填空题(4大题)
16.为除去粗盐中的Ca2+、Mg2+、以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
称取粗盐滤液粗盐
(1)第①步中,操作A是_________,第⑤步中,操作B是_________。
(2)第④步中,写出相应的离子方程式(假设粗盐溶液中Ca2+的主要存在形式为CaCl2)__________________,______________________。
(3)若先用盐酸调pH调至中性,再过滤,将对实验结果产生影响,其原因是_____________________。
(4)判断BaCl2已过量的方法是__________________________________________。
17.亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,溶于浓硫酸不分解。
(1)装置A制取SO2
①A中反应的化学方程式为_______。
②导管b的作用是_______。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①装置B中的三颈烧瓶应放在_______(填“冷水”或“温水”)浴中。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是_____。
(3)装置C的主要作用是_______(用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是_______。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入碘量瓶中,加入含有0.006mol KMnO4的过量KMnO4标准溶液和25%的H2SO4溶液,然后摇匀。用0.2500mol·L−1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①完成并配平:++____=Mn2++____+H2O,_______。
②滴定终点时的现象为_______。
③亚硝酰硫酸的纯度=_______。(精确到0.1%)[M(NOSO4H)=127g·mol−1]
18.实验室欲配制480mL0.5mol·L-1的CuSO4溶液,据此回答下列问题:
(1)需称量胆矾CuSO4.5H2O__g。
(2)在配制的过程中一定不需要使用到的仪器是(填写代号)__,还缺少的仪器有__、__。
A.烧杯 B.药匙 C.玻璃棒 D.1000mL容量瓶 E.锥形瓶 F.胶头滴管
(3)如图所示的实验操作的先后顺序为__。
(4)从配制好的CuSO4溶液中取出10mL,将这10mL的CuSO4溶液稀释至100mL,稀释后CuSO4溶液的浓度变为__mol·L-1。
(5)下列的实验操作可能导致配制的溶液浓度偏低的是__。
A.容量瓶内原来存有少量的水
B.定容时液面超过刻度线,用胶头滴管吸出
C.称量所需CuSO4.5H2O的质量时,物品与砝码的位置放反了(1g以下用游码)
D.定容时俯视刻度线
19.在学习元素周期表和元素周期律后,某化学兴趣小组在老师的指导下,设计实验以探究元素性质的递变规律。
Ⅰ.为了验证卤族部分元素递变规律,设计如图装置进行实验。
(1)指出溴元素在周期表中的位置___________;
(2)A中发生反应的离子方程式是___________;
(3)A中通入Cl2充分反应后,将A中液体滴入试管内,取下试管,充分振荡,静置,可观察到的现象是___________。
(4)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是___________。
(5)下列性质的递变正确,且能作为卤族元素非金属性递变规律判断依据的是___________。(填写序号)
a.Cl2、Br2、I2的熔点逐渐升高b.HCl、HBr、HI的稳定性逐渐减弱
c.HCl、HBr、HI的酸性逐渐减弱d.Cl-、Br-、I-的还原性逐渐增强
Ⅱ.为了验证非金属性:N>C>Si,该兴趣小组又设计如下装置,实验所用到的物质有:①稀HNO3②稀盐酸③碳酸钙④Na2SiO3溶液⑤饱和NaHCO3溶液,已知H2SiO3不溶于水。据此回答以下问题。
(6)分液漏斗内装入的试剂为___________(填序号),B中装入的试剂为___________(填序号)
(7)烧杯C中发生反应的离子方程式为___________。
参考答案
1.B
2.C
3.A
4.A
5.A
6.A
7.C
8.C
9.A
10.D
11.A
12.D
13.D
14.B
15.B
16.溶解 过滤 Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓ 操作③④中生成的Mg(OH)2、CaCO3、BaCO3沉淀会与盐酸反应生成可溶物质而无法过滤除去,从而影响精盐的纯度 取少量第②步后的上层清液,滴入几滴BaCl2溶液,看是否有白色沉淀生成,若无沉淀生成,则表明BaCl2已过量
17.Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ 平衡压强,使分液漏斗中的液体能顺利流下 冷水 生成的NOSO4H作为该反应的催化剂 SO2+2OH−=+H2O C装置中的水蒸气会进入B中使NOSO4H分解 2+5+16H+=2Mn2++10CO2↑+8H2O 溶液恰好由紫红色变为无色,且半分钟内不恢复 92.0%
18.62.5g DE 500mL容量瓶 托盘天平 ④⑥②⑤③① 0.05mol/L BC
19.第四周期第ⅦA族 2Br-+Cl2=Br2+2Cl- 溶液分层,上层几乎无色,下层呈紫红色 氯气通入少(适)量 bd ① ⑤ CO2+H2O+=H2SiO3↓+
2021年高一上学期化学期末复习题(2019人教版化学必修一1)教案: 这是一份2021年高一上学期化学期末复习题(2019人教版化学必修一1)教案,共7页。教案主要包含了单选题,填空题等内容,欢迎下载使用。
2021年高一上学期化学期末复习题(必修一2019人教版)教案: 这是一份2021年高一上学期化学期末复习题(必修一2019人教版)教案,共7页。教案主要包含了单选题,填空题等内容,欢迎下载使用。
2021年高一上学期化学期末复习题(2019人教版必修一) (2)教案: 这是一份2021年高一上学期化学期末复习题(2019人教版必修一) (2)教案,共7页。教案主要包含了单选题,填空题等内容,欢迎下载使用。












